




2024届高三化学一轮复习课件:化学平衡移动
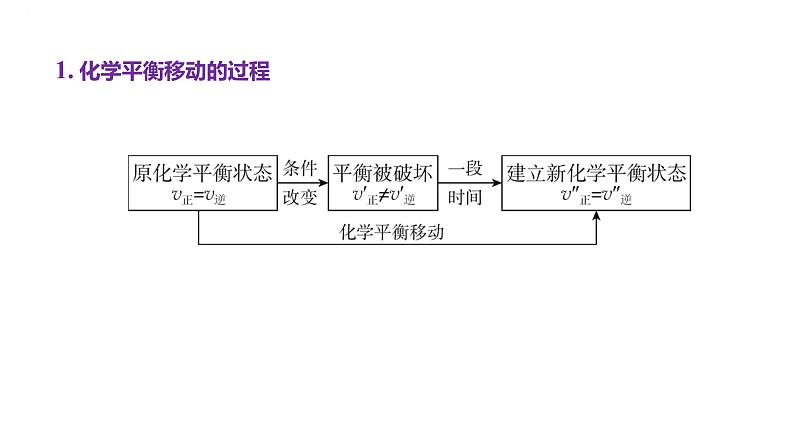
展开1. 化学平衡移动的过程
2.平衡移动方向的判断(1)根据速率判断①若v正 v逆,则平衡向正反应方向移动。 ②若v正 v逆,则平衡不移动。 ③若v正 v逆,则平衡向逆反应方向移动。 (2)根据体系中各组分含量的变化判断平衡移动的结果,如果是使体系中产物含量(如物质的量、浓度或百分含量等) ,则平衡正向移动;反之则逆向移动。
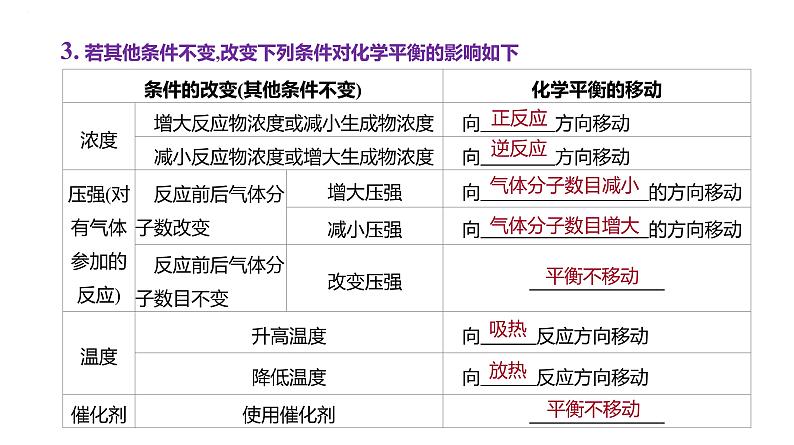
3. 若其他条件不变,改变下列条件对化学平衡的影响如下
4. 勒夏特列原理如果改变影响平衡的一个因素(如浓度、压强或温度),平衡将向能够 这种改变的方向移动,也称化学平衡移动原理。 5.几种特殊情况(1)当反应混合物中存在与其他物质不相混溶的固体或液体物质时,由于其“浓度”是恒定的,不随其量的增减而变化,故改变这些固体或液体的量,对化学平衡无影响。(2)对于反应前后气态物质的化学计量数相等的反应,压强的变化对正、逆反应速率的影响程度是等同的,故平衡不移动。
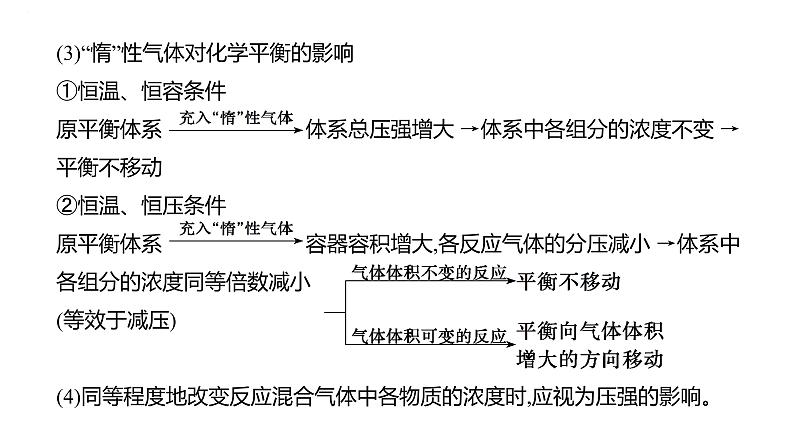
(3)“惰”性气体对化学平衡的影响①恒温、恒容条件原平衡体系 体系总压强增大 →体系中各组分的浓度不变 →平衡不移动②恒温、恒压条件原平衡体系 容器容积增大,各反应气体的分压减小 →体系中各组分的浓度同等倍数减小(等效于减压)(4)同等程度地改变反应混合气体中各物质的浓度时,应视为压强的影响。
[解析]化学反应速率改变,化学平衡不一定发生移动,如加催化剂,错误。
1.判断正误(正确的打“√”,错误的打“×”)(1)化学平衡发生移动,化学反应速率一定改变;化学反应速率改变,化学平衡也一定发生移动( )
(2)升高温度,平衡向吸热反应方向移动,此时v放减小,v吸增大( )
[解析]升高温度,平衡向吸热反应方向移动,此时v放、v吸均增大,错误。
(3)C(s)+CO2(g) ⇌2CO(g) ΔH>0,其他条件不变时,升高温度,反应速率v(CO2)和CO2的平衡转化率均增大( )
(4)化学平衡正向移动,反应物的转化率不一定增大 ( )(5)向平衡体系FeCl3+3KSCN ⇌Fe(SCN)3+3KCl中加入适量KCl固体,平衡逆向移动,溶液的颜色变浅( )
(6)对于2NO2(g) ⇌ N2O4(g)的平衡体系,压缩体积,增大压强,平衡正向移动,混合气体的颜色变浅( )
[解析]向平衡体系FeCl3+3KSCN ⇌Fe(SCN)3+3KCl中加入适量KCl固体,实际参加反应的离子浓度不变,平衡不移动,错误。
[解析]对于2NO2(g) ⇌ N2O4(g)的平衡体系,压缩体积,增大压强,平衡正向移动,但混合气体的颜色加深,错误。
[解析]移出部分CO2,平衡正向移动,故A正确;此反应为放热反应,提高反应温度,平衡逆向移动,故B错误;加入合适的催化剂,对平衡没有影响,故C错误;该反应为前后气体分子数不变的反应,减小容器的容积,平衡不移动,故D错误。
1.将等物质的量的N2、H2充入某密闭容器中,在一定条件下,发生如下反应并达到平衡:N2(g)+3H2(g) ⇌2NH3(g) ΔH<0。当改变某个条件并维持新条件直至达到新的平衡时,下表中关于新平衡与原平衡的比较正确的是 ( )
题组一 化学平衡的影响因素
[解析]正反应是气体分子数减小的反应,依据勒夏特列原理可知增大压强平衡向正反应方向移动,但氮气的浓度仍然比原平衡大,A不正确;正反应是放热反应,则升高温度平衡向逆反应方向移动,氮气的转化率减小,B正确;充入一定量的氢气,平衡向正反应方向移动,氮气的转化率增大,而氢气的转化率减小,C不正确;催化剂只能改变反应速率而不能改变平衡状态,D不正确。
2.某温度下,在一恒容密闭容器中进行如下两个反应并达到平衡:①2X(g)+Y(g) ⇌ Z(s)+2Q(g) ΔH1<0②M(g)+N(g) ⇌ R(g)+Q(g) ΔH2>0下列叙述错误的是 ( )A.加入适量Z,①和②平衡均不移动B.通入稀有气体Ar,①平衡正向移动C.降温时无法判断Q浓度的增减D.通入气体Y,则N的浓度增大
[解析] Z为固体,加入适量Z不影响反应①的平衡移动,而反应②与Z无关,故加入Z也不影响反应②的平衡移动,A正确;通入稀有气体Ar,由于容器容积不变,故反应气体浓度不发生改变,反应①的平衡不移动,B错误;温度降低,反应①正向进行,反应②逆向进行,但两个反应中反应物的起始浓度未知,温度对两个反应的影响程度也不同,故无法判断Q浓度的增减,C正确;通入气体Y,反应①平衡正向移动,Q的浓度增大,导致反应②平衡逆向移动,则N的浓度增大,D正确。
[规律小结]平衡移动就是由一个“平衡状态→不平衡状态→新平衡状态”的过程。
题组二 平衡移动图像分析
1.对于可逆反应:2A(g)+B(g) ⇌ 2C(g) ΔH<0,下列图像不正确的是 ( ) A BC D
[解析] ΔH<0,升高温度,正逆反应速率均增大,平衡逆向移动,A的转化率减小,故温度较高时达平衡C%较小,且温度高时速率较大,达到平衡所需时间较短,故A正确、B错误;
当压强相同时,温度较高时,A的平衡转化率较小,且压强增大,平衡正向移动,A的平衡转化逐渐增大,故C正确;两曲线交点表示该条件下的平衡状态,继续增大压强,正逆反应速率都增大,平衡向正反应方向移动,即v正>v逆,故D正确。
2. T ℃时,向绝热恒容密闭容器中通入a ml SO2和b ml NO2,一定条件下发生反应:SO2(g)+NO2(g) ⇌ SO3(g)+NO(g) ΔH<0,测得SO3的浓度随时间变化如图所示。下列说法不正确的是 ( )A.容器内压强不再改变说明反应已达平衡B.SO3在40~50 s内的平均反应速率大于50~60 s内的平均反应速率C.NO2速率:v正(t=80 s时)大于v逆(t=60 s时)D.T ℃时,若在恒温恒容下,向原容器通入a ml SO2和b ml NO2,达到平衡时c(SO3)>0.33 ml·L-1
由图像可知反应在60 s及80 s时总反应都是正向进行,这两个时刻都是正反应速率大于逆反应速率,又由于t=80 s时比t=60 s,生成物浓度大,反应温度升高,所以NO2速率:v正(t=80 s时)>v逆(t=80 s时)>v逆(t=60 s时),C项正确;该反应的正反应是放热反应,降低温度,化学平衡向放热的正反应方向移动,根据图像可知:在绝热恒容条件下反应达到平衡时SO3的浓度为0.33 ml·L-1,所以反应若在恒温恒容的容器内进行,反应达到平衡后SO3的浓度大于0.33 ml·L-1,D项正确。
1. 含“断点”的反应速率—时间图像分析
2.含量—时间—温度(压强)图像常见图像形式有如下几种,其中C%指生成物的百分含量,B%指反应物的百分含量。(1) (2)
(3) (4) (5)
3.转化率(或质量分数)与压强—温度图像(1)恒压线图像图甲中,当压强相等(任意一条等压线)时,升高温度,A的转化率增大,说明升高温度平衡正向移动,即正反应为吸热反应。当温度相等时,在图中作垂直于横坐标的直线,与三条等压线交于三点,这三点自下而上为增大压强,A的转化率增大,说明增大压强平衡正向移动,即正反应为气体分子数减小的反应。
(2)恒温线图像图甲中,当温度相等(任意一条等温线)时,增大压强,A的转化率增大,说明增大压强平衡正向移动,即正反应是气体分子数减小的反应。当压强相等时,在图中作垂直于横坐标的直线,与两条等温线交于两点,这两点自下而上为降低温度,A的转化率增大,说明降低温度平衡正向移动,即正反应为放热反应。
1.判断正误(正确的打“√”,错误的打“×”)(1)图①表示p2>p1,正反应为气体分子数增大的反应( )(2)图②表示随温度升高,吸热反应的平衡常数变化( )
[解析]温度升高,K减小,平衡向逆反应方向移动,正反应为放热反应。
(3)图③若表示p2>p1,可逆反应的正反应为气体分子数减小的吸热反应( )(4)图④表示可逆反应的正反应为吸热反应( )
[解析]升高温度,生成物百分含量增多,平衡向正反应方向移动,正反应为吸热反应;p2→p1,减小压强,生成物百分含量增多,平衡向正反应方向移动,正反应为气体分子数增多的反应。
[解析]升高温度v逆>v正,说明平衡向逆反应方向移动,正反应为放热反应。
2.在2 L恒容密闭容器中充入2 ml X 和1 ml Y发生反应:2X(g)+Y(g) ⇌3Z(g),反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是 ( )A.Q点时,Y的转化率最大B.W点的正反应速率等于M点的正反应速率C.升高温度,平衡常数增大D.温度一定,平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大
[解析]由图可知,Q点X的体积分数φ(X)最小,则最低点Q为平衡点,Q点后升高温度,φ(X)增大,平衡逆向移动,Y的转化率降低,故Q点时Y的转化率最大,A正确;W、M两点的φ(X)相同,但M点的温度高于W点的温度,故M点的正反应速率较大,B错误;升高温度,平衡逆向移动,平衡常数减小,C错误;该反应前后气体分子数不变,温度一定,平衡时充入Z,达到的新平衡与原平衡是等效的,故达到平衡时Z的体积分数不变,D错误。
1.可逆反应A(g)+3B(g) ⇌ 2C(g) ΔH<0。该反应的速率与时间的关系如图所示:如果t2、t4、t6、t8时都只改变了一个反应条件,则对应t2、t4、t6、t8时改变的条件正确的是( )A.增大反应物浓度、使用了催化剂、减小压强、升高温度B.升高温度、减小压强、增大反应物浓度、使用了催化剂C.使用了催化剂、增大压强、减小反应物浓度、降低温度D.升高温度、减小压强、减小反应物浓度、使用了催化剂
题组一 反应速率—时间图像
[解析]该反应的正反应为气体分子数减小的放热反应,t2时刻正逆反应速率均增大,逆反应速率增大的程度更大,平衡逆向移动,说明t2时改变的条件为升高温度;t4为减压,正逆反应速率均减小,平衡逆向移动;t6时刻逆反应速率不变,正反应速率突然增大,说明t6时增大了反应物浓度;t8时刻正逆反应速率同等程度增大,说明加入了催化剂。综上分析可知B项正确。
[题后反思] 分析反应速率-时间图像,要注意判断以下几点:(1)图像连续还是不连续:连续一般是浓度改变影响的,不连续则是其他条件影响(判断改变条件)的。(2)图像上移还是下移:上移速率变大,下移速率变小(判断速率变化)。(3)达到新平衡前v正大还是v逆大:若v正>v逆,则平衡正移;若v正
题组二 物质的量(浓度)—时间图像
[方法技巧] 有关“拐点”图像的分析方法同一可逆反应,若反应条件不同,达到平衡所用的时间也可能不同,对应图像出现“拐点”的时间也就有差异。图像中先出现“拐点”的反应先达到平衡,即反应所处的外界条件(温度、压强)相对要高一些,或者是加入了催化剂。
1.用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g) ⇌CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是 ( )A.温度:T1>T2>T3B.正反应速率:v(a)>v(c)、v(b)>v(d)C.平衡常数:K(a)>K(c)、K(b)=K(d)D.平均摩尔质量:M(a)
题组三 转化率—温度(压强)图像
[解析]此反应为放热反应,压强相同时,温度越高,CO的平衡转化率越低, 所以T1
2024届高三化学高考备考一轮复习专题:化学平衡状态 化学平衡的移动课件: 这是一份2024届高三化学高考备考一轮复习专题:化学平衡状态 化学平衡的移动课件,共29页。PPT课件主要包含了正反应,逆反应,化学平衡状态,不再改变,3特征,浓度或百分含量,正反应方向,不发生,逆反应方向,勒夏特列原理等内容,欢迎下载使用。
2024届高三化学第一轮复习:7.2.2化学平衡移动及影响因素课件: 这是一份2024届高三化学第一轮复习:7.2.2化学平衡移动及影响因素课件,共35页。PPT课件主要包含了知识梳理·题型构建,化学平衡移动,谁快向谁移,②规律,加压前,刚加压时,加压后,催化剂,②图象,356×104等内容,欢迎下载使用。
人教版高考化学一轮复习7.2化学平衡状态化学平衡移动课件: 这是一份人教版高考化学一轮复习7.2化学平衡状态化学平衡移动课件












