




2024届高考化学一轮复习 第三章 金属及其化合物 第4讲 高考常考查的两性金属及变价金属课件PPT
展开这是一份2024届高考化学一轮复习 第三章 金属及其化合物 第4讲 高考常考查的两性金属及变价金属课件PPT,共53页。PPT课件主要包含了答案A,3氢氧化钒等内容,欢迎下载使用。
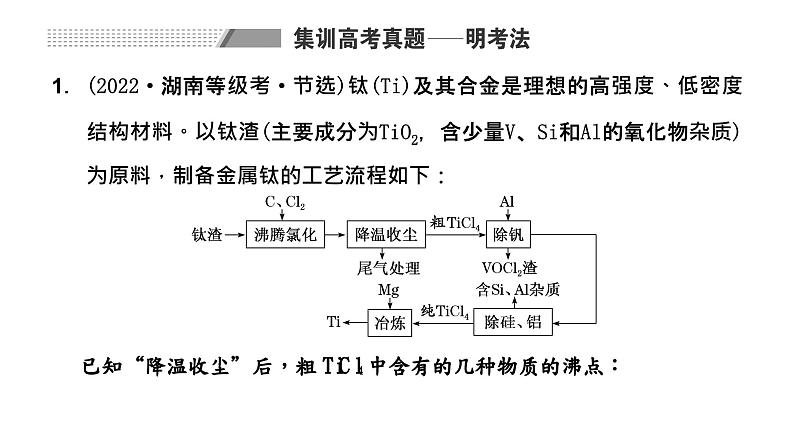
1.(2022·湖南等级考·节选)钛(Ti)及其合金是理想的高强度、低密度结构材料。以钛渣(主要成分为TiO2,含少量V、Si和Al的氧化物杂质)为原料,制备金属钛的工艺流程如下:
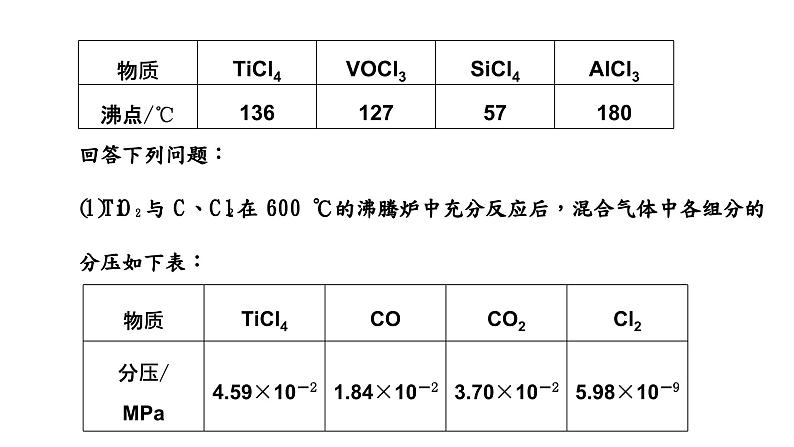
①该温度下,TiO2与C、Cl2反应的总化学方程式为___________________;②随着温度升高,尾气中CO的含量升高,原因是____________________。(2)“除钒”过程中的化学方程式为________________________;“除硅、铝”过程中,分离TiCl4中含Si、Al杂质的方法是________________。(3)“除钒”和“除硅、铝”的顺序________(填“能”或“不能”)交换,理由是____________________。(4)下列金属冶炼方法与本工艺流程中加入Mg冶炼Ti的方法相似的是________。A.高炉炼铁 B.电解熔融氯化钠制钠C.铝热反应制锰 D.氧化汞分解制汞
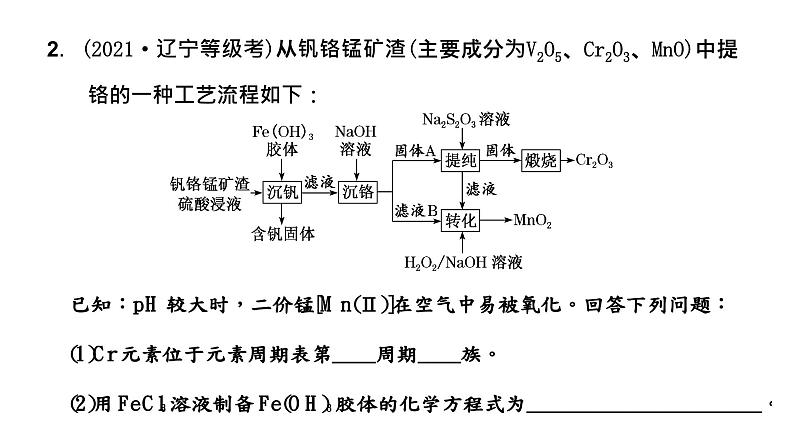
2.(2021·辽宁等级考)从钒铬锰矿渣(主要成分为V2O5、Cr2O3、MnO)中提铬的一种工艺流程如下:
(3)常温下,各种形态五价钒粒子总浓度的对数[lg c总(V)]与pH关系如图1。已知钒铬锰矿渣硫酸浸液中c总(V)=0.01 ml·L-1,“沉钒”过程控制pH=3.0,则与胶体共沉降的五价钒粒子的存在形态为_______________(填化学式)。
(4)某温度下,Cr(Ⅲ)、Mn(Ⅱ)的沉淀率与pH关系如图2。“沉铬”过程最佳pH为________;在该条件下滤液B中c(Cr3+)=________ml·L-1[Kw近似为1×10-14,Cr(OH)3的Ksp近似为1×10-30]。(5)“转化”过程中生成MnO2的离子方程式为_____________________________________________________________________________________。(6)“提纯”过程中Na2S2O3的作用为___________________________________________________________________________________________。
解析:分析工艺流程图可知,“沉钒”步骤中使用氢氧化铁胶体吸附含有钒的杂质,滤液中主要含有Mn2+和Cr3+,加热NaOH“沉铬”后,Cr3+转化为固体A为Cr(OH)3沉淀,滤液B中主要含有MnSO4,加入Na2S2O3主要是防止pH较大时,二价锰[Mn(Ⅱ)]被空气中氧气氧化,Cr(OH)3煅烧后生成Cr2O3,“转化”步骤中反应的离子方程式为Mn2++H2O2+2OH-===MnO2+2H2O,据此分析解题。(1)Cr是24号元素,价层电子排布为3d54s1,根据最高能层数等于周期序数,价电子数等于族序数,故Cr元素位于元素周期表第4周期ⅥB族。
提能点(一) 两性金属(Be、Zn)及其重要化合物 (一)铍(Be)、锌(Zn)类似铝的化学性质
[综合应用训练]1.铝、铍及其化合物具有相似的化学性质,已知反应:BeCl2+Na2BeO2+2H2O===2NaCl+2Be(OH)2↓能完全进行,则下列推断正确的是 ( )A.Be(OH)2既能溶于盐酸,又能溶于NaOH溶液B.因BeCl2水溶液的导电性强,故BeCl2是离子化合物C.常温下Na2BeO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为BeOD.常温下BeCl2溶液的pH>7,将其蒸干并灼烧后得到的残留物是BeCl2
解析:铝、铍及其化合物具有相似的化学性质,Be(OH)2与Al(OH)3性质相似,Be(OH)2既能溶于盐酸,又能溶于NaOH溶液,A正确;某些共价化合物水溶液的导电性也较强,B错误;Na2BeO2溶液蒸干灼烧后得到Na2BeO2,C错误;常温下BeCl2溶液的pH<7,蒸干并灼烧后得到的残留物是BeO,D错误。
2.下列各组溶液,不用外加试剂就可以鉴别的是__________(填序号)。①AlCl3溶液与氨水 ②ZnSO4溶液与氨水③Al2(SO4)3溶液与NaOH溶液④Na2CO3溶液与稀盐酸⑤Na2ZnO4溶液与稀盐酸⑥ZnCl2溶液与NaOH溶液⑦Na2CO3溶液与CaCl2溶液答案:②③④⑤⑥
3.锌和铝都是活泼金属,其氢氧化物既能溶于强酸溶液,又能溶于强碱溶液,但是Al(OH)3不溶于氨水,而Zn(OH)2能溶于氨水,生成[Zn(NH3)4]2+。回答下列问题:(1)单质铝溶于NaOH溶液后,溶液中铝元素的存在形式为________(用化学式表示)。(2)写出锌和NaOH溶液反应的离子方程式:________________________________________________________________________________。
(3)下列各组中的两种溶液,用相互滴加的实验方法可以鉴别的是________(填序号)。①Al2(SO4)3和NaOH ②Al2(SO4)3和氨水③ZnSO4和NaOH ④ZnSO4和氨水(4)写出可溶性铝盐和氨水反应的离子方程式:__________________________________________________________________________________。试解释实验室不宜用可溶性锌盐与氨水反应制取氢氧化锌的原因:_____________________________________________________________。
提能点(二) 变价金属及其化合物(一)钛、钒、铬、锰及其化合物的性质1.钛及其化合物的性质
2.钒及其化合物的性质(1)钒单质具有耐酸性,在空气中不易被氧化,可溶于氢氟酸、硝酸和王水。
(2)钒的氧化物钒的常见化合价为+2、+3、+4、+5,对应氧化物分别为VO、V2O3、VO2和V2O4、V2O5。钒的氧化物的化学性质
相关反应的离子方程式:
4.锰及其化合物的性质锰元素的常见价态有+7、+6、+4、+3、+2,Mn2+在酸性溶液中的稳定性强于在碱性溶液中的稳定性。(1)Mn2+:存在于酸性条件;在碱性条件下,Mn2+易被氧化为MnO2等,如 ClO-+Mn2++2OH-===Cl-+MnO2↓+H2O。
[综合应用训练]1.金属钒被誉为“合金的维生素”。从废钒(主要成分为V2O5、Fe2O3、SiO2等)中回收V2O5的一种工艺流程如图所示:
回答下列问题:(1)步骤①酸浸过程中发生氧化还原反应的化学方程式为_________________________________ ,滤渣的成分为____________。(2)萃取时应加入适量碱的作用是__________________________________。(3)步骤④中反应的离子方程式为__________________________________。
2.锰酸锂是较有前景的锂离子电池正极材料之一。工业上用某软锰矿(主要成分为MnO2,还含有少量铁、铝及硅等的氧化物)为原料制备锰酸锂(LiMn2O4)。工艺流程如图甲:
(2)“浸取”得到的浸取液中阳离子主要是Mn2+,生成Mn2+的离子方程式为_______________________________________________。(3)滤渣Ⅱ的主要成分是____________________;“精制”中加入H2O2的量比理论值大得多,其主要原因是______________________________。 (4)“沉锰”得到的是Mn(OH)2和Mn2(OH)2SO4滤饼,二者均可被氧化为MnO2,若“控温、氧化”时溶液的pH随时间的变化如图乙所示,pH下降的原因是____________________________________________(用化学方程式表示)。
解析:软锰矿加入H2SO4、FeSO4浸取后,MnO2被还原为Mn2+,Fe、Al的氧化物转化为Fe2+、Fe3+、Al3+,SiO2不溶解,以滤渣Ⅰ的形式离开体系;加入H2O2、MnO后,Fe2+、Fe3+、Al3+转化为Fe(OH)3、Al(OH)3沉淀,以滤渣Ⅱ的形式离开体系;加入氨水后,Mn2+转化为Mn(OH)2和Mn2(OH)2SO4,经过“控温、氧化”“锂化”后得到产品。答案:(1)适当升温;适当增加浸取剂浓度;搅拌(任写两种,合理即可)(2)MnO2+2Fe2++4H+===Mn2++2Fe3++2H2O(3)Al(OH)3、Fe(OH)3 H2O2在Fe3+的催化作用下部分分解(4)Mn2(OH)2SO4+O2===2MnO2+H2SO4
(二)铁、钴、镍的化合物含铁、钴、镍元素的物质性质比较
[综合应用训练]3.(2023·德州模拟)水钴矿主要成分为COOH,同时含有少量Fe、Al、Mn、Mg、Ca、Ni的氧化物及其他杂质。用水钴矿制取C的工艺流程如图甲所示:
已知部分阳离子形成氢氧化物沉淀时,溶液pH见表:
请回答下列问题:(1)“还原酸浸”中发生的氧化还原反应的化学方程式是______________,浸出液中加入NaClO溶液的目的:___________________________________________________________________________(用离子方程式表示)。(2)浸出过程中加入Na2CO3调pH的范围是______________。(3)如图乙所示,萃取剂可以把滤液Ⅱ中部分阳离子选择性分离。萃取剂合适的pH为________(填字母)。A.2~3 B.3~4C.6~7 D.7~8
(4)C能与强酸反应产生H2,工业上采用惰性电极电解CCl2溶液制取钴,不能用CSO4溶液代替CCl2溶液的理由是________________________________________________________________________________________。解析:(1)由分析可知,还原酸浸中发生的氧化还原反应为酸性条件下,COOH与硫代硫酸钠溶液反应生成硫酸钠、硫酸钴和水;向浸出液中加入次氯酸钠溶液的目的是将亚铁离子氧化为铁离子。(2)由分析可知,浸出过程中加入碳酸钠溶液调节pH在5.2~7.6的范围内,可将铁离子和铝离子转化为氢氧化铁和氢氧化铝沉淀,而C2+、Mn2+没有沉淀。(3)由图乙可知,pH在3~4范围内,镍离子、锰离子的萃取率很大,而钴离子的萃取率较小,B正确。
答案:(1)8COOH+Na2S2O3+7H2SO4===8CSO4+Na2SO4+11H2OClO-+2Fe2++2H+===Cl-+2Fe3++H2O(2)5.2≤pH<7.6 (3)B(4)若用CSO4代替CCl2,OH-在阳极放电,H+与C反应,导致C产率降低
相关课件
这是一份2025版高考化学一轮复习真题精练第三章金属及其化合物第6练以金属元素为主体考查物质的性质与应用课件,共13页。PPT课件主要包含了新考法等内容,欢迎下载使用。
这是一份2025版高考化学一轮复习真题精练第三章金属及其化合物第7练结合实验考查金属及其化合物课件,共13页。PPT课件主要包含了新考法等内容,欢迎下载使用。
这是一份2025版高考化学一轮复习真题精练第三章金属及其化合物第8练结合无机工艺流程考查金属及其化合物课件,共15页。PPT课件主要包含了流程梳理,新考法等内容,欢迎下载使用。












