

四川省达州市万源中学2023-2024学年高二化学上学期第一次考试试题(Word版附答案)
展开四川省万源中学高2025届高二(上)10月考试
化学试题
考试时间:75分钟 总分:100分
.可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Cl 35.5
第I卷(选择题,共42分)
一、选择题(每个小题仅有一个正确答案,每小题3分)
1. 2023年7月国内海拔最高、区域最广的丹霞地貌景区配套设施—四川省甘孜州新龙红山景区正式开园,丹霞地貌的岩层呈红色是因为含
A.Fe(OH)3 B.Fe(OH)2 C.FeO D.Fe2O3
2.下列说法正确的是
A.ΔH<0、ΔS>0的反应在温度低时不能自发进行
B.NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) ΔH=+185.57 kJ/mol能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
C.焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D.催化剂不影响反应的活化能,但能增大活化分子百分数,从而增大反应速率
3. 根据热化学方程式S(s)+O2(g)═SO2(g)△H=﹣297.23kJ•mol﹣1,分析下列说法正确的是
A.S(g)═ S(s)△H>0
B.S(g)+O2(g)═SO2(g)|△H|=297.23 kJ•mol﹣1
C.S(g)+O2(g)═SO2(g)|△H|<297.23 kJ•mol﹣1
D.1 mol SO2(g)所具有的能量小于1 mol S(s)与1 mol O2(g)所具有的能量之和
4. 25℃、101kPa时,强酸与强碱的稀溶液发生中和反应生成1mol液态水的反应热,石墨的燃烧热 ,乙醇的燃烧热ΔH=-1366.8kJ/mol。下列热化学方程式书写正确的是
A.
B.
C.C(石墨)+ O2(g)= CO(g)△H=-393.5kJ/mol
D.
5. 已知483K时,反应CO(g)+2H2(g)=CH3OH(g) △H<0的K=14.5。在483 K,将1.0 mol的CO(g)和1.0 mol的H2(g)充入容积为2.0 L的恒容密闭容器中。在反应达到平衡时,以下说法正确的是
A.c(H2)=2c(CO) B.c(CO)=c(CH3OH)<c(H2)
C.c(H2)<c(CO) D.c(CO)=c(CH3OH)=c(H2)
6. 已知反应2NO(g)+2H2(g)N2(g)+2H2O(g)△H=-752kJ·mol-1的反应机理如下:
①2NO(g)N2O2(g)(快) ②N2O2(g)+H2(g)N2O(g)+H2O(g)(慢)
③N2O(g)+H2(g)N2(g)+H2O(g)(快)
下列有关说法错误的是
A.增大H2(g)的浓度能增大单位体积内气体的活化分子数,有效碰撞次数增多,速率加快
B.该反应的速率主要取决于②的快慢
C.N2O2和N2O是该反应的催化剂
D.总反应中逆反应的活化能比正反应的活化能大
7. 已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOHCH3COO-+H+,要使溶液中值增大,可以采取的措施是
①加少量烧碱固体 ②升高温度 ③加少量冰醋酸 ④加水
A.①② B.②③ C.②④ D.③④
8. 如右图,在注射器中加入少量晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是
A.蓝色石蕊试纸先变红后褪色
B.品红试纸、蘸有酸性KMnO4溶液的滤纸均 褪色,证明SO2具有漂白性
C.湿润的淀粉试纸未变蓝说明SO2的氧化性弱于
D.饱和NaCl溶液可用于除去实验中多余的SO2
9. 根据能量变化示意图,下列热化学方程式正确的是
A.2NH3(l)=N2(g)+3H2(g) ΔH=2(b+c-a)kJ·mol-1
B.2NH3(l)=N2(g)+3H2(g) ΔH=2(a+b-c)kJ·mol-1
C.N2(g)+3H2(g)=2NH3(g) ΔH=-(b-a)kJ·mol-1
D.N2(g)+3H2(g)=2NH3(g) ΔH=-(a-b)kJ·mol-1
10. 已知NaHCO3溶液与盐酸反应生成CO2吸热,Na2CO3溶液与盐酸反应生成CO2放热。下列关于的判断正确的是
A. B.
C. D.
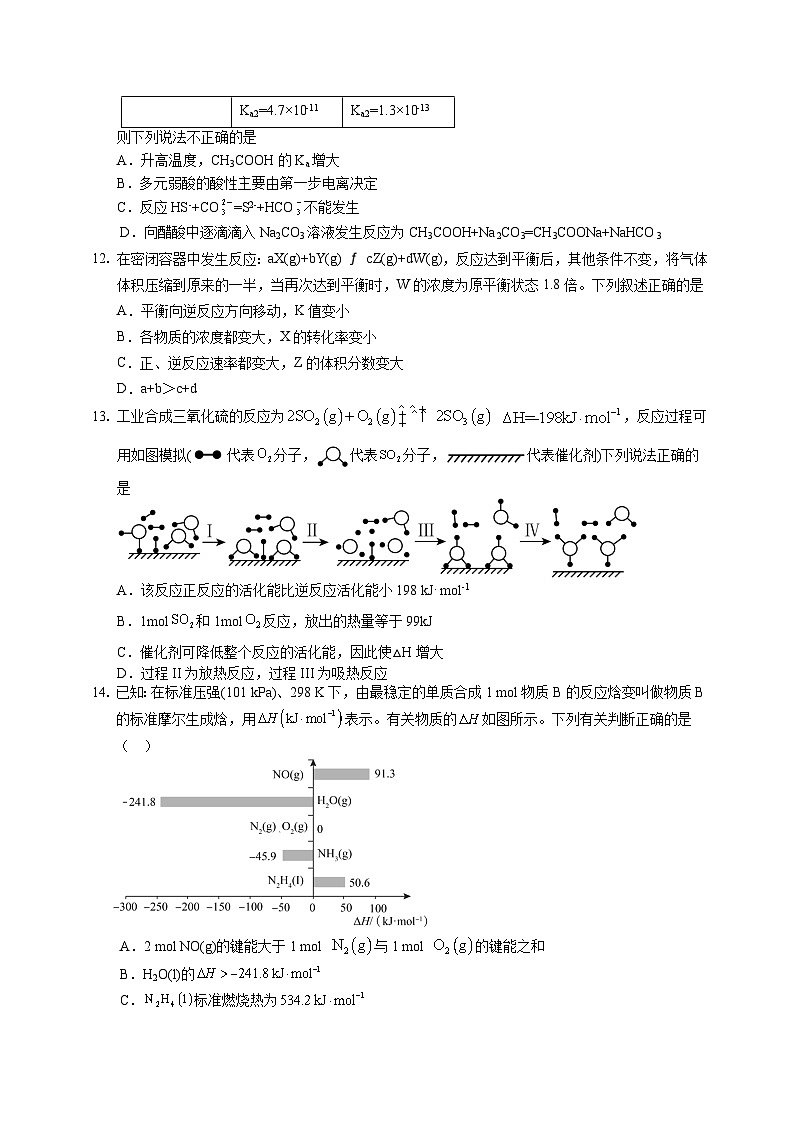
11. 表中是几种弱酸在常温下的电离平衡常数:
CH3COOH | H2CO3 | H2S |
Ka=1.75×10-5 | Ka1=4.5×10-7 Ka2=4.7×10-11 | Ka1=1.1×10-7 Ka2=1.3×10-13 |
则下列说法不正确的是
A.升高温度,CH3COOH的Ka增大
B.多元弱酸的酸性主要由第一步电离决定
C.反应HS-+CO=S2-+HCO不能发生
D.向醋酸中逐滴滴入Na2CO3溶液发生反应为CH3COOH+Na2CO3=CH3COONa+NaHCO3
12. 在密闭容器中发生反应:aX(g)+bY(g) cZ(g)+dW(g),反应达到平衡后,其他条件不变,将气体体积压缩到原来的一半,当再次达到平衡时,W的浓度为原平衡状态1.8倍。下列叙述正确的是
A.平衡向逆反应方向移动,K值变小
B.各物质的浓度都变大,X的转化率变小
C.正、逆反应速率都变大,Z的体积分数变大
D.a+b>c+d
13. 工业合成三氧化硫的反应为 ,反应过程可用如图模拟(代表分子,代表分子,代表催化剂)下列说法正确的是
A.该反应正反应的活化能比逆反应活化能小198 kJmol-1
B.1mol和1mol反应,放出的热量等于99kJ
C.催化剂可降低整个反应的活化能,因此使△H增大
D.过程II为放热反应,过程III为吸热反应
14. 已知:在标准压强(101 kPa)、298 K下,由最稳定的单质合成1 mol物质B的反应焓变叫做物质B的标准摩尔生成焓,用表示。有关物质的如图所示。下列有关判断正确的是( )
A.2 mol NO(g)的键能大于1 mol 与1 mol 的键能之和
B.H2O(l)的
C.标准燃烧热为
D.NH3比N2H4稳定
第II卷(非选择题,共58分)
二、非选择题(本题共4个小题,共58分)
15.(14分)下图是氮单质及其化合物的“价类二维图”。
(1)写出氮元素在元素周期表中的位置: 。
(2)图中方框中的化学式为 ,氨分子的电子式为 ,一水合氨电离可使溶液显碱性,写出一水合氨的电离方程式: 。
(3)向盛有少量NH4Cl溶液的试管中加入NaOH溶液并加热,在试管口放一片湿润的红色石蕊试纸,实验现象是 。
(4)氮的最高价氧化物的水化物为 (填写化学式),由于其见光易分解,故常保存在棕色瓶中,其分解的化学方程式为: 。若有4mol该分子发生分解,则过程中转移的电子数目为 。
16.(16分)某化学兴趣小组学习了《化学反应原理》以后,设计了以下几个实验。
Ⅰ. 设计实验测定反应H+(aq)+OH-(aq)==H2O(l)的
(1)取用50mL 0.50mol/L 盐酸和50mL 0.55mol/L NaOH溶液,用如图装置进行实验,其中仪器a的名称为 ,其操作方式为 (填字母)。
A. 左右搅动 B.上下移动 C.顺时针旋转 D.逆时针旋转
(2)某次实验测得中和热,与理论值出现较大偏差,产生偏差的原因不可能是 。(填字母序号)
A.实验装置保温、隔热效果差
B.分多次把碱溶液倒入盛有酸的小烧杯中
C.用温度计测定碱溶液起始温度后直接测定酸浴液的温度
D.用量筒量取酸和碱溶液的体积时均仰视读数
Ⅱ.为探究影响化学反应速率及化学平衡的因素,设计以下实验:
(3)利用实验I探究锌与稀硫酸反应的速率,需要记录的实验数据有:
。
(4)利用实验II探究浓度对化学平衡的影响。已知:Cr2(橙色)+H2O ⇌2Cr(黄色)+2H+ ,推测B试管中的实验现象为: ,用平衡移动原理解释其原因: 。
(5)该小组同学继续用酸性溶液和草酸()溶液进行实验,设计实验方案如表所示。请回答相关问题:
编号 | 温度℃ | 溶液 | 酸性溶液 | ||
浓度/() | 体积/mL | 浓度/() | 体积/mL | ||
a | 25 | 0.10 | 2.0 | 0.010 | 4.0 |
b | 25 | 0.20 | 2.0 | 0.010 | 4.0 |
c | 50 | 0.20 | 2.0 | 0.010 | 4.0 |
①实验a、b、c所加的溶液均要过量。理由是 。
②实验b和c是探究 对化学反应速率的影响。
③实验a和b起初反应均很慢,过了一会儿速率突然增大,可能原因是 。
17.(14分)一定温度下,在容积为2L的密闭容器中盛有NO2、N2O4两种气体,反应开始至达到平衡状态过程中,两种物质的浓度随时间的变化如图所示:
(1)图中x曲线是表示 的浓度变化(填化学式)。
(2)写出容器中发生反应的化学方程式 。
(3)从反应开始至达到平衡状态时间段内的反应速率v(N2O4)= 。
(4)图中a、b两点对应状态的化学反应速率大小比较v(a) v(b)(填“>”、“=”或“<”)。
(5)欲增大体系的化学反应速率,可以采取的措施有 (填字母)。
a.投入NO2 b.分离出N2O4 c.升高温度 d.充入氦气
(6)在相同温度下,若向该容器中再充入一定体积的NO2,平衡后混合气体颜色与原来相比 (填“变浅”、“不变”或“变深”,下同),若向该容器中充入一定体积的N2O4,平衡后混合气体颜色与原来相比 。
18.(14分)NOx的排放主要来自于汽车尾气,包含 NO2和 NO
I. (1)用 CH4催化还原 NOx 可以消除氮氧化物的污染。例如:
a.CH4(g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(g) ∆H1= -574kJ/mol
b.CH4(g)+4NO(g)==2N2(g)+CO2(g)+2H2O(g) ∆H2= -1160kJ/mol
①这两个反应在热力学上趋势均很大,其原因是: 。
②有利于提高 NOx 的平衡转化率的反应条件是: (至少答一条)。
③在相同条件下,CH4(g)+2NO2(g)=N2(g)+2H2O(g)+CO2(g) ∆H2= kJ/mol。
(2)为了提高 CH4和 NO 转化为 N2的产率,种学家寻找了一种新型的催化剂。将 CH4和 NO 按一定比例、一定流速通过装有上述新型催化剂的反应器中,测得 N2的产率与温度的关系如图1所示,OA 段 N2产率增大的原因是 。
AB 段 N2产率降低的可能原因是 (填字母)。
A.催化剂活性降低 B.平衡常数变大 C. 副反应增多
(3)N2的产率与,由上图中的图2可知最佳约为 。
II. 有人利用反应 2C(s)+2NO2(g)N2(g)+2CO2(g) ΔH=-64.2kJ/mol 对 NO2进行吸附。在 T℃下,向密闭容器中加入足量的 C 和一定量的 NO2气体,图为不同压强下上述反应经过相同时间,NO2的转化率随着压强变化的示意图。
(4)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作 Kp);在 T℃、 1100KPa 时,该反应的化学平衡常数 Kp= (计算表达式表示)。已知:气体分压(P分)=气体总压(P总)×体积分数。
四川省万源中学高2025届高二(上)10月考试
化学试题参考答案及评分标准
一、选择题(每个小题仅有一个正确答案,每小题3分)
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
答案 | D | B | D | B | C | C | C | C | A | B | D | B | A | D |
二、非选择题(本题共4个小题,共58分)
15. (本题共14分)
(1) 第二周期 ⅤA族(2分)
(2) (1分) (2分) (2分)
(3) 湿润的红色石蕊试纸变蓝(2分)
(4) HNO3 (1分) (2分)
4NA 或2.408×1024 (2分)
16.(本题共16分)
(1) 玻璃搅拌器或环形玻璃搅拌棒(1分) B(1分) (2)D(2分)
(3) 反应时间、生成气体体积(2分)
(4) 溶液变黄色(2分) 氢氧化钠和氢离子反应导致氢离子浓度减小,平衡正向移动(2分)
(5) 要保证高锰酸钾溶液完全反应(2分) 温度(2分) 反应生成了具有催化作用的物质或生成的Mn2+起到了催化剂作用(2分)
17.(本题共14分)
(1)NO2 (2分)
(2)2NO2N2O4 (2分)
(3)0.2mol•L-1•min-1 (2分)
(4) > (2分)
(5) ac (2分)
(6)变深 (2分) 变深(2分)
18. (本题共14分)
(1)这两个反应均为熵增大且放热较多的反应(2分) 增大 CH4 浓度或降低温度(2分) -867(2分)
(2)OA 段随着温度的升高,催化剂的活性增强,化学反应速率加快,因此氮气的产率逐渐增大(2分) AC(2分) 4(2分) 或
KPa (2分)
四川省达州市万源中学2023-2024学年高二上学期10月月考化学试题含答案: 这是一份四川省达州市万源中学2023-2024学年高二上学期10月月考化学试题含答案,共21页。试卷主要包含了 下列说法正确的是,23kJ•ml﹣1等内容,欢迎下载使用。
四川省达州市万源中学2023-2024学年高二上学期第二次月考试题(11月)化学(Word版附答案): 这是一份四川省达州市万源中学2023-2024学年高二上学期第二次月考试题(11月)化学(Word版附答案),共9页。试卷主要包含了每空2分, 除标注外每空2分等内容,欢迎下载使用。
四川省达州市万源中学2023-2024学年高二上学期10月月考化学试题(Word版附解析): 这是一份四川省达州市万源中学2023-2024学年高二上学期10月月考化学试题(Word版附解析),共17页。试卷主要包含了 下列说法正确的是,23kJ•ml﹣1等内容,欢迎下载使用。












