

【期中单元知识点归纳】(苏教版2019)2023-2024学年高一上学期化学 必修1 专题1 物质的分类及计量 试卷
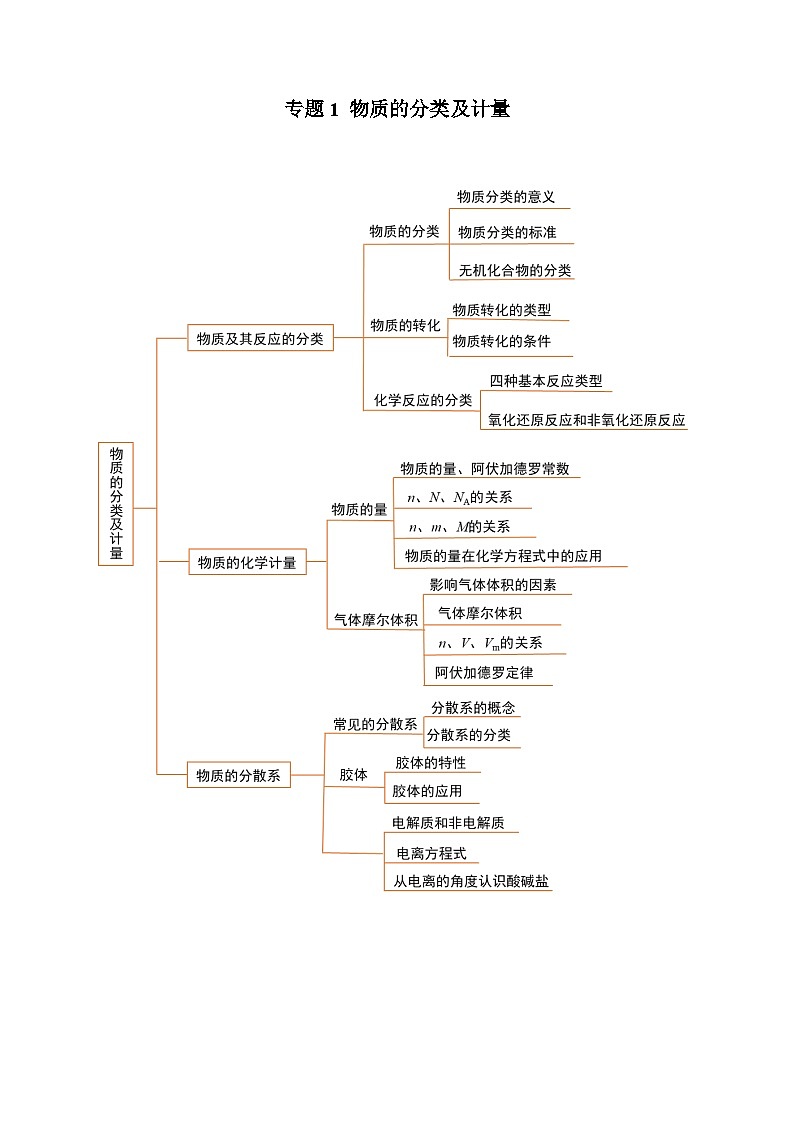
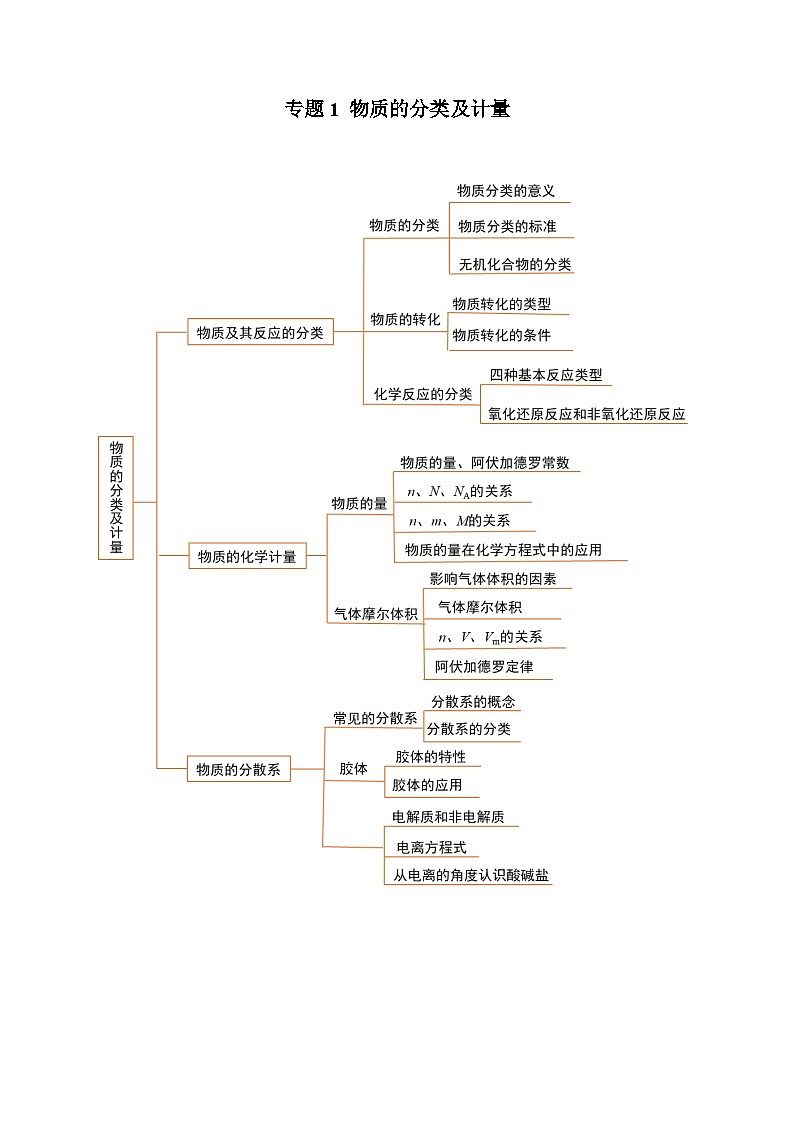
展开专题1 物质的分类及计量
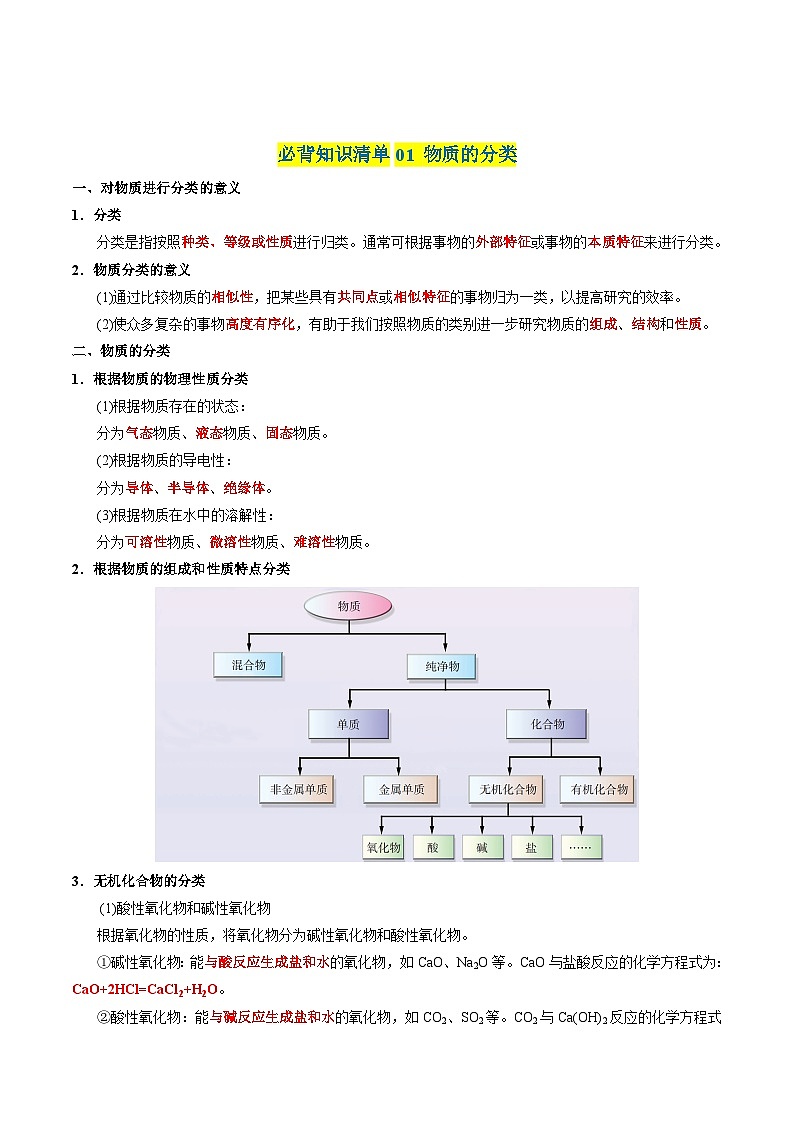
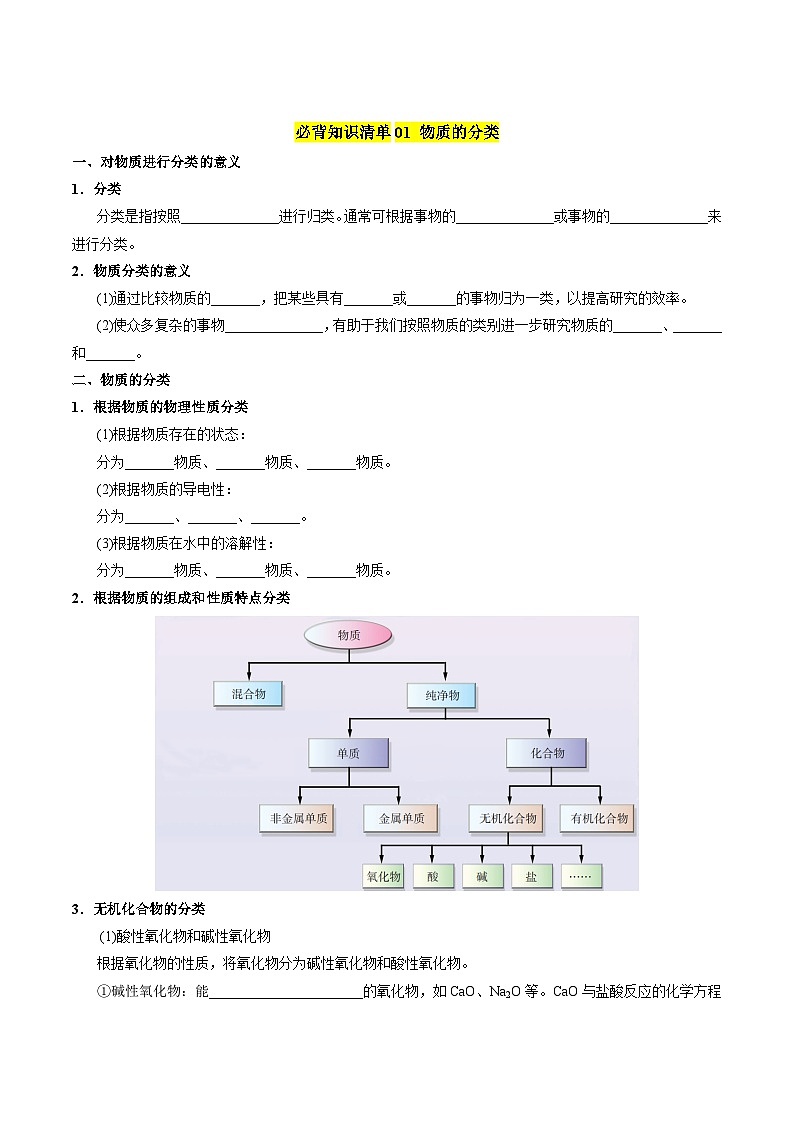
必背知识清单01 物质的分类
一、对物质进行分类的意义
1.分类
分类是指按照种类、等级或性质进行归类。通常可根据事物的外部特征或事物的本质特征来进行分类。
2.物质分类的意义
(1)通过比较物质的相似性,把某些具有共同点或相似特征的事物归为一类,以提高研究的效率。
(2)使众多复杂的事物高度有序化,有助于我们按照物质的类别进一步研究物质的组成、结构和性质。
二、物质的分类
1.根据物质的物理性质分类
(1)根据物质存在的状态:
分为气态物质、液态物质、固态物质。
(2)根据物质的导电性:
分为导体、半导体、绝缘体。
(3)根据物质在水中的溶解性:
分为可溶性物质、微溶性物质、难溶性物质。
2.根据物质的组成和性质特点分类
3.无机化合物的分类
(1)酸性氧化物和碱性氧化物
根据氧化物的性质,将氧化物分为碱性氧化物和酸性氧化物。
①碱性氧化物:能与酸反应生成盐和水的氧化物,如CaO、Na2O等。CaO与盐酸反应的化学方程式为:CaO+2HCl=CaCl2+H2O。
②酸性氧化物:能与碱反应生成盐和水的氧化物,如CO2、SO2等。CO2与Ca(OH)2反应的化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O。
(2)酸的分类
①根据组成,将酸分为无氧酸和含氧酸。
无氧酸:不含氧元素的酸,如HCl等。
含氧酸:含氧元素的酸,如H2SO4、HNO3等。
②根据在水溶液中电离出的H+个数,分为一元酸(如HCl、HNO3)、二元酸(如H2SO4、H2CO3)和三元酸(如H3PO4)。
③根据酸性强弱,分为强酸(如HCl、H2SO4)和弱酸(如H2CO3)。
(3)碱的分类
①根据溶解性,NaOH、KOH和Ba(OH)2为可溶性碱;Cu(OH)2、Fe(OH)3为难溶性碱或难溶性氢氧化物;Ca(OH)2为微溶性碱。
②根据碱性强弱,KOH、NaOH、Ca(OH)2、Ba(OH)2为强碱;NH3·H2O、Cu(OH)2等为弱碱。
必背知识清单02 物质的转化
一、钙和碳元素的单质及其化合物的转化
1.钙及其化合物之间的转化关系
用化学方程式表示钙及其化合物之间的转化关系,并从反应物和生成物的类别加以说明:
序号
化学方程式
反应物和生成物的类别
①
2Ca+O2===2CaO
金属单质+氧气—→金属氧化物
②
CaO+H2O===Ca(OH)2
碱性氧化物+水—→碱
③
CaO+CO2===CaCO3
碱性氧化物+酸性氧化物—→盐
④
Ca(OH)2+CO2===CaCO3↓+H2O
碱+酸性氧化物—→盐+水
⑤
Ca(OH)2+2HCl===CaCl2+2H2O
碱+酸—→盐+水
⑥
CaCO3+2HCl===CaCl2+CO2↑+H2O
碳酸盐+酸—→盐+ CO2↑+H2O
2.碳及其化合物之间的转化关系
用化学方程式表示碳及其化合物之间的转化关系:
序号
化学方程式
反应物和生成物的类别
①
C+O2CO2
非金属单质+氧气—→非金属氧化物
②
CO2+H2O===H2CO3
酸性氧化物+水—→酸
③
CO2+CaO===CaCO3
酸性氧化物+碱性氧化物—→盐
④
CO2+Ca(OH)2===CaCO3↓+H2O
酸性氧化物+碱—→盐+水
⑤
H2CO3+Ca(OH)2===CaCO3↓+2H2O
酸+碱—→盐+水
通过物质分类,可以建立物质间的从属关系,分析物质间的本质区别和联系,寻找各类物质之间的转化关系。
二、物质之间的转化
1.酸、碱和盐在溶液中的复分解反应
酸、碱和盐之间要发生复分解反应,通常有沉淀析出、气体放出或有水等物质生成。
分别写出下列化学方程式,并指出反应发生的条件:
①稀硫酸与NaOH溶液:H2SO4+2NaOH=Na2SO4+2H2O 有水生成
②稀盐酸与Na2CO3溶液:2HCl+Na2CO3=2NaCl+CO2↑+H2O 有气体生成
③BaCl2溶液与Na2SO4溶液:BaCl2+Na2SO4=BaSO4↓+2NaCl 有沉淀生成
④NaOH溶液与CuSO4溶液:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4 有沉淀生成
2.金属活动顺序表的应用
(1)金属活动顺序表氢前面的金属与稀盐酸或(稀硫酸)发生置换反应生成盐和氢气。
(2) 一般情况下,金属活动顺序表中前面的金属能将后面金属从它们的盐溶液中置换出来。
3.酸性氧化物和碱性氧化物
(1)酸性氧化物
常见的酸性氧化物有CO2、SO2等。
酸性氧化物有的能与水反应,一定条件下与碱和碱性氧化物反应。
请根据酸性氧化物的性质,写出下列化学方程式:
①CO2与水反应:CO2+H2O===H2CO3。
②CO2与Na2O反应:CO2+Na2O===Na2CO3。
③CO2与和NaOH溶液反应:CO2+NaOH===Na2CO3+H2O。
(2)碱性氧化物
常见的碱性氧化物有Na2O、CaO、MgO、Fe2O3等。
碱性氧化物有的能与水反应,一定条件下与酸和酸性氧化物反应。
请根据碱性氧化物的性质,写出下列化学方程式:
①CaO与水反应:CaO+H2O===Ca(OH)2。
②CaO与CO2反应:CaO+CO2===CaCO3。
③Fe2O3与盐酸反应:Fe2O3+6HCl=2FeCl3+3H2O。
【归纳小结】
1.酸、碱、盐的化学通性
(1)酸的化学通性
酸
(2)碱的化学通性
碱
(3)盐的化学通性
盐
2.氧化物的化学通性
(1)酸性氧化物的化学通性
酸性氧化物
(2)碱性氧化物的化学通性
碱性氧化物
3.单质、氧化物、酸、碱、盐之间的转化关系
必背知识清单03 化学反应的分类
1.四种基本类型的化学反应
根据反应物和生成物的类别以及反应前后物质的种类多少,将化学反应分为四种基本类型。
化学反应
反应类型
实例(请各举一例)
A+B===AB
化合反应
CaO+H2O===Ca(OH)2
AB===A+B
分解反应
2H2O22H2O+O2↑
AB+C===A+CB
置换反应
Zn+CuSO4===ZnSO4+Cu
AB+CD===AD+CB
复分解反应
BaCl2+Na2SO4===BaSO4↓+2NaCl
2.氧化还原反应和非氧化还原反应
(1)根据反应前后元素的化合价是否发生变化,将化学反应分为氧化还原反应和非氧化还原反应。
(2)凡元素化合价发生变化的化学反应称为氧化还原反应。反之,为非氧化还原反应。
(3)请指出下列各反应的四种基本反应类型:
①2H2+O22H2O 化合反应
②CO2+CaO===CaCO3 化合反应
③NH4HCO3NH3↑+CO2↑+H2O 分解反应
④2KClO32KCl+3O2↑ 分解反应
⑤Fe+2HCl===FeCl2+H2↑ 置换反应
⑥Zn+CuSO4===ZnSO4+Cu 置换反应
⑦HCl+KOH===KCl+H2O 复分解反应
⑧BaCl2+Na2SO4===BaSO4↓+2NaCl 复分解反应
上述各反应属于氧化还原反应的是①④⑤⑥ (填序号)。
3.氧化还原反应与四种基本反应类型之间的关系
(1)分解反应:部分是氧化还原反应,其中有单质生成的分解反应一定是氧化还原反应。
(2)化合反应:部分是氧化还原反应,其中有单质参加的化合反应一定是氧化还原反应。
(3)置换反应:一定是氧化还原反应。
(4)复分解反应:一定不是氧化还原反应。
必背知识清单04 物质的量
一、物质的量
1.物质的量的概念
物质的量是七大基本物理量之一,是表示一定数目的微粒的集合体的物理量,用符号n表示,常用单位是mol。
通过物质的量,可以把物质的质量、体积等宏观量与原子、分子或离子等微观粒子的数量联系起来。
2.计量对象
物质的量计量对象是分子、原子、离子、质子、中子、电子等微观粒子及它们的特定组合。
3.阿伏加德罗常数定义
1mol某种微粒 集合体中所含的微粒数与0.012 kg12C中所含的原子数相等。
0.012 kg12C中所含的原子数称为阿伏加德罗常数,近似为6.02×1023mol-1。
阿伏加德罗常数符号是NA,单位是mol-1。
4.物质的量(n)与微粒数(N)、阿伏加德罗常数(NA)之间的关系
n= N=n·NA
【归纳小结】物质的量及其单位使用时的注意事项
(1)物质的量是一个专用名词,在表述时不可增减,不能说成“物质量”“物质的质量”或“物质的数量”等。
(2)物质的量的单位是摩尔,只能用于表示分子、原子、离子、质子、中子、电子等微观粒子的多少,不适合表示宏观物质的数量。
例:1 mol苹果、1 mol铁元素等说法都是错误的。
(3)在使用物质的量表示物质时,必须具体指明粒子的种类。
如1 mol H2表示1摩尔氢分子,1 mol H表示1摩尔氢原子,1 mol H+表示1摩尔氢离子。而1 mol氢的表述是错误的,因为“氢”是元素名称,是宏观物质名称,不是微观微粒名称。
(4)物质的量表示的是很多个微粒的集合体,其数值可以是整数,也可以是小数。
二、摩尔质量
1.摩尔质量的概念:
摩尔质量是指单位物质的量的物质所具有的质量,符号为M,单位是g/mol或g·mol-1。
2.n、m、M之间的关系:M=。
3.摩尔质量与相对分子(原子)质量的关系:
当物质的质量以克为单位时,其在数值上与该粒子的相对原子质量或相对分子质量相等。
三、物质的量在化学方程式中的应用
1.化学方程式中化学计量数的含义:
既表示反应物和生成物之间的微粒的数量关系,又表示反应物和生成物之间的物质的量关系。如:2H2+O22H2O表示2个H2分子与1个O2分子在点燃条件下生成2个 H2O分子,也表示2molH2和1molO2在点燃条件下完全反应,生成2molH2O。
2.物质的量在化学方程式计算中的应用
根据化学方程式中物质的化学计量数之比等于相应物质的物质的量之比,可以列比例式计算各反应物或生成物的物质的量。
必背知识清单05 气体摩尔体积
一、影响物质体积的因素
1.从微观角度分析物质体积大小的影响因素
粒子的数目
粒子的大小
粒子间的距离
固体体积
√
√
×
液体体积
√
√
×
气体体积
√
×
√
粒子的数目和粒子的大小决定固体或液体的体积,粒子的数目和粒子间的距离决定气体的体积。
2.粒子数目相同时物质的体积关系
同温同压下,不同的固体或液体,由于粒子的大小不同,因此体积不同;不同的气体,由于粒子间的距离几乎相同,因此体积大致相同。
二、阿伏加德罗定律
1.阿伏加德罗定律的内容
相同的温度和压强下,粒子数相同的任何气体都具有相同的体积,也可以说,在相同的温度和压强下、相同体积的任何气体都含有相同数目的粒子。
2.适用范围
阿伏加德罗定律适用于任何气体,也可以是混合气体。
3.正确理解阿伏加德罗定律
(1)定律中的同温同压,不一定指在标准状况下。
(2)因为气体的物质的量之比等于分子数之比,同温同压下,具有相同体积的气体的物质的量相等,分子数相等。
4.阿伏加德罗定律的推论
(1)同温同压下,气体的物质的量之比等于体积比。
即:T、p相同,=
(2)由ρ=,分子和分母都除以n,得ρ=。
同温、同压下,气体的密度与其相对分子质量(或是摩尔质量)成正比。
即:T、p相同,=。
由ρ=,已知标准状况下,Vm=22.4L·mol-1,由此可以计算标准状况下气体的密度或气体的摩尔质量(相对分子质量)。
三、气体摩尔体积
1.定义:单位物质的量的气体所占有的体积。
符号:Vm,单位L·mol-1(或L/mol)和m3·mol-1(或m3/mol)。
2.计算公式:Vm=。
3.影响气体摩尔体积的因素
气体摩尔体积的数值取决于气体所处的温度和压强。
4.标准状况下的气体摩尔体积
在标准状况下,1mol任何气体的体积都约为22.4L,即标准状况下,气体摩尔体积约为22.4L·mol-1,其中,标准状况是指温度为0℃(273K)、压强为1.01×105Pa 。
标准状况下的气体摩尔体积是阿伏加德罗定律的一个特例。
5.正确理解气体摩尔体积
(1)气体摩尔体积只适用于气态物质,对于固态物质和液态物质来讲是不适用的,气体可以为相互不反应的混合气体。
(2)气体摩尔体积并不都约等于22.4 L·mol-1,22.4 L·mol-1只是气体摩尔体积在标准状况下的一个特例。
(3)气体摩尔体积受温度和压强的影响,若温度和压强保持一定,那么气体摩尔体积也保持不变。
必背知识清单06 常见的分散系
1.分散系的概念
(1)把由一种或几种物质(称为分散质)分散到另一种物质(称为分散剂)中形成的混合物体系称为分散系。
溶液是一种均一、稳定的分散系,其中溶质是溶液分散系的分散质,溶剂是该分散系的分散剂。
2.分散系的分类
根据分散质粒子直径的大小作为标准进行分类:
分散质粒子直径大于10-7m的分散系是浊液;
分散质粒子直径在10-9~10-7m之间的分散系是胶体;
分散质粒子直径小于10-9m的分散系是溶液。
必背知识清单07 胶体
1.胶体的性质
(1)【实验探究】
【实验1】将盛有硫酸铜溶液和氢氧化铁胶体的两只小烧杯置于暗处,用聚光手电筒照射从垂直于光线的方向观察实验现象。
【实验2】在两只烧杯中分别加入相同量的含有悬浊液颗粒物的浑浊的水,再向其中一只烧杯中加入适量氢氧化铁胶体,搅拌后静置片刻,比较两只烧杯中液体的浑浊程度。
实验序号
实验现象
实验结论
实验1
氢氧化铁胶体中出现一条光亮的通路
胶体能发生丁达尔效应
实验2
加入氢氧化铁胶体胶体,液体变澄清
胶体能使悬浮颗粒物沉降
(2)胶体的性质
①丁达尔效应:
当光束通过胶体时,在垂直于光线的方向可以看到一条光亮的通路的现象。
丁达尔效应是胶体的特有性质,区别溶液和胶体最简单的方法是丁达尔效应。
②胶体的吸附性
氢氧化铁胶体的胶粒具有吸附性,能吸附水中的悬浮颗粒物并产生沉降,从而除去水中的悬浮杂质。
氢氧化铁胶体常用于净水。
明矾能够净水,是因为明矾溶于水后能形成氢氧化铝胶体。
2.胶体的应用
(1)铁盐和铝盐用作净水剂。
(2)在金属、陶瓷、聚合物等材料中加入固态胶体粒子,能改善材料的机械性能和光学性质。
(3)医学上利用高度分散的胶体来检验或治疗疾病。
(4)广泛用于冶金工业中的选矿、石油原油的脱水、有机高分子材料的制造。
3.常见的胶体
固态胶体:硅胶、烟水晶、有色玻璃等。
液态胶体:蛋白质溶液(牛奶、鸡蛋清、豆浆)、淀粉溶液、Fe(OH)3胶体、Al(OH)3胶体、血液、墨水等。
气态胶体:烟、云雾等。
4.胶体常识:
(1)胶体微粒一般是离子、分子或难溶物的聚集体,因此在Fe(OH)3胶体中,Fe(OH)3胶体粒子的数目要远远小于原FeCl3溶液中Fe3+的数目。
(2)胶体不带电荷,呈电中性。胶体粒子(分散质)可带电荷,有些胶体粒子不带电,如淀粉胶体。
(3)胶体粒子的直径一般在1~100 nm之间,它决定了胶体粒子具有较大的表面积,吸附力很强,能在水中吸附悬浮固体或毒素形成沉淀,从而达到净化水的目的。
【归纳小结】溶液、胶体、浊液三种分散系的比较
分散系
溶液
胶体
浊液
分散质粒子直径/m
<10-9
10-9~10-7
>10-7
外观特征
均一、透明
均一、透明
不均一、不透明
稳定性
稳定
较稳定
不稳定
能否通过滤纸
能
能
不能
能否通过半透膜
能
不能
不能
是否有丁达尔效应
无
有
无
实例
食盐水、蔗糖溶液
氢氧化铁胶体、淀粉溶液
泥浆、油水
必背知识清单08 电解质溶液
一、电解质和非电解质
1.电解质
(1)概念:在水溶液中或熔融状态下能导电的化合物,常见的酸、碱、盐大都是电解质。
(2)电解质的电离:
电解质在水溶液中或熔融状态下产生自由移动的离子的过程称为电离。
2.非电解质:
(1)概念:无论在水溶液中和熔融状态下均以分子形式存在,都不能导电的化合物。
(2)蔗糖、酒精、葡萄糖、油脂等有机化合物大多是非电解质。
3.常见的电解质和非电解质
(1)常见的电解质:
酸 如H2SO4、H2CO3等)
碱(如NaOH、NH3·H2O等)
盐(如NaCl、CaCO3等)
部分氧化物(如Na2O、H2O等
(2)常见的非电解质:
多数非金属氧化物(如CO2、SO2等)
大部分有机物(如蔗糖、酒精等)
部分非金属氢化物(如NH3等
二、电解质的电离
1.电离的概念
电离是指电解质在水溶液或熔融状态下产生自由移动的离子的过程。
在水溶液中,电解质生成水合离子,而不是简单离子,为了书写方便,写成简单离子的形式。
2.电离方程式的书写
中学阶段,一般要求会书写电解质在水中的电离方程式。书写电离方程式时要注意以下几点:
(1)电离方程式左边书写化学式,表示电解质还未电离时的状态;右边书写离子符号,表示电解质电离产生的离子。
(2)原子团不可拆分。如KClO3的电离方程式为:KClO3===K++ClO。
(3)要遵循质量守恒定律,即在方程式两边原子的种类和数目相同。
(4)NaHCO3溶液电离出Na+、HCO;NaHSO4溶液中电离出Na+、H+、SO ;NaHSO4熔融状态下电离出Na+、HSO。
电离方程式分别为:NaHCO3===Na++HCO;NaHSO4===Na++H++SO(在溶液中);NaHSO4===Na++HSO(熔融状态下)
3.从电离的角度认识酸、碱、盐
(1)酸:在水溶液中电离时生成的阳离子全部是H+的化合物,如:
酸
阳离子
阴离子
HCl
H+
Cl-
H2SO4
H+
SO
HNO3
H+
NO
(2)碱:在水溶液中电离时生成的阴离子全部是OH-的化合物,如:
碱
阳离子
阴离子
NaOH
Na+
OH-
KOH
K+
OH-
Ca(OH)2
Ca2+
OH-
(3)盐:在水溶液中电离时生成金属阳离子(或铵根离子)和酸根阴离子的化合物,如:
盐
阳离子
阴离子
NaCl
Na+
Cl-
NH4Cl
NH
Cl-
K2SO4
K+
SO
【归纳小结】对电解质和非电解质的理解
1.电解质和非电解质的判断
2.电解质与导电的关系
电解质导电的条件是溶于水或熔融状态,两个条件具备一个即可。
(1)电解质溶液的导电能力与溶液中离子的浓度及离子所带电荷多少有关,离子浓度越大,离子所带电荷越多,溶液导电能力越强。电离是电解质导电的前提条件。
(2)电解质的导电性
①有些电解质溶于水能导电,熔融状态不能导电,如HCl。
②有些电解质只在熔融状态导电,如BaSO4,其水溶液不导电是因为BaSO4难溶于水。
③电解质本身不一定能导电,如NaCl晶体;能导电的物质不一定是电解质,如石墨、Fe、Cu、NaCl溶液。
④化合物在水溶液中导电,可能是本身电离导电,也可能是与水反应后生成物电离而导电;若为前者,则化合物是电解质,若为后者,则化合物为非电解质(如SO2、SO3、NH3、P2O5等)。
多角度对物质和化学反应进行分类,使科学探究的思路更开阔,在科学探究物质的性质和转化的过程中,培养科学探究的思维品质和创新意识,利用物质的量,可以把物质的宏观量与构成微观粒子的数量联系起来,从微观角度认识分散系的本质区别,为分析物质的宏观性质和变化找到根本原因,使宏观辨识更透彻,从微观角度揭示物质变化的本质。
【典例1】下图表示的一些物质或概念间的从属关系,不正确的是( )
选项
X
Y
Z
A
氧化物
化合物
纯净物
B
CO
非电解质
化合物
C
NaCl溶液
电解质
能导电物质
D
NaOH
碱
纯净物
答案:C
解析:A项,氧化物属于化合物,化合物属于纯净物,符合图示从属关系;B项,非电解质属于化合物,一氧化碳是非电解质中的一种,符合图示从属关系;C项,氯化钠溶液属于混合物,电解质一定是纯净物,不符合图示从属关系;D项,NaOH属于碱,碱属于纯净物,符合图示从属关系。
【典例2】下列化学反应中,既属于四种基本反应类型又属于氧化还原反应的是( )
A.NH4Cl+NaOH NH3↑+H2O+NaCl
B.3CO+Fe2O32Fe+3CO2
C.Cl2+2KBr===Br2+2KCl
D.NH3+CO2+H2O===NH4HCO3
答案:C
解析:选项A中各元素化合价没有发生变化,不属于氧化还原反应;选项B中碳、铁元素化合价发生变化,属于氧化还原反应,但不属于四种基本反应类型;选项C为置换反应,属于氧化还原反应;选项D为无单质参加的化合反应,不属于氧化还原反应。
【典例3】“纳米技术”广泛应用于催化及军事科学中,“纳米材料”是粒子直径在1~100 nm(纳米)之间的材料,纳米碳就是其中的一种。若将纳米碳均匀地分散到蒸馏水中,所形成的体系( )
①是溶液 ②是胶体 ③是浊液 ④不能透过滤纸 ⑤能透过滤纸 ⑥能产生丁达尔效应 ⑦静置会析出黑色沉淀
A.②⑤⑥ B.②⑥⑦ C.①⑤ D.③④⑦
答案:A
解析:分散质粒子的直径为1~100 nm的分散系为胶体,胶体粒子能通过滤纸,胶体具有丁达尔效应,具有介稳性,静置后不会析出黑色沉淀。
【典例4】下列各组均为两种化合物溶于水时电离出的离子,其中按照仅由酸、碱、盐依次电离的是( )
①Na+、OH-、SO ②H+、Cl-、SO
③Na+、K+、OH- ④Na+、K+、NO
A.②③④ B.②①④
C.②③① D.②①③
答案:A
解析:此题从电离的角度理解酸、碱、盐的概念。酸电离出的阳离子只有H+,②符合要求;碱电离出的阴离子只有OH-,③符合要求;盐电离出金属阳离子(或铵根离子)和酸根离子,④符合要求。
【典例5】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.在常温常压下,11.2 L 氮气含有的分子数为0.5NA
B.在常温常压下,1 mol氧气含有的原子数为2NA
C.在常温常压下,11.2 L氧气所含的原子数目为NA
D.在同温同压下,相同体积的任何气体单质所含的原子数相同
答案:B
解析:选项A、C中气体处于非标准状况下,不能直接用标准状况下的气体摩尔体积进行计算;选项D中,同温同压下,相同体积的任何气体单质所含的分子数相同,所含原子数不一定相同(如氧气和臭氧)。
【典例6】计算填空:
(1)已知某气体的摩尔质量为M g·mol-1,在标准状况下的体积为V L,该气体的质量为________。
(2)如果a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是____________。
(3)标准状况下,1.6 g某气态氧化物RO2的体积为0.56 L,该气体的摩尔质量是____________。
答案:(1) g (2) L (3)64 g·mol-1
解析:(2)由n=可知a g气体的物质的量为 mol,那么c g气体的物质的量为· mol,则V=n·Vm= L。(3)由=可知,M==64 g·mol-1。
【典例7】硫酸、碳酸钠、二氧化碳、铜片、氧氧化钡、氢氧化钠、铁片、生石灰和木炭粉9种物质中的几种存在如图所示关系,选择适当的物质,使连线的两种物质能发生反应(酸、碱、盐均配制成稀溶液)。
(1)判断出它们的化学式分别为
①____;②______;③______;④________;⑤________。
(2)写出下列序号对应物质之间发生反应的化学方程式:
①和②:________________________________;
②和④:________________________________;
②和⑤:________________________________;
④和⑤:________________________________。
答案:(1)①Fe ②H2SO4 ③CO2 ④Ba(OH)2 ⑤Na2CO3 (2)Fe+H2SO4===FeSO4+H2↑ H2SO4+Ba(OH)2===BaSO4↓+2H2O H2SO4+Na2CO3===Na2SO4+H2O+CO2↑ Ba(OH)2+Na2CO3===BaCO3↓+2NaOH
解析:Cu、Fe、C三种单质中,只有Fe能与稀硫酸反应,生成FeSO4和H2,故①为Fe,②为硫酸,碱可能是NaOH或Ba(OH)2,盐只有Na2CO3,而NaOH不能与Na2CO3反应,故④为Ba(OH)2,⑤为Na2CO3,③为氧化物,且能与碱反应,则应该为酸性氧化物,即CO2。
必修 第一册第一单元 物质及其反应的分类习题: 这是一份必修 第一册第一单元 物质及其反应的分类习题,共14页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。
【期中模拟卷】(苏教版2019)2023-2024学年高一上学期化学 必修1 专题1 物质的分类及计量 单元测试: 这是一份【期中模拟卷】(苏教版2019)2023-2024学年高一上学期化学 必修1 专题1 物质的分类及计量 单元测试,文件包含期中模拟卷苏教版20192023-2024学年高一上学期化学必修1专题1物质的分类及计量单元测试原卷版docx、期中模拟卷苏教版20192023-2024学年高一上学期化学必修1专题1物质的分类及计量单元测试解析版docx等2份试卷配套教学资源,其中试卷共12页, 欢迎下载使用。
【期中考点梳理】(苏教版2019)2023-2024学年高一上学期化学 必修1专题1 物质的分类与计量(6大核心考点)讲义: 这是一份【期中考点梳理】(苏教版2019)2023-2024学年高一上学期化学 必修1专题1 物质的分类与计量(6大核心考点)讲义,文件包含期中考点梳理苏教版20192023-2024学年高一上学期化学必修1专题1物质的分类与计量原卷版docx、期中考点梳理苏教版20192023-2024学年高一上学期化学必修1专题1物质的分类与计量解析版docx等2份试卷配套教学资源,其中试卷共14页, 欢迎下载使用。