鲁科版 (2019)选择性必修2第1节 认识晶体课后练习题
展开3.1认识晶体同步练习-鲁科版高中化学选择性必修2
学校:___________姓名:___________班级:___________考号:___________
一、单选题
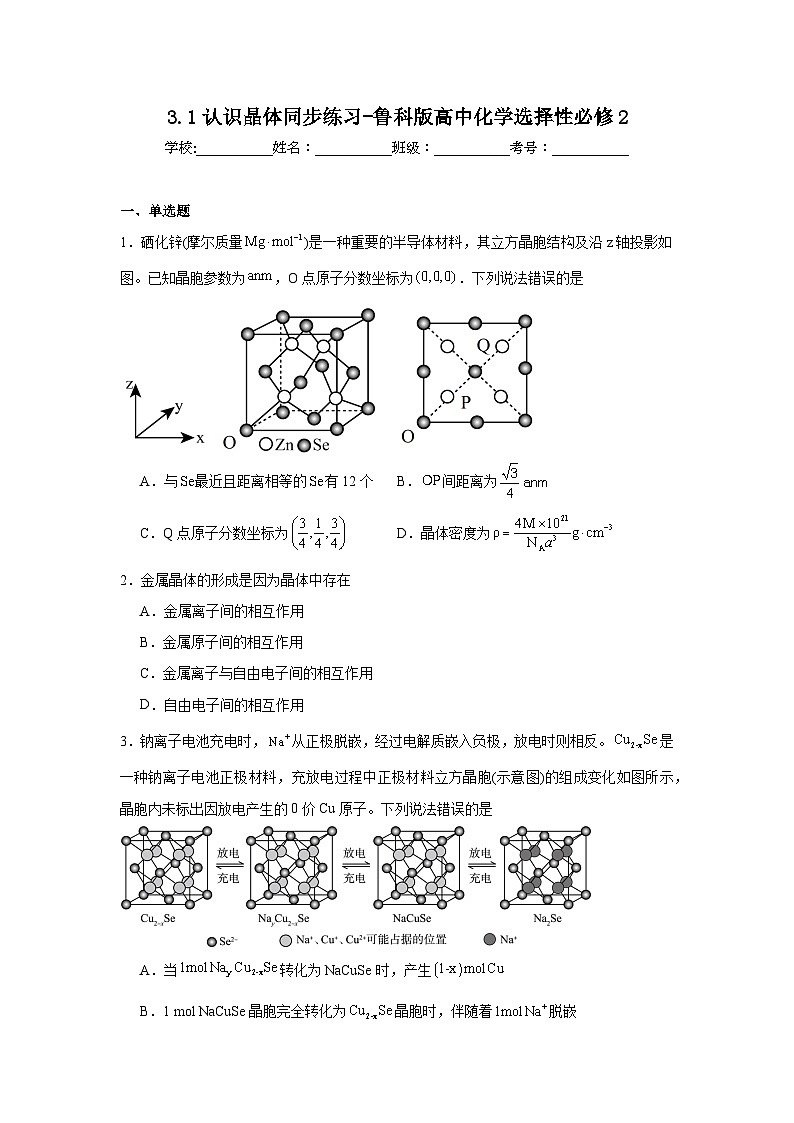
1.硒化锌(摩尔质量)是一种重要的半导体材料,其立方晶胞结构及沿z轴投影如图。已知晶胞参数为,O点原子分数坐标为.下列说法错误的是
A.与最近且距离相等的有12个 B.间距离为
C.Q点原子分数坐标为 D.晶体密度为
2.金属晶体的形成是因为晶体中存在
A.金属离子间的相互作用
B.金属原子间的相互作用
C.金属离子与自由电子间的相互作用
D.自由电子间的相互作用
3.钠离子电池充电时,从正极脱嵌,经过电解质嵌入负极,放电时则相反。是一种钠离子电池正极材料,充放电过程中正极材料立方晶胞(示意图)的组成变化如图所示,晶胞内未标出因放电产生的0价Cu原子。下列说法错误的是
A.当转化为NaCuSe时,产生
B.1 mol NaCuSe晶胞完全转化为晶胞时,伴随着脱嵌
C.每个晶胞完全转化为晶胞,转移的电子数为
D.晶胞中处于四面体空隙的有8 mol
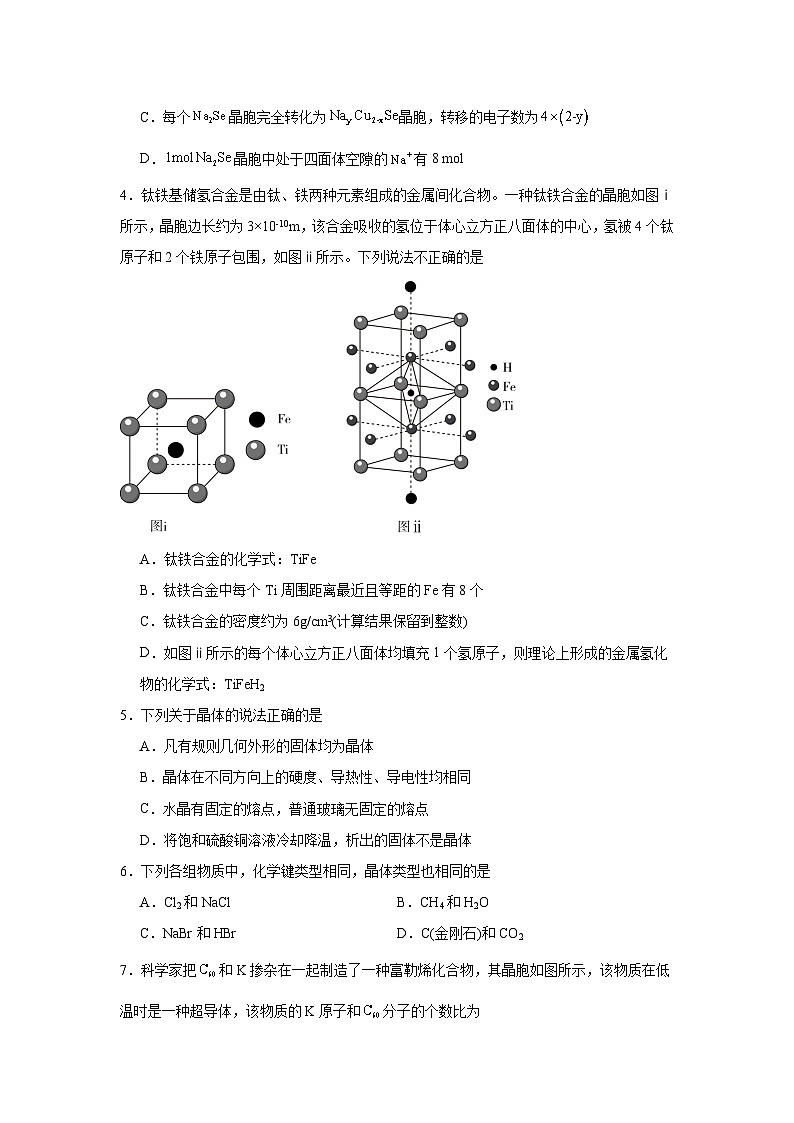
4.钛铁基储氢合金是由钛、铁两种元素组成的金属间化合物。一种钛铁合金的晶胞如图ⅰ所示,晶胞边长约为3×10-10m,该合金吸收的氢位于体心立方正八面体的中心,氢被4个钛原子和2个铁原子包围,如图ⅱ所示。下列说法不正确的是
A.钛铁合金的化学式:TiFe
B.钛铁合金中每个Ti周围距离最近且等距的Fe有8个
C.钛铁合金的密度约为6g/cm3(计算结果保留到整数)
D.如图ⅱ所示的每个体心立方正八面体均填充1个氢原子,则理论上形成的金属氢化物的化学式:TiFeH2
5.下列关于晶体的说法正确的是
A.凡有规则几何外形的固体均为晶体
B.晶体在不同方向上的硬度、导热性、导电性均相同
C.水晶有固定的熔点,普通玻璃无固定的熔点
D.将饱和硫酸铜溶液冷却降温,析出的固体不是晶体
6.下列各组物质中,化学键类型相同,晶体类型也相同的是
A.Cl2和NaCl B.CH4和H2O
C.NaBr和HBr D.C(金刚石)和CO2
7.科学家把和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体,该物质的K原子和分子的个数比为
A.1∶1 B.4∶1 C.6∶1 D.3∶1
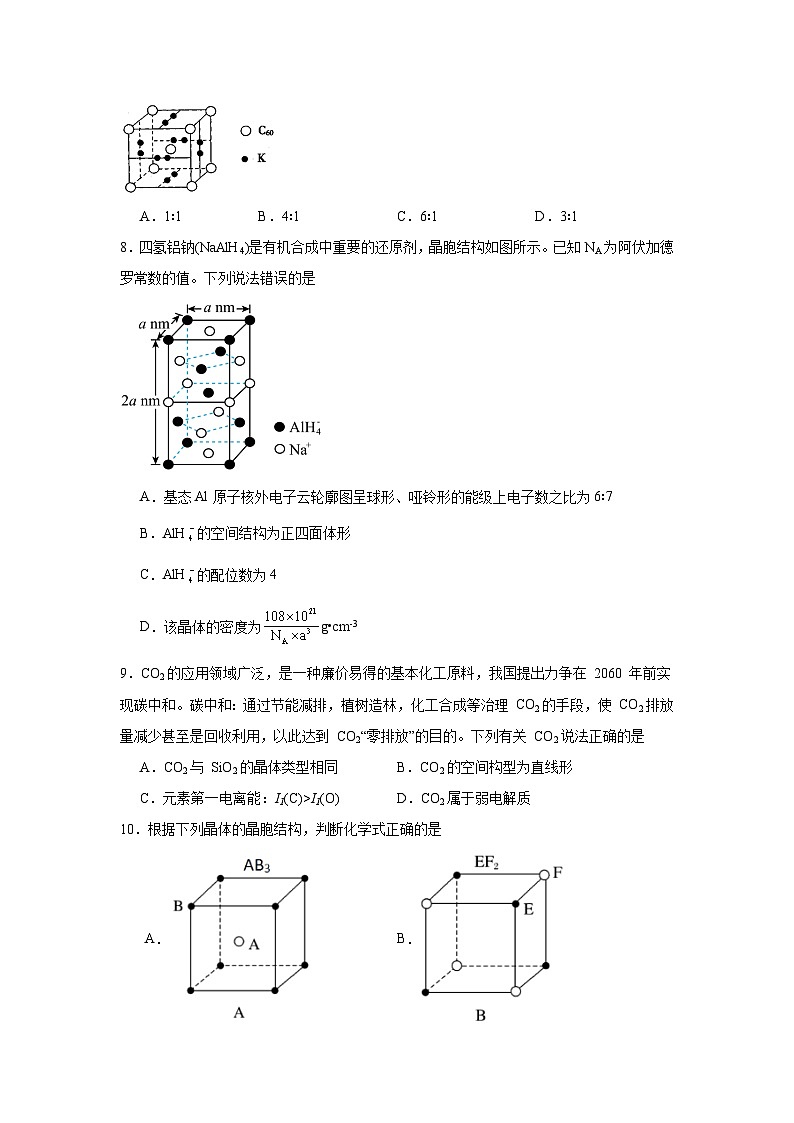
8.四氢铝钠(NaAlH4)是有机合成中重要的还原剂,晶胞结构如图所示。已知NA为阿伏加德罗常数的值。下列说法错误的是
A.基态Al原子核外电子云轮廓图呈球形、哑铃形的能级上电子数之比为6∶7
B.AlH的空间结构为正四面体形
C.AlH的配位数为4
D.该晶体的密度为g•cm-3
9.CO2的应用领域广泛,是一种廉价易得的基本化工原料,我国提出力争在 2060 年前实现碳中和。碳中和:通过节能减排,植树造林,化工合成等治理 CO2的手段,使 CO2排放量减少甚至是回收利用,以此达到 CO2“零排放”的目的。下列有关 CO2说法正确的是
A.CO2与 SiO2的晶体类型相同 B.CO2的空间构型为直线形
C.元素第一电离能:I1(C)>I1(O) D.CO2属于弱电解质
10.根据下列晶体的晶胞结构,判断化学式正确的是
A. B. C. D.
二、填空题
11.(1)某物质的晶体内部一个截面上原子的排布情况如图所示,则该晶体的化学式可表示为
(2)Si 元素以 Si-O-Si 链构成矿物界,由许多四面体(图 l)连接成无限长的单链或双链(图 2)结构。图 2 所示的多硅酸根离子的化学式通式为 (以含正整数 n 的代数式表示)。
12.CaC2是重要的金属碳化物,工业上可用CaC2制造乙炔。CaC2有多种晶型,其中一种晶型的晶胞如图所示:
CaC2的电子式为 ,晶胞中Ca2+的配位数为 ,阴离子填充了由Ca2+围成的 空隙。
13.下图为几种物质的晶体结构或晶胞示意图。
回答下列问题:
(1)以共价键结合形成的晶体是 。
(2)上图所示的四种物质中,熔点最低的是 。
(3)晶体中的配位数是 。
(4)每个晶胞中平均含有 个铜原子。
(5)金刚石的熔点远高于冰晶体,原因是 。
14.磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料。 LiFePO4可用FeCl3、NH4H2PO4、LiCl和苯胺()等作为原料制备。
(1) Fe2+基态核外电子排布式为 ,PO43-的空间构型为 (用文字描述)。
(2) NH4H2PO4中,除氢元素外,其余三种元素第一电离能最大的是 (填元素符号)。
(3) 1 mol含有的σ键数目为 ,苯胺的沸点高于甲苯的主要原因是 。
(4) 一个LiCl晶胞(如图)中,Li+数目为 。
15.已知MgO具有NaCl型晶体结构,其结构如图所示。已知MgO晶胞边长为 0.42 nm,则MgO的密度为 g/cm3(保留小数点后一位);相邻Mg2+之间的最短距离为 nm(已知=1.414;结果保留小数点后两位),每个Mg2+周围具有该距离的Mg2+个数为 。
16.方钴矿化合物是典型的热电材料,在环境污染和能源危机日益严重的今天,进行新型热电材料的研究具有很强的现实意义。
(1)Brian Sales等研究了一类新型热电材料,叫作填隙方钴矿锑化物,在钴和锑形成的晶体空隙中填充入稀土原子La(如图所示),该化合物的化学式为 。
(2)Co和Fe的逐级电离能数据如表,Fe的大于Co的原因是 。
元素 | …… | |||||
Fe | 462.5 | 1561.9 | 2957 | 5290 | 7240 |
|
760.4 | 1648 | 3232 | 4950 | 7670 |
|
(3)已知的熔点73℃,沸点223.5℃,的熔点是735℃,沸点是1049℃。两者的熔沸点差异较大的原因是 。预测的空间构型为 。
(4)为更好地理解超酸的强酸性,实验小组查阅相关资料了解得:混合超强酸显强酸性的原因是氟化氢提供和离子,氟离子通过强配位键与生成稳定结构的四氟化硼阴离子,于是就成为了“自由质子”,从而导致整合体系具有非常强的酸性。以此类推,魔酸()是最早发现的超强酸,其中Sb采取 杂化方式,S采取 杂化方式。
17.我国秦俑彩绘和汉代器物上用的颜料被称为中国蓝”、“中国紫”,近年来,人们对这些颜料的成分进行了研究,发现其成分主要为BaCuSi4O10、BaCuSi2O6
(1)基态Cu原子核外有 个运动状态不同的电子,其在周期表中的位置 。Si、O、Ba元素电负性由大到小的顺序为 。
(2)“中国蓝”的发色中心是以Cu2+为中心离子的配合物,其中提供孤电子对的是 元素。
(3)比较Si、SiC、 CO2 三种物质晶体状态时熔点由高到低的顺序为 ,原因为 。
(4)C、N元素与颜料中的氧元素同周期。
①写出CO的一种常见等电子体分子的电子式 ;NO的VSEPR模型为 ,酸性:HNO2 HNO3(填“强于”或“弱于”)。
②C、N元素能形成一种类石墨的聚合物半导体g-C3N4其单层平面结构如图1,晶胞结构如图2。
i.g-C3N4中氮原子的杂化类型是 。
ii.已知该晶胞的体积为Vcm3,中间层原子均在晶胞内部。设阿伏加德罗常数的值为NA,则g-C3N4的密度为 。
iii.根据图2,在图1中用平行四边形画出个最小重复单元 。
18.现有甲.乙.丙.丁四种晶胞(如下图所示),可推知:甲晶体中A与B的离子个数比为 ;乙晶体的化学式为 ;丙晶体的化学式为 ;丁晶体的化学式为 。
19.回答下列问题:
(1)甲醛与新制Cu(OH)2加热可得砖红色沉淀Cu2O,已知Cu2O晶胞的结构如图所示:
①在该晶胞中,Cu+的配位数是
②若该晶胞的边长为apm,则Cu2O的密度为 g∙cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数的值为NA,1pm=10-12m)。
(2)晶胞有两个基本要素:原子坐标参数,表示晶胞内部各原子的相对位置,LiZnAs基稀磁半导体的晶胞如图所示,其中A处Li的原子坐标参数为(0,0,)B处As的原子坐标参数为(,,);C处Li的原子坐标参数为 。
(3)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构如图。储氢原理:镧镍合金吸附H2,H2解离为原子,H原子储存在其中形成化合物。若储氢后,氢原子占据晶胞中上下底面的棱心和面心,则形成的储氢化合物的化学式为 。
20.汞钡铜氧晶体的晶胞如图A所示,通过掺杂Ca2+获得的具有更高临界温度的超导材料如图B所示。图A晶胞中钡离子的分数坐标为(,,)和
三、实验题
21.三氯化硼(BCl3)是一种重要的化工原料,实验室采用三氟化硼(BF3)与氯化铝(AlCl3)加热的方法制备BCl3,装置如下图所示(夹持装置及加热装置略)。
已知:1.三氟化硼(BF3)易与水反应:三氯化硼(BCl3)易潮解:三氯化铝(AlCl3)沸点低、易升华。Ⅱ.部分物质的常点如下表所示。
物质 | BF3 | BCl3 | AlCl3 |
沸点/℃ | -101 | 12.5 | 180 |
回答下列问题:
(1)BF3中B的杂化方式为 ,AlCl3属于 晶体,C中仪器a的名称为 (每空1分,共3分)
(2)将氟硼酸钾(KBF4)和硼酐(B2O3)一起研磨均匀加入A中的圆底烧瓶,滴入浓硫酸并加热,除产生气体外,还生成一种酸式盐,分别写出气体和酸式盐的化学式 、 。
(3)实验开始时,两处加热装置应先加热 (填“A”或“C”)。
(4)装置B中盛放的是浓硫酸,其作用是 。
(5)装置D的作用是 。
(6)C中2.50 g无水氯化铝完全反应后,取下U形管并注入水,完全反应生成盐酸和硼酸(H3BO3是一元弱酸)将所得溶液加水稀释到250 mL,取10 mL加入锥形瓶中滴入2滴酚酞溶液,用0.1000 mol/L的NaOH溶液滴定至终点,消耗NaOH溶液的体积为28.00 mL,则BCl3的产率为 %(保留四位有效数字)。
22.叠氮化合物是重要的有机合成试剂,化学兴趣小组的同学在实验室制备叠氮化钾(KN3)并测定其结构。
I.制备KN3
在异丙醇[(CH3)2CHOH]和H2SO4的混合溶液中逐滴加入NaNO2溶液,将反应容器置于冰盐浴中,控制温度低于0℃。反应1h后生成的亚硝酸异丙酯[(CH3)2CHONO]浮在表面上,分离出上层的油状物,接着用NaCl和NaHCO3的混合溶液洗涤(CH3)2CHONO三次,干燥后得到(CH3)2CHONO。将一定量KOH溶于无水乙醇中,取其上层清液于三颈烧瓶(图1)中,先加入N2H4加热,随后加入(CH3)2CHONO并加热反应约1h。待KN3析出后冰浴冷却,过滤后用无水乙醇洗涤三次,干燥后得到KN3粗产品。
II.测定KN3晶体结构
将KN3粗产品进一步进行纯化后得到纯晶,然后测定其晶体结构,经过进一步数据处理,得到KN3的晶胞结构如图2所示。
相关物质的性质见表。
物质 | 颜色、状态 | 沸点 | 溶解性 |
KN3 | 无色晶体 | 300℃,受热易分解 | 易溶于水,微溶于乙醇,不溶于乙醚 |
(CH3)2CHOH | 无色液体 | 82℃ | 微溶于水,与乙醇、乙醚混溶 |
(CH3)2CHONO | 无色油状液体 | 39℃ | 不溶于水,与乙醇、乙醚混溶 |
回答下列问题:
(1)图1中仪器B的名称是 。
(2)在(CH3)2CHOH、H2SO4和NaNO2反应时,需使用冰盐浴控温而不能使用冰浴控温的原因是 。用含NaHCO3的混合溶液洗涤(CH3)2CHONO的目的是 ,洗涤时需要使用的玻璃仪器是 。
(3)异丙醇的沸点高于亚硝酸异丙酯沸点的原因是 。
(4)写出由(CH3)2CHONO、N2H4和KOH反应生成KN3和(CH3)2CHOH的化学方程式: 。
(5)纯化KN3粗产品的方法是 ,测定KN3晶体结构的方法是 。
(6)N的中心原子孤电子对数为 。KN3晶体中每个K+周围离最近且相等的N共有 个。
23.某化学兴趣小组做了淀粉水解及产物检验的实验,步骤如下:
步骤1:取1mL淀粉溶液,加入2mL10%稀硫酸,加热煮沸。
步骤2:向步骤1所得溶液中加入10%溶液调节pH至碱性。
步骤3:在另一支试管中加入2mL10%溶液滴入5滴5%溶液,振荡,制得新制的。
步骤4:向步骤2所得溶液中加入少量新制备的,加热3~5min,观察到生成砖红色沉淀。
回答下列问题
(1)要想证明淀粉溶液没有水解完全,只需在步骤1所得溶液中加入 ,观察到 的现象时,即可证明。
(2)步骤4发生反应的化学方程式是 。
(3)新制的里含有 (四羟基合铜离子),该离子的配体是 ,的配位数是 。
(4)步骤4所得的砖红色沉淀的晶胞如图所示,其中e是 (填离子符号),假设该晶胞的边长为,该晶体的密度为 (用含a的代数式表示,为阿伏加德罗常数的值)。
参考答案:
1.C
2.C
3.B
4.D
5.C
6.B
7.D
8.C
9.B
10.C
11. AB (Si4O11)n6n
12. 6 正八面体
13.(1)金刚石晶体
(2)冰晶体
(3)6
(4)4
(5)金刚石熔化破坏的是共价键,冰熔化破坏的是氢键,共价键的作用力远大于氢键
14. 1s22s22p63s23p63d6或[Ar]3d6 正四面体 N 14 mol 苯胺可形成分子间氢键,而甲苯分子间没有氢键 4
15. 3.6 0.30 12
16.(1)
(2)的第四电离能失去的是的电子,失去的是的电子,比较稳定
(3) 是分子晶体,是离子晶体 三角锥形
(4)
17. 29 第四周期第IB族 O>Si> Ba O SiC>Si>CO2 Si、SiC 都是原子晶体,熔点高:干冰(或CO2晶体)是分子晶体,熔点低。而C原子半径比Si小,Si-C 共价键比Si-Si键长短,键能大,SiC 熔点比Si高 平面三角形 弱于 sp2杂化 g/cm3
18. 1:1 C2D EF XY2Z
19.(1) 2
(2)(,,)
(3)
20.(,,)
21.(1) sp2 分子 球形冷凝管
(2) BF3 KHSO4
(3)A
(4)干燥除水,观察气泡,控制气体流速
(5)冷凝收集BCl3
(6)93.45
22.(1)球形冷凝管
(2) 要求控制温度低于0℃,冰浴只能控温到0℃ 除去混合液中的稀硫酸 玻璃棒、烧杯、分液漏斗
(3)异丙醇中存在羟基能形成氢键,而亚硝酸异丙酯不能形成氢键
(4)(CH3)2CHONO+N2H4+KOH=KN3+(CH3)2CHOH+2H2O
(5) 使用适量的乙醚溶解粗产品,然后过滤、洗涤、烘干得到KN3 X射线衍射
(6) 0 8
23. 碘液 溶液变蓝 OH- 4 Cu+
高中化学鲁科版 (2019)选择性必修1第3章 物质在水溶液中的行为第1节 水与水溶液练习题: 这是一份高中化学鲁科版 (2019)选择性必修1第3章 物质在水溶液中的行为第1节 水与水溶液练习题,共11页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
高中化学鲁科版 (2019)选择性必修2第1节 认识晶体课后复习题: 这是一份高中化学鲁科版 (2019)选择性必修2第1节 认识晶体课后复习题,共17页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
高中化学鲁科版 (2019)选择性必修1第1节 水与水溶液一课一练: 这是一份高中化学鲁科版 (2019)选择性必修1第1节 水与水溶液一课一练,共10页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。













