
2023-2024学年北京市重点大学附属中学高三(上)开学化学试卷(含解析)
展开2023-2024学年北京市重点大学附属中学高三(上)开学化学试卷
一、单选题(本大题共14小题,共42.0分)
1.下列化学用语正确的是( )
A. 羟基的电子式:
B. 聚丙烯的结构简式:
C. Ga的价层电子排布:4s24p1
D. 水分子的充填模型:
2.NA为阿伏加德罗常数,下列说法正确的是( )
A. 3.2gO2和O3的混合物中含有的氧原子数目为0.2NA
B. 1mol金刚石中含有的共价键数为4NA
C. 标准状况下,11.2L水中含有的氧原子数为0.5NA
D. 2.0mol/L硫酸溶液中含有的硫酸根离子数目为2NA
3.根据元素周期律判断,不正确的是( )
A. Mg原子失电子能力比Ca弱 B. K与水反应比Mg与水反应剧烈
C. HCl的稳定性强于HBr D. H3PO4酸性强于H2SO4
4.元素周期表中的五种元素A、B、E、W、Z,原子序数依次增大。A的基态原子价层电子排布为nsnnpn;B的基态原子最外层有3个单电子;E的原子最外层电子数是其内层的3倍,W和E位于同一族;Z3+的3d轨道中有5个电子。下列说法正确的是( )
A. 第一电离能:I1(E)>I1(B)>I1(A)
B. A单质的晶体都属于共价晶体
C. E的单质可将W从它的氢化物中置换出来
D. 单质Z和稀硫酸反应的离子方程式为:2Z+6H+=2Z3++3H2↑
5.下列各组变化,所克服的粒子间作用属于同种类型的是( )
A. Na2O2和SiO2熔化 B. Mg和S熔化
C. 氯化钾和蔗糖熔化 D. 碘和干冰升华
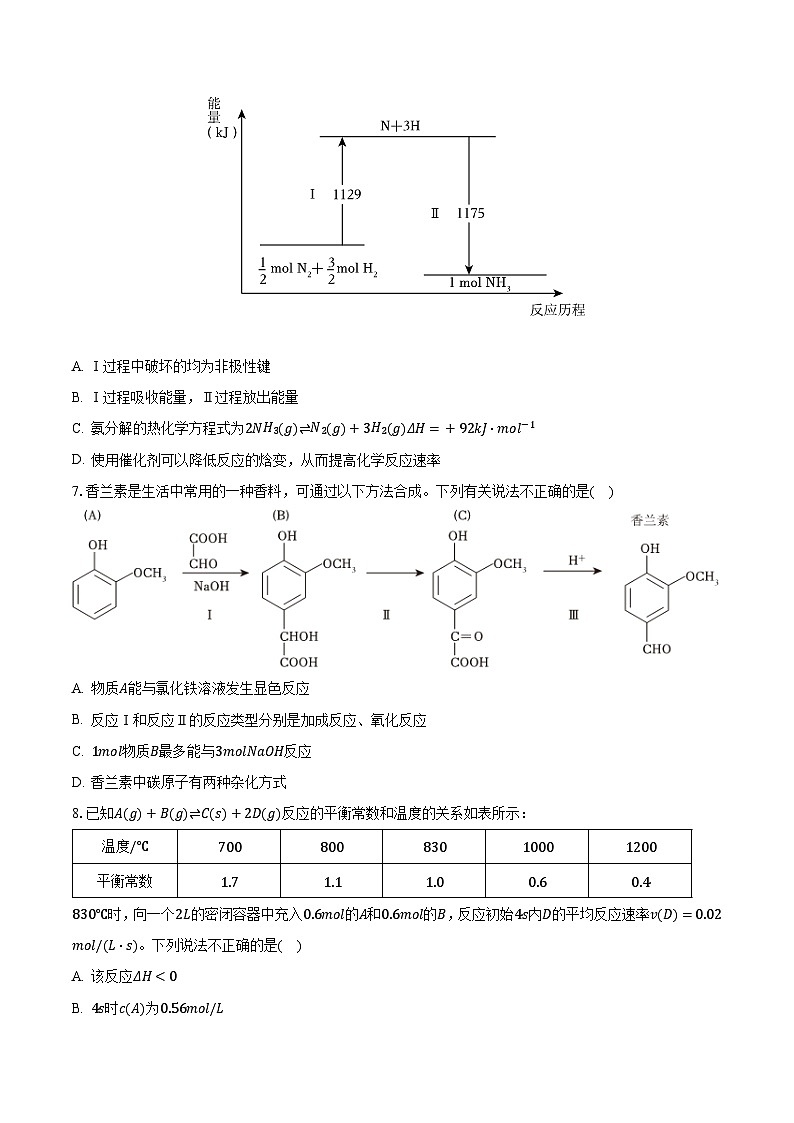
6.N2(g)与H2(g)在铁催化剂表面经历如图过程生成NH3(g),下列说法不正确的是( )
A. Ⅰ过程中破坏的均为非极性键
B. Ⅰ过程吸收能量,Ⅱ过程放出能量
C. 氨分解的热化学方程式为2NH3(g)⇌N2(g)+3H2(g)ΔH=+92kJ⋅mol−1
D. 使用催化剂可以降低反应的焓变,从而提高化学反应速率
7.香兰素是生活中常用的一种香料,可通过以下方法合成。下列有关说法不正确的是( )
A. 物质A能与氯化铁溶液发生显色反应
B. 反应Ⅰ和反应Ⅱ的反应类型分别是加成反应、氧化反应
C. 1mol物质B最多能与3molNaOH反应
D. 香兰素中碳原子有两种杂化方式
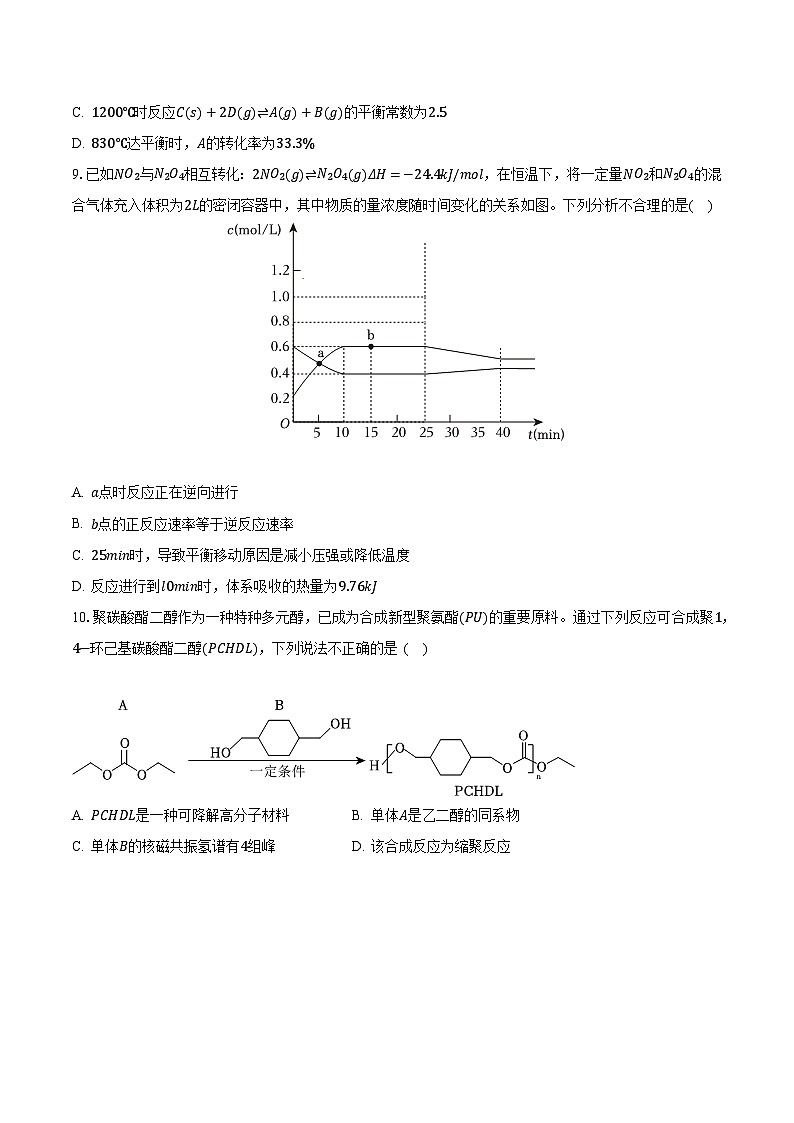
8.已知A(g)+B(g)⇌C(s)+2D(g)反应的平衡常数和温度的关系如表所示:
温度/℃
700
800
830
1000
1200
平衡常数
1.7
1.1
1.0
0.6
0.4
830℃时,向一个2L的密闭容器中充入0.6mol的A和0.6mol的B,反应初始4s内D的平均反应速率v(D)=0.02mol/(L⋅s)。下列说法不正确的是( )
A. 该反应ΔH<0
B. 4s时c(A)为0.56mol/L
C. 1200℃时反应C(s)+2D(g)⇌A(g)+B(g)的平衡常数为2.5
D. 830℃达平衡时,A的转化率为33.3%
9.已如NO2与N2O4相互转化:2NO2(g)⇌N2O4(g)ΔH=−24.4kJ/mol,在恒温下,将一定量NO2和N2O4的混合气体充入体积为2L的密闭容器中,其中物质的量浓度随时间变化的关系如图。下列分析不合理的是( )
A. a点时反应正在逆向进行
B. b点的正反应速率等于逆反应速率
C. 25min时,导致平衡移动原因是减小压强或降低温度
D. 反应进行到l0min时,体系吸收的热量为9.76kJ
10.聚碳酸酯二醇作为一种特种多元醇,已成为合成新型聚氨酯(PU)的重要原料。通过下列反应可合成聚1,4−环己基碳酸酯二醇(PCHDL),下列说法不正确的是 ( )
A. PCHDL是一种可降解高分子材料 B. 单体A是乙二醇的同系物
C. 单体B的核磁共振氢谱有4组峰 D. 该合成反应为缩聚反应
11.某小组设计完成了如图实验,下列说法不正确的是 ( )
A. ⅰ中深蓝色溶液中存在[Cu(NH3)4]2+
B. ⅱ中发生反应的离子方程式为:Cu2++S2−=CuS↓
C. ⅲ中现象是Cu2++4NH3⇌[Cu(NH3)4]2+逆向移动的结果
D. ⅳ中生成的气体是NH3
12.铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示如图−1所示,晶胞边长为anm。Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x−n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图−2所示,下列说法不正确的是 ( )
A. 制备该铁氮化合物时生成氢气
B. a位置周围距离最近的铁原子有6个
C. 可通过晶体的X−射线衍射实验获取晶体结构信息
D. 更稳定的Cu替代型产物的化学式Fe3CuN
13.探究草酸(H2C2O4)性质,进行如下实验。(已知:室温下,0.1mol⋅L−1H2C2O4的pH=1.3)
实验
装置
试剂a
现象
①
Ca(OH)2溶液(含酚酞)
溶液褪色,产生白色沉淀
②
少量NaHCO3溶液
产生气泡
③
酸性KMnO4溶液
紫色溶液褪色
④
C2H5OH和浓硫酸
加热后产生有香味物质
根据上述实验判断草酸性质以及所对应的方程式不正确的是( )
A. H2C2O4有酸性,Ca(OH)2+H2C2O4=CaC2O4↓+2H2O
B. 酸性:H2C2O4>H2CO3,NaHCO3+H2C2O4=NaHC2O4+CO2↑+H2O
C. H2C2O4具有还原性,2MnO4−+5C2O42−+16H+=2Mn2++10CO2↑+8H2O
D. H2C2O4可发生酯化反应:
14.下列实验操作和现象对应所得到的结论均正确的是 ( )
选项
实验操作和现象
结论
A
向某无色溶液中滴加氯水和CCl4,振荡、静置,下层溶液显紫色
原溶液中有I−
B
向稀HNO3中加入过量的Fe粉,充分反应后,滴入K3[Fe(CN)6]溶液,产生蓝色沉淀
稀HNO3只能将Fe氧化为Fe2+
C
向试管中加入1mL0.002mol/LFeCl3溶液和1mL0.002mol/LKSCN溶液,溶液变为红色,再滴加2滴0.02mol/LKSCN溶液,溶液颜色变深
其它条件不变,增大反应物浓度,平衡正向移动
D
将电石与饱和食盐水反应产生的气体通入到酸性KMnO4溶液中,溶液紫色逐渐变浅
乙炔具有还原性,被高锰酸钾酸性溶液氧化
A. A B. B C. C D. D
二、实验题(本大题共1小题,共10.0分)
15.某同学研究浓硝酸与KSCN溶液的反应。
资料:Ⅰ.SCN−中S、C、N元素的化合价依次为:−2价、+4价、−3价。
Ⅱ.SCN−的性质类似卤素离子,能被氧化为黄色的(SCN)2,(SCN)2可聚合为红色的(SCN)x。
Ⅲ.NO2可溶于浓硝酸。
实验一:
(1)向浓硝酸中滴加KSCN溶液,溶液立即变红是因为生成了 ______ (填化学式)。
(2)研究SCN−的转化产物。
实验二:
a.将实验一ⅲ中的气体通入Ba(OH)2和NaOH的混合溶液中,有白色沉淀生成。
b.过滤、洗涤白色沉淀,取少量于试管中,加入过量的稀硝酸,沉淀完全溶解,再滴加少量KMnO4溶液,不褪色。
c.另取少量实验一ⅲ中试管内的溶液加入BaCl2溶液,产生大量白色沉淀。
①通过b证实了红棕色气体中不含SO2,证据是 ______ 。
②a中,Ba(OH)2溶液中加入NaOH溶液以增大OH−浓度的目的是 ______ 。
③由上述实验现象可知:SCN−转化的最终产物中一定有 ______ 。
(3)继续研究实验一ⅲ中“静置一段时间后,突然剧烈反应,红色迅速褪去”的原因。
实验三:
①对比实验一和实验三可得结论:一定浓度的NO2 ______ 。
②结合实验三,从化学反应速率的角度解释实验一ⅱ和ⅲ中的现象: ______ 。
三、简答题(本大题共4小题,共48.0分)
16.“撞击说”是导致恐龙灭绝的可能原因。在一个6500万年前形成的沉积物薄层中发现了含量丰富的 77Ir,这可能是由于小行星对地球的撞击的结果,同时,被撞击出的坑表面还发现有超石英(SiO2)的存在。请回答下列问题:
(1)Ir在元素周期表中位于 ______ ,价层电子排布式是 ______ 。
(2)SiO2有多种结构,常温下最稳定的是低温石英,低温石英和超石英的晶胞如图所示:
所有大球在面上,所有小球在体内(a=b=c=5×10−8cm)
立方体(a=c=4×10−8cm,b=3×10−8cm)
①Si的最高能级符号是 ______ ,低温石英晶体中,Si的杂化轨道类型是 ______ 。
②超石英晶体中,Si的紧邻O原子个数是 ______ 个。
③结合密度计算说明,被撞击出的坑表面有超石英存在的原因是: ______ 。(已知sin60°≈0.9)
④超石英也会出现在地壳深处,可通过火山喷发被携带到地表,但人们在火山活动等高温地区的地表层尚未发现过超石英,而撞击坑表面却至今还存在超石英。请解释火山活动地区未发现超石英的原因: ______ 。
(3)工业上用焦炭在高温下还原SiO2可制备粗硅,其化学方程式为 ______ ,某同学认为该反应能用来比较C和Si的非金属性强弱,你是否同意?说明理由: ______ 。
17.有催化剂的条件下,将H2和CO2混合加热可制备CH4。主要的反应有:
Ⅰ.CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) ΔH1=−165kJ/mol
Ⅱ.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2>0
Ⅲ.CO2(g)+2H2(g)⇌C(s)+2H2O(g) ΔH3=−96.1kJ/mol
(1)CO2、CH4、H2O的沸点由高到低的顺序是 ______ 。
(2)由燃烧热求ΔH2。已知H2(g)和CO(g)的燃烧热分别为−285.8kJ/mol、−283kJ/mol。
①要计算ΔH2至少还需要一个过程的热效应(该热效应记为ΔH4),则此过程的热化学方程式是 ______ 。
②ΔH2= ______ (用含有ΔH4的代数式表示)。
(3)CO2的电子式是 ______ ,其中C=O键的键能是799kJ/mol,H2O中O−H键的键能是463kJ/mol。则H−H键的键能与C−H的键能相差 ______ kJ/mol。
(4)CO2甲烷化反应的机理大体可归结为两种,如图表示了两种途径每步反应的能量变化(TSx代表过渡态,*表示吸附在催化剂表面的物料),其中速率较快的途径中的决速步的化学方程式是 ______ 。
(5)将n(CO2):n(H2)=1:4混合气持续以一定的流速通过含催化剂的恒容反应器,测定CO2的转化率和CH4的选择性随温度的变化关系如图所示。温度高于500℃后,CO2的转化率几乎保持不变但CH4的选择性下降的可能原因是 ______ 。
(6)不同压强下,保持相同的投料比,测定反应体系中CO2的平衡转化率和CH4的平衡产率随温度的变化关系如图所示。
P1时曲线出现拐点的温度高于P2时的,原因是 ______ 。
18.法匹拉韦
是我国最早批准的可用于抗新冠肺炎临床试验的药物之一,而最新文献研究也证实了其对新型冠状病毒(2019nCoV)表现出良好的体外抑制作用。F是合成法匹拉韦过程中的重要中间体,其合成路线如图:
已知:
①
②
(1)A可以与Na2CO3溶液反应产生CO2,A的官能团名称为 ______ 。
(2)X含三种元素,请写出B→X的方程式 ______ 。
(3)反应①的反应类型为 ______ 。
(4)Y含有酯基,请写出Y的结构简式 ______ 。
(5)补充下列合成路线:合成E分三步进行,③为取代反应,中间产物2和E互为同分异构体,请补充中间产物1、中间产物2和E的结构简式 ______ 。
(6)依据整个反应流程判断反应②的目的是 ______ 。
19.用ClO2消毒的饮用水中会含有ClO2、ClO2−和ClO3−,化学小组用如下方法测定预处理后的饮用水中ClO2、ClO2−和ClO3−的含量和总量(总氯)。
资料:氧化性强弱:ClO2>ClO2−>ClO3−;I2+2Na2S2O3=2NaI+Na2S4O6(Na2S2O3和Na2S4O6溶液颜色均为无色)
Ⅰ.ClO2和ClO2−含量的测定
①向v1mL的饮用水中加入过量KI溶液,用amol/LNa2S2O3标准溶液滴定至终点。消耗Na2S2O3溶液v2mL;
②向①中反应后的溶液中,加入盐酸调节溶液pH=2,充分反应后,继续用amol/LNa2S2O3标准溶液滴定至终点,又消耗Na2S2O3溶液v3mL。
Ⅱ.总氯的测定
③向v1mL的饮用水中加入过量KBr溶液,加入浓盐酸调节溶液pH=0.5,密封放置20min;然后加入过量KI溶液,立即用饱和磷酸氢二钠溶液调节溶液pH=1.5。
④用amol/LNa2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液v4mL。
⑤用v1mL的纯水重复③~⑤,消耗Na2S2O3溶液v5mL。
(1)配制vmL amol/LNa2S2O3标准溶液,需称量Na2S2O3固体______g。
(2)①中滴定时所用的指示剂应该是______,滴定至终点的现象是______。
(3)②中加入盐酸后发生反应的离子方程式是______。
(4)磷酸氢二钠(Na2HPO4)溶液呈碱性的原因是______。(结合离子方程式和必要的文字说明)
(5)③中加入KI后发生反应的化学方程式是______。
(6)水样中ClO3−的含量是______mg/L。
(7)测定总氯时不用KI直接反应,而是先加入KBr的原因是______。
答案和解析
1.【答案】C
【解析】解:A.羟基中O、H原子间共用1对电子,O原子的最外层电子数为7,其电子式为,故A错误;
B.丙烯结构简式为CH3CH=CH2,断裂碳碳双键发生加聚反应生成聚丙烯,则聚丙烯的结构简式为,故B错误;
C.基态Ga原子的核外电子排布式为[Ar]3d104s24p1,4s、4p能级上的电子为其价电子,价电子排布式为3d104s24p1,故C正确;
D.H2O是共价化合物,空间构型为V型,并且O原子半径大于H,则空间充填模型为,故D错误;
故选:C。
A.羟基中O原子的最外层电子数为7;
B.聚丙烯是丙烯加聚反应的产物,碳碳双键断裂形成;
C.基态Ga原子的核外电子排布式为[Ar]3d104s24p1,4s、4p能级上的电子为其价电子;
D.H2O的空间构型为V型,O原子半径大于H。
本题考查常见化学用语的表示方法,涉及电子式、结构简式、电子排布式和充填模型等知识,明确常见化学用语的书写原则即可解答,试题有利于提高学生的规范答题能力,题目难度不大。
2.【答案】A
【解析】解:A.氧气和臭氧均由氧原子构成,故3.2g氧气和臭氧的混合物中含有的氧原子的物质的量为0.2mol,个数为0.2NA个,故A正确;
B.金刚石为原子晶体,晶体中每个C原子与其它4个C形成了4个C−C共价键,根据均摊法,每个碳原子形成共价键的数目为:12×4=2,1molC能够形成2mol共价键,含有的共价键数为2NA,故B错误;
C.标况下,水不是气体,不能使用标况下的气体摩尔体积计算11.2L水的物质的量,故C错误;
D.溶液体积未知,无法计算硫酸根离子个数,故D错误;
故选:A。
A.氧气和臭氧均由氧原子构成;
B.金刚石中,每个C原子与其它4个C形成了4个C−C共价键,根据均摊法,每个碳原子形成共价键的数目为:12×4=2,据此计算出1mol碳原子形成的共价键数目;
C.标准状况下,水不是气体,不能使用标况下的气体摩尔体积计算水的物质的量;
D.溶液体积未知。
本题考查了阿伏加德罗常数的有关计算,难度不大,应注意公式的运用和物质的结构特点.
3.【答案】D
【解析】解:A.镁和钙为同主族元素,钙原子半径大于镁原子,失电子能量强于镁,Mg原子失电子能力比Ca弱,故A正确;
B.K的金属性大于镁,K与水反应比Mg与水反应剧烈,故B正确;
C.非金属性Cl>Br,氢化物HCl的稳定性强于HBr,故C正确;
D.非金属性P
A.同主族金属性增强;
B.金属性越强,金属与水反应的剧烈程度越大;
C.非金属性越强,形成的氢化物稳定性越强;
D.非金属元素的非金属性越强,对应最高价氧化物对应水化物形成的酸的酸性越强。
本题考查了周期表中的递变规律分析、金属性和非金属性的判断依据等,掌握基础是解题关键,题目难度不大。
4.【答案】C
【解析】解:由分析可知,A为C元素、B为N元素、E为O元素、W为S元素、Z为Cu元素;
A.同周期主族元素随原子序数增大第一电离能呈增大趋势,N元素原子2p轨道为半满稳定状态,其第一电离能大于同周期相邻元素,故第一电离能:N>O>C,故A错误;
B.碳单质的晶体中,金刚石属于共价晶体,而石墨属于混合型晶体,富勒烯属于分子晶体,故B错误;
C.O2能与H2S反应生成S和H2O,故C正确;
D.Z是Cu元素,Cu单质不能与稀硫酸反应,故D错误;
故选:C。
元素周期表中的五种元素A、B、E、W、Z,原子序数依次增大,其中A的基态原子价层电子排布为nsnnpn,由于s能级填充电子最多容纳2个电子,则n=2,故A为C元素;E的原子最外层电子数是其内层的3倍,由于最外层电子数不超过8,原子只能有2个电子层,最外层电子数为6,故E为O元素;W和E位于同一族,可知W为S元素;B的基态原子最外层有3个单电子,其原子序数介于碳、氧之间,故B为N元素;Z3+的3d轨道中有5个电子,可知Z原子外围电子排布式为3d64s2,故Z为Cu元素。
本题考查原子结构与元素周期律,推断元素是解题的关键,熟练掌握元素周期律与元素化合物知识,注意同周期主族元素第一电离能变化异常情况。
5.【答案】D
【解析】解:A.Na2O2和SiO2分别属于离子晶体、共价晶体,Na2O2熔化克服离子键、SiO2熔化克服共价键,类型不同,故A错误;
B.Mg和S分别属于金属晶体、分子晶体,Mg熔化克服金属键,硫熔化克服分子间作用力,类型不同,故B错误;
C.氯化钾和蔗糖分别属于离子晶体、分子晶体,氯化钾溶化克服离子键,蔗糖熔化克服分子间作用力,类型不同,故C错误;
D.碘和干冰升华均属于分子晶体,升华时均克服分子间作用力,类型相同,故D正确;
故选:D。
根据离子晶体熔化克服离子键,原子晶体熔化克服共价键,金属晶体熔化克服金属键,分子晶体熔化或升华克服分子间作用力,以此来解答。
本题考查晶体类型及化学键,为高频考点,明确不同类型的晶体在熔化时克服不同的作用力是解答本题的关键,题目难度不大,注意把握晶体类型.
6.【答案】D
【解析】解:A.N2和H2分子中存在的共价键为非极性键,由图可知,过程I中破坏的化学键均为非极性键,故A正确;
B.由图可知,过程I是N2和H2断裂化学键生成N和H原子的过程,吸收热量,过程Ⅱ放出能量是N和H原子生成NH3的过程,放出热量,故B正确;
C.由图可知,氨分解的热化学方程式为2NH3(g)⇌N2(g)+3H2(g)ΔH=2×(1175−1129)kJ⋅mol−1=+92kJ⋅mol−1,故C正确;
D.使用催化剂能降低反应的活化能,加快反应速率,但不能降低反应的焓变,故D错误,
故选:D。
A.过程I是N2和H2断裂化学键生成N和H原子的过程,N2和H2分子中存在非极性键;
B.断裂化学键吸热,形成化学键放热;
C.根据题给图示进行分析判断,氨分子断裂化学键放出能量,氮原子、氢原子分别形成氮分子、氢分子吸收能量,两种之差即为该反应的总能量;
D.使用催化剂能降低反应的活化能,加快反应速率,但不能降低反应的焓变,
本题考查反应热与焓变,为高频考点,把握反应中能量变化、吸放热反应的判定、焓变与物质具有总能量的关系为解答的关键,侧重分析与运用能力的考查,注意焓变的计算方法,题目难度不大。
7.【答案】C
【解析】解:A.含有酚羟基的有机物能和氯化铁溶液发生显色反应,A中含有酚羟基,所以能和氯化铁溶液发生显色反应,故A正确;
B.反应Ⅰ中−CHO转化为−CH(OH)−,反应Ⅱ中醇羟基转化为羰基,则前者为加成反应、后者为氧化反应,故B正确;
C.B中酚羟基、羧基都能和NaOH以1:1反应,1molB最多消耗2molNaOH,故C错误;
D.香兰素中苯环和醛基上的碳原子采用sp2杂化,甲基上的碳原子采用sp3杂化,所以香兰素中碳原子有两种杂化方式,故D正确;
故选:C。
A.含有酚羟基的有机物能和氯化铁溶液发生显色反应;
B.反应Ⅰ中−CHO转化为−CH(OH)−,反应Ⅱ中醇羟基转化为羰基;
C.B中酚羟基、羧基都能和NaOH以1:1反应;
D.香兰素中苯环和醛基上的碳原子采用sp2杂化,甲基上的碳原子采用sp3杂化。
本题考查有机物的结构和性质,侧重考查分析、判断及知识综合运用能力,明确官能团及其性质的关系是解本题关键,题目难度不大。
8.【答案】B
【解析】解:A.由表可知,升高温度化学平衡常数减小,平衡向逆反应方向移动,则该反应为放热反应,即ΔH<0,故A正确;
B.化学反应速率之比等于化学计量数之比,v(D)=0.02mol/(L⋅s),则v(A)=0.01mol/(L⋅s),Δc(A)=v(A)Δt=0.01mol/(L⋅s)×4s=0.04mol/L,4s时c(A)为0.3mol/L−0.04mol/L=0.26mol/L,故B错误;
C.已知1200℃时反应A(g)+B(g)⇌C(s)+2D(g)的化学平衡常数为0.4,C(s)+2D(g)⇌A(g)+B(g)的平衡常数与A(g)+B(g)⇌C(s)+2D(g)的化学平衡常数互为倒数,因此1200℃时反应C(s)+2D(g)⇌A(g)+B(g)的平衡常数为10.4=2.5,故C正确;
D.设830℃达平衡时,转化A的浓度为xmol/L,则有:
A(g)+B(g)⇌C(s)+2D(g)
始(mol/L) 0.3 0.3 0 0
转(mol/L) x x x 2x
平(mol/L) 0.3−x 0.3−x x 2x
K=c2(D)c(A)c(B)=(2x)2(0.3−x)2=1.0,解之得,x=0.1,A的转化率为:0.1mol/L0.3mol/L×100%=33.3%,故D正确;
故选:B。
A.升高温度平衡向吸热反应方向移动;
B.化学反应速率之比等于化学计量数之比,v(D)=0.02mol/(L⋅s),则v(A)=0.01mol/(L⋅s),代入Δc(A)=v(A)Δt即可得4s时c(A);
C.互为可逆反应的两反应的化学平衡常数互为倒数;
D.设830℃达平衡时,转化A的浓度为xmol/L,列反应A(g)+B(g)⇌C(s)+2D(g)的三段式,代入公式K=c2(D)c(A)c(B)即可得,x=0.1,进而得A的转化率。
本题主要考查化学平衡的计算,为高频考点,题目难度一般。
9.【答案】C
【解析】解:A.反应为2NO2(g)⇌N2O4(g),则△c(NO2):△c(N2O4)=2:1,由图可知,b点所在曲线表示c(NO2)随时间变化,a点后c(NO2)增大、c(N2O4)减小,所以a点时反应正在逆向进行,故A正确;
B.由图可知,b点时c(NO2)和c(N2O4)不再变化,反应达到平衡状态,则b点的正反应速率等于逆反应速率,故B正确;
C.正反应2NO2(g)⇌N2O4(g)是气体体积减小的放热反应,减小压强时平衡逆向移动,c(NO2)增大、c(N2O4)减小,降低温度时平衡正向移动,c(NO2)减小、c(N2O4)增大,则25min时导致平衡移动原因是增大压强或降低温度,故C错误;
D.反应进行到10min时,NO2浓度增大0.4mol/L,即NO2物质的量增大了0.4mol/L×2L=0.8mol,且反应向逆反应方向移动,则反应吸收热量为0.8mol2×24.4kJ/mol=9.76kJ热量,故D正确;
故选:C。
A.反应为2NO2(g)⇌N2O4(g),则△c(NO2):△c(N2O4)=2:1,结合图象中各物质浓度变化分析判断;
B.物质的浓度不发生变化时表示化学反应处于平衡状态;
C.正反应2NO2(g)⇌N2O4(g)是气体体积减小的放热反应,减小压强时平衡逆向移动,降低温度时平衡正向移动;
D.反应向逆反应方向移动,反应进行到10min时,NO2浓度增大0.4mol/L,即NO2物质的量增大了0.4mol/L×2L=0.8mol,据此计算反应吸收的热量。
本题考查化学平衡图象,侧重考查学生的分析能力和计算能力,把握化学平衡影响因素、平衡状态的判定、反应热的计算等知识即可解答,题目难度不大。
10.【答案】B
【解析】解:A.PCHDL中酯基能发生水解反应生成和CO2、H2O、CH3CH2OH,所以PCHDL是一种可降解高分子材料,故A正确;
B.A属于酯类物质、HOCH2CH2OH属于醇类物质,二者结构不相似,所以不互为同系物,故B错误;
C.有机物B中含有4种氢原子,其核磁共振氢谱中有4组峰,故C正确;
D.A和B反应生成PCHDL和CH3CH2OH,所以该合成反应为缩聚反应,故D正确;
故选:B。
A.酯基能发生水解反应;
B.结构相似,在分子组成上相差1个或nCH2原子团的有机物互为同系物;
C.有机物中含有几种氢原子,其核磁共振氢谱中就有几组峰;
D.A和B反应生成PCHDL和CH3CH2OH。
本题考查有机物的合成,侧重考查分析、判断及知识综合运用能力,明确缩聚反应特点、同系物概念的内涵、氢原子种类与核磁共振氢谱吸收峰的关系是解本题关键,题目难度不大。
11.【答案】B
【解析】解:A.氨水呈碱性,向CuSO4溶液中滴加氨水,先生成氢氧化铜的蓝色沉淀,继续滴加氨水,蓝色沉淀溶解发生反应,形成铜氨([Cu(NH3)4]2+)溶液,为深蓝色溶液,故A正确;
B.[Cu(NH3)4]2+和S2−反应生成CuS黑色沉淀,则离子方程式为.[Cu(NH3)4]2++S2−=CuS↓+4NH3,故B错误;
C.产生蓝色沉淀,是Cu2+和OH−反应生成蓝色沉淀Cu(OH)2,则Cu2++4NH3⇌[Cu(NH3)4]2+酸性条件下生成更多的Cu2+,故C正确;
D.Cu2++4NH3⇌[Cu(NH3)4]2+碱性性条件下生成蓝色沉淀Cu(OH)2,平衡逆向移动生成氨气,故D正确,
故选:B。
A.氨水呈碱性,向CuSO4溶液中滴加氨水,先生成氢氧化铜的蓝色沉淀,继续滴加氨水,蓝色沉淀溶解发生反应,形成铜氨溶液,为深蓝色溶液;
B.[Cu(NH3)4]2+和S2−反应生成CuS黑色沉淀;
C.Cu2+和OH−反应生成蓝色沉淀,则[Cu(NH3)4]2+,酸性条件下转化成Cu2+;
D.蓝色沉淀为氢氧化铜,则气体为氨气。
本题考查了铜及其化合物性质的分析应用、平衡移动原理等,注意根据物质的颜色判断平衡移动方向。
12.【答案】B
【解析】解:A.铁和氨气在640℃可发生置换反应,产物之一为铁氮化合物,根据原子守恒,另一种产物为氢气,故A正确;
B.a位置的Fe位于顶点,距顶点的Fe最近的Fe位于距a位置最近的b位置,个数为3×82=12,故B错误;
C.X−射线衍射法是测定晶体结构最科学的方法,通过晶体的X−射线衍射实验获取晶体结构信息,故C正确;
D.由图2可知,更稳定的Cu替代型产物为Cu替代a位置Fe型,其化学式为,Cu位于顶点,个数为8×18=1,Fe位于面心,个数为6×12=3,1个N位于体心,其化学式Fe3CuN,故D正确;
故选:B。
A.铁和氨气在640℃可发生置换反应;
B.a位置的Fe位于顶点,距顶点的Fe最近的Fe位于距a位置最近的b位置;
C.X−射线衍射法是测定晶体结构最科学的方法;
D.由图2可知,更稳定的Cu替代型产物为Cu替代a位置Fe型。
本题考查晶胞的计算,把握原子的位置、均摊法计算为解答的关键,侧重分析与计算能力的考查,题目难度中等。
13.【答案】C
【解析】解:A.H2C2O4有酸性,能够与Ca(OH)2溶液发生反应Ca(OH)2+H2C2O4=CaC2O4↓+2H2O,对应的离子方程式为:Ca2++2OH−+H2C2O4=CaC2O4↓+2H2O,故A正确;
B.酸性H2C2O4>H2CO3,向少量NaHCO3溶液中加入草酸会生成CO2和NaHC2O4,反应的化学方程式为:NaHCO3+H2C2O4=NaHC2O4+CO2↑+H2O,故B正确;
C.H2C2O4有还原性,能被酸性KMnO4溶液氧化生成CO2,H2C2O4是弱电解质,离子方程式中应保留化学式,离子方程式为:2MnO4−+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,故C错误;
D.H2C2O4是二元羧酸,可以与乙醇发生酯化反应,其完全酯化的化学方程式为,故D正确;
故选:C。
A.酸可与碱发生中和反应;
B.发生强酸制取弱酸的反应;
C.草酸为弱酸,在离子反应中保留化学式;
D.草酸含−COOH,可发生酯化反应。
本题考查物质的性质实验,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与实验能力的考查,注意草酸为弱酸,题目难度不大。
14.【答案】A
【解析】解:A.氯水可氧化碘离子生成碘,碘易溶于四氯化碳,则下层溶液显紫色,可知原溶液中有I−,故A正确;
B.Fe与硝酸反应生成硝酸铁,过量Fe与硝酸铁反应生成硝酸亚铁,滴入K3[Fe(CN)6]溶液,与亚铁离子反应产生蓝色沉淀,故B错误;
C.FeCl3溶液过量,与再滴加的2滴0.02mol/LKSCN溶液反应,则溶液的颜色加深,不能证明浓度对平衡移动的影响,故C错误;
D.生成的乙炔中混有硫化氢等,均使酸性高锰酸钾溶液褪色,紫色褪去,不能证明乙炔具有还原性,故D错误;
故选:A。
A.氯水可氧化碘离子生成碘,碘易溶于四氯化碳;
B.Fe与硝酸反应生成硝酸铁,过量Fe与硝酸铁反应生成硝酸亚铁;
C.FeCl3溶液过量,与再滴加的2滴0.02mol/LKSCN溶液反应;
D.生成的乙炔中混有硫化氢等,均使酸性高锰酸钾溶液褪色。
本题考查化学实验方案的评价,为高频考点,把握物质的性质、反应与现象、实验技能为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难度不大。
15.【答案】(1)(SCN)x
(2)①向洗净的白色沉淀中加入过量的稀硝酸,沉淀完全溶解,再滴加少量KMnO4溶液,不褪色
②避免混合气体中大量的NO2使溶液呈酸性,干扰检验CO2和SO2
③CO2、SO42−
(3)①加快浓硝酸氧化(SCN)x的化学反应速率
②实验一中存在反应:a.浓硝酸氧化SCN−,b.浓硝酸氧化(SCN)x,化学反应速率:υa>υb,所以ⅱ中溶液立即变红;静置过程中,生成的NO2溶于硝酸,浓度积累到一定程度时,使υb增大,红色迅速褪去
【解析】【分析】
本题以浓硝酸的强氧化性为载体,探究KSCN被硝酸氧化的反应原理,准确利用实验现象,综合分析实验原理是解题关键,难点是通过实验一和实验三的对比明确NO2的催化作用,基础考查,难度中等。
【解答】
(1)黄色的(SCN)2可聚合为红色的(SCN)x,则向浓硝酸中滴加KSCN溶液变红色,说明反应中生成了(SCN)x。
(2)①实验一ⅲ中的气体通入Ba(OH)2和NaOH的混合溶液中生成的白色沉淀能完全溶解于稀硝酸,说明此沉淀不是BaSO3或BaSO4沉淀,且反应后的溶液中滴加酸性KMnO4溶液,紫色不褪去,可知沉淀为BaCO3,证明红棕色气体中无SO2。
②NO2溶于水生成HNO3,而HNO3能溶解BaCO3,则a中,Ba(OH)2溶液中加入NaOH溶液以增大OH−浓度的目的是避免混合气体中大量的NO2使溶液呈酸性,溶解BaCO3或氧化BaSO3沉淀,干扰检验CO2和SO2。
③混合气体成分是NO2和CO2,根据元素守恒,溶液中含有SO42−,则SCN−被氧化的最终产物中一定有CO2、SO42−。
(3)①实验一与实验三比较是硝酸中增加了溶解的NO2,生成的红色(SCN)x迅速褪色,反应速率加快,说明NO2能加快浓硝酸氧化(SCN)x的化学反应速率,起催化作用。
②实验一ⅱ中有(SCN)x生成,而ⅲ中当NO2的浓度达到一定程度时(SCN)x迅速被氧化,说明实验一中存在反应:a.浓硝酸氧化SCN−,b.浓硝酸氧化(SCN)x,化学反应速率:υa>υb,所以ⅱ中溶液立即变红;静置过程中,生成的NO2溶于硝酸,浓度积累到一定程度时,使υb增大,红色迅速褪去。
16.【答案】第六周期Ⅷ族 5d76s2 3p sp3 6 低温石英晶体密度为1.610−24×NAg⋅cm−3,超石英晶体密度为2.510−24×NAg⋅cm−3,低温石英密度更小,可在被撞击时转变为密度较大的超石英 超石英由于原子间距离过近,室温下不稳定,在高温下转变为低温石英的速率较快,因此火山喷发携带出的超石英在高温下会转变为低温石英,导致至今未发现过超石英 不同意,该反应只能说明在该条件下C的还原性大于Si的,而无法说明C的氧化性大于Si的,因此无法用来比较C和Si的非金属性强弱
【解析】解:(1)Ir为77号元素,位于元素周期表中第六周期Ⅷ族,价层电子排布式为5d76s2,
故答案为:第六周期Ⅷ族;5d76s2;
(2)①基态Si原子的价层电子排布式为3s23p2,最高能级符号是3p;由低温石英晶胞图可知,Si原子与4个O原子形成Si−Oσ键,为sp3杂化,
故答案为:3p;sp3;
②由超石英晶胞图可知,体心的Si原子与6个O原子成键,Si的紧邻O原子个数是6,
故答案为:6;
③由低温石英晶胞图可知,Si位于面上,个数为6×12=3,6个O原子位于体内,低温石英晶体密度为3×28+6×16NAsin60∘×(5×10−8)3g⋅cm−3=1800.9×53×10−24×NAg⋅cm−3=1.610−24×NAg⋅cm−3;由超石英晶胞图可知,Si位于顶点和体心,个数为8×18+1=2,O原子位于面上和体内,个数为4×12+2=4,超石英晶体密度为2×28+4×16NA4×10−8×4×10−8×3×10−8g⋅cm−3=12042×3×10−24×NAg⋅cm−3=2.510−24×NAg⋅cm−3,低温石英密度更小,可在被撞击时转变为密度较大的超石英,
故答案为:低温石英晶体密度为1.610−24×NAg⋅cm−3,超石英晶体密度为2.510−24×NAg⋅cm−3,低温石英密度更小,可在被撞击时转变为密度较大的超石英;
④由图a和图b可知,超石英中Si−O原子间距离比低温石英中Si−O原子距离小,由图c可知,Si−O原子间距离越小,原子间能量越大,故超石英中Si−O原子距离过近,能量比较高,室温下不稳定,在高温下转变为低温石英的速率较快,因此火山喷发携带出的超石英在高温下会转变为低温石英,导致人们在火山活动等高温地区的地表层尚未发现过超石英,
故答案为:超石英由于原子间距离过近,室温下不稳定,在高温下转变为低温石英的速率较快,因此火山喷发携带出的超石英在高温下会转变为低温石英,导致至今未发现过超石英;
(3)焦炭在高温下还原SiO2可制备粗硅,并得到CO,反应方程式为:;由反应方程式可知,C为还原剂,Si为还原产物,还原性:C>Si,无法说明C的氧化性比Si的强,因此无法用来比较C和Si的非金属性强弱,
故答案为:;不同意,该反应只能说明在该条件下C的还原性大于Si的,而无法说明C的氧化性大于Si的,因此无法用来比较C和Si的非金属性强弱。
(1)Ir为77号元素;
(2)①基态Si原子的价层电子排布式为3s23p2;由低温石英晶胞图可知,Si原子与4个O原子形成Si−Oσ键;
②由超石英晶胞图可知,体心的Si原子与6个O原子成键;
③撞击过程中,密度小的物质可转化为密度大的物质;
④由图a和图b可知,超石英中Si−O原子间距离比低温石英中Si−O原子距离小,由图c可知,Si−O原子间距离越小,原子间能量越大;
(3)焦炭在高温下还原SiO2可制备粗硅,并得到CO;根据氧化还原反应分析反应。
本题考查物质结构与性质,涉及核外电子排布、价层电子对互斥理论、杂化方式、晶体结构与性质、化学反应式书写等知识点,需要学生具备扎实的基础与灵活运用能力,题目难度中等。
17.【答案】H2O>CO2>CH4 H2O(g)=H2O(l)ΔH4或H2O(l)=H2O(g)ΔH4 (−285.8+283)kJ/mol−ΔH4或(−285.8+283)kJ/mol+ΔH4 22.25 *OCOH―*O=*CHO或*OCOH=*CHO+*O 温度高于500℃后,因积碳或超过了催化剂的活性温度等,致使催化剂对反应Ⅰ的催化效率降低,反应Ⅰ反应速率减慢,造成甲烷的选择性下降,而反应Ⅱ、Ⅲ的反应速率仍有所增加,二氧化碳的转化率基本不变;温度高于500℃后,化学反应达到平衡状态,升高温度,反应Ⅰ、Ⅲ的化学平衡逆向移动,反应Ⅱ的化学平衡正向移动,可能使二氧化碳的转化率基本不变,而甲烷占含碳产物的比例下降,即选择性下降 升高温度,反应Ⅰ(和Ⅲ)的平衡左移使二氧化碳的平衡转化率降低;反应Ⅱ的平衡右移,使二氧化碳的平衡转化率增大;因此,图像中拐点前体系中以反应Ⅰ(和Ⅲ)为主,拐点后体系中以反应Ⅱ为主。图中P1>P2,高压条件下更有利于反应Ⅰ(和Ⅲ),因此P1条件下需要更高温度才能抑制反应Ⅰ(和Ⅲ),促进反应Ⅱ,使体系中的反应Ⅱ成为主要方面
【解析】解:(1)分子晶体中分子间氢键大于范德华力,同为范德华力,相对分子质量越大,范德华力越大,沸点越高,CO2、CH4、H2O均为分子晶体,水分子间存在氢键,CO2、CH4分子间为范德华力,H2O的沸点最大,CO2相对分子质量大于CH4,即沸点大小顺序是H2O>CO2>CH4,
故答案为:H2O>CO2>CH4;
(2)①氢气燃烧热的化学方程式为H2(g)+12O2(g)=H2O(l) ΔH=−285.8kJ/mol;CO燃烧热的化学方程式为CO(g)+12O2(g)=CO2(g) ΔH=−283kJ/mol;则ΔH2需要判断H2O(g)=H2O(l) ΔH4或H2O(l)=H2O(g) ΔH4,
故答案为:H2O(g)=H2O(l) ΔH4或H2O(l)=H2O(g) ΔH4;
②H2(g)+12O2(g)=H2O(l) ΔH=−285.8kJ/mol①;CO(g)+12O2(g)=CO2(g) ΔH=−283kJ/mol②;H2O(g)=H2O(l) ΔH4③;根据目标反应方程式,可知①−②−③,ΔH2=(−285.8+283)kJ/mol−ΔH4,若H2O(l)=H2O(g) ΔH4④,根据目标反应方程式可知,①−②+④,ΔH2=(−285.8+283)kJ/mol+ΔH4,
故答案为:(−285.8+283)kJ/mol−ΔH4或(−285.8+283)kJ/mol+ΔH4;
(3)二氧化碳的结构式为O=C=O,其电子式为;根据ΔH=反应物键能总和―生成物键能总和,因此有799×2+4E(H−H)―[4E(C−H)+4×463]=−165,解得E(H−H)―E(C−H)=22.25kJ/mol,
故答案为:;22.25;
(4)活化能越小,化学反应速率越快,TS1、TS2、TS3所对应的反应速率快,活化能大为该途径的决速步,因此化学方程式为*OCOH―*O=*CHO或*OCOH=*CHO+*O,
故答案为:*OCOH―*O=*CHO或*OCOH=*CHO+*O;
(5)温度高于500℃后,CO2的转化率几乎保持不变但CH4的选择性下降的可能原因是温度高于500℃后,因积碳或超过了催化剂的活性温度等,致使催化剂对反应Ⅰ的催化效率降低,反应Ⅰ反应速率减慢,造成甲烷的选择性下降,而反应Ⅱ、Ⅲ的反应速率仍有所增加,二氧化碳的转化率基本不变;温度高于500℃后,化学反应达到平衡状态,升高温度,反应Ⅰ、Ⅲ的化学平衡逆向移动,反应Ⅱ的化学平衡正向移动,可能使二氧化碳的转化率基本不变,而甲烷占含碳产物的比例下降,即选择性下降,
故答案为:温度高于500℃后,因积碳或超过了催化剂的活性温度等,致使催化剂对反应Ⅰ的催化效率降低,反应Ⅰ反应速率减慢,造成甲烷的选择性下降,而反应Ⅱ、Ⅲ的反应速率仍有所增加,二氧化碳的转化率基本不变;温度高于500℃后,化学反应达到平衡状态,升高温度,反应Ⅰ、Ⅲ的化学平衡逆向移动,反应Ⅱ的化学平衡正向移动,可能使二氧化碳的转化率基本不变,而甲烷占含碳产物的比例下降,即选择性下降;
(6)拐点的温度P1高于P2,原因是升高温度,使反应Ⅰ(和Ⅲ)的平衡左移,二氧化碳的平衡转化率降低;反应Ⅱ的平衡右移,二氧化碳的平衡转化率增大;图像中拐点前体系中以反应Ⅰ(和Ⅲ)为主,拐点后以反应Ⅱ为主;图中P1>P2,高压条件下更有利于反应Ⅰ(和Ⅲ),则P1条件下需要更高温度才能抑制反应Ⅰ(和Ⅲ),促进反应Ⅱ,使体系中的反应Ⅱ成为主要方面,
故答案为:升高温度,反应Ⅰ(和Ⅲ)的平衡左移使二氧化碳的平衡转化率降低;反应Ⅱ的平衡右移,使二氧化碳的平衡转化率增大;因此,图像中拐点前体系中以反应Ⅰ(和Ⅲ)为主,拐点后体系中以反应Ⅱ为主。图中P1>P2,高压条件下更有利于反应Ⅰ(和Ⅲ),因此P1条件下需要更高温度才能抑制反应Ⅰ(和Ⅲ),促进反应Ⅱ,使体系中的反应Ⅱ成为主要方面。
(1)三种物质均为分子晶体,水分子间存在氢键,CO2、CH4不含分子间氢键,H2O的沸点最大,CO2相对分子质量大于CH4;
(2)①氢气燃烧热的化学方程式为H2(g)+12O2(g)=H2O(l) ΔH=−285.8kJ/mol;CO燃烧热的化学方程式为CO(g)+12O2(g)=CO2(g) ΔH=−283kJ/mol;根据目标反应方程式可知;
②H2(g)+12O2(g)=H2O(l) ΔH=−285.8kJ/mol①;CO(g)+12O2(g)=CO2(g) ΔH=−283kJ/mol②;H2O(g)=H2O(l) ΔH4③;根据目标反应方程式,可知①−②−③,ΔH2=−285.8+283−ΔH4,若H2O(l)=H2O(g) ΔH4④,根据目标反应方程式可知,①−②+④;
(3)二氧化碳的结构式为O=C=O,其电子式为;根据ΔH=反应物键能总和―生成物键能总和;
(4)活化能越小,化学反应速率越快,根据图像可知,TS1、TS2、TS3所对应的反应速率快,活化能大为该途径的决速步;
(5)温度高于500℃后,CO2的转化率几乎保持不变但CH4的选择性下降的可能原因是(速率角度)温度高于500℃后,因积碳或超过了催化剂的活性温度等,致使催化剂对反应Ⅰ的催化效率降低,反应Ⅰ反应速率减慢,造成甲烷的选择性下降,而反应Ⅱ、Ⅲ的反应速率仍有所增加,可以保持二氧化碳的转化率基本不变;
(6)P1时曲线出现拐点的温度高于P2时的,原因是升高温度,使反应Ⅰ(和Ⅲ)的平衡左移使二氧化碳的平衡转化率降低;反应Ⅱ的平衡右移,二氧化碳的平衡转化率增大。因此,图像中拐点前体系中以反应Ⅰ(和Ⅲ)为主,拐点后体系中以反应Ⅱ为主。
本题反应中的能量变化和化学平衡,侧重考查学生焓变和平衡图像的掌握情况,试题难度中等。
18.【答案】羧基 ClCH2COOH+2NaOH→△H2OHOCH2COONa+NaCl+H2O、HOCH2COO−+H+→HOCH2COOH 取代反应 、、 保护醛基
【解析】解:(1)A的分子式为C2H4O2,不饱和度为1,A可以与Na2CO3溶液反应产生CO2,说明A含有的官能团只有羧基,
故答案为:羧基;
(2)B→X的过程中,有关反应方程式为ClCH2COOH+2NaOH→△H2OHOCH2COONa+NaCl+H2O、HOCH2COO−+H+→HOCH2COOH,
故答案为:ClCH2COOH+2NaOH→△H2OHOCH2COONa+NaCl+H2O、HOCH2COO−+H+→HOCH2COOH;
(3)反应①是CH3COOH转化为ClCH2COOH,该反应类型为取代反应,
故答案为:取代反应;
(4)由分析可知,Y的结构简式为,
故答案为:;
(5)合成E分三步进行,③为取代反应,该过程是氯原子取代−OH,可知E为,在酸性条件下反应产生中间产物1为,中间产物1的醛基与氨基再发生消去反应产生中间产物2为,中间产物2异构生成,
故答案为:、、;
(6)反应②中消除醛基,D的系列转化过程中存在氨基与羧基的反应,而在生成E的三步反应中第一步重新引入消除的醛基、第二步是醛基与氨基反应,可知整个反应②的目的是保护醛基,防止在D系列转化中醛基与氨基反应,
故答案为:保护醛基。
A的分子式为C2H4O2,(1)中A可以与Na2CO3溶液反应产生CO2,说明A含有羧基,结合B的结构简式(ClCH2COOH),可推知A为CH3COOH;(2)中X含三种元素,由B的结构简式、C的分子式,可知B中氯原子被羟基替代生成X,X中羟基发生醇的催化氧化生成C,推知X为HOCH2COOH、C为OHC−COOH,(4)中Y含有酯基,结合D的结构简式、反应条件,可知X与乙醇在浓硫酸、共热条件下生成Y为,与NaOH溶液共热发生酯的水解反应、然后酸化生成D(),经一系列反应产生,合成E经过3步反应,而(5)中E生成F的反应为取代反应,该过程是氯原子取代−OH,可知E为,在酸性条件下反应产生中间产物1为,中间产物1的醛基与氨基再发生消去反应产生中间产物2为,中间产物2异构生成。
本题考查有机物的推动与合成,涉及官能团、有机反应方程式的书写、有机反应类型、对步骤的分析评价等,充分利用转化中有机物结构简式、分子式进行分析推断,题目较好地考查了学生自学能力、分析推理能力、知识迁移运用能力。
19.【答案】0.158av 淀粉 加入最后一滴标准液,溶液由蓝色变为无色,且30s内不变色 4I−+ClO2−+4H+=2I2+Cl−+2H2O HPO42−既能电离:HPO42−⇌PO43−+H+,又能水解HPO42−+H2O⇌H2PO4−+OH−,且水解程度大于电离程度,则溶液中c(OH−)>c(H+) Br2+2KI=2KBr+I2 501000×av3v1 饮用水中含有少量O2,可将KI氧化为I2,使测定结果偏高
【解析】解:(1)根据题意,配制vmLamol/LNa2S2O3标准溶液,根据n=c⋅V=vmL×amol/L1000mL/L=va10−3mol,m=nM=va10−3mol×158g/mol=0.158avg,
故答案为:0.158av;
(2)向v1mL的饮用水中加入过量KI溶液,ClO2可将I−氧化为I2,用amol/LNa2S2O3标准溶液滴定,发生反应:I2+2Na2S2O3=2NaI+Na2S4O6,可看出Na2S2O3标准溶液与I2反应,根据I2遇淀粉变蓝可知指示剂为淀粉,则滴定终点的现象是加入最后一滴标准液,溶液由蓝色变为无色,且30s内不变色,
故答案为:淀粉;加入最后一滴标准液,溶液由蓝色变为无色,且30s内不变色;
(3)向①中反应后的溶液中,加入盐酸调节溶液pH=2,ClO2−在酸性环境下将I−氧化为I2,离子方程式为:4I−+ClO2−+4H+=2I2+Cl−+2H2O,
故答案为:4I−+ClO2−+4H+=2I2+Cl−+2H2O;
(4)磷酸氢二钠(Na2HPO4)溶液呈碱性的原因是HPO42−既能电离:HPO42−⇌PO43−+H+,又能水解HPO42−+H2O⇌H2PO4−+OH−,且水解程度大于电离程度,则溶液中c(OH−)>c(H+),使磷酸氢二钠(Na2HPO4)溶液呈碱性,
故答案为:HPO42−既能电离:HPO42−⇌PO43−+H+,又能水解HPO42−+H2O⇌H2PO4−+OH−,且水解程度大于电离程度,则溶液中c(OH−)>c(H+);
(5)向v1mL的饮用水中加入过量KBr溶液,加入浓盐酸调节溶液pH=0.5,ClO2、ClO2−和ClO3−均能将Br−氧化为Br2,然后加入过量KI溶液,Br2可将I−氧化为I2,化学方程式为:Br2+2KI=2KBr+I2,
故答案为:Br2+2KI=2KBr+I2;
(6)由实验Ⅰ②知,ClO3−将I−氧化为I2,I2用Na2S2O3标准溶液滴定,I2+2Na2S2O3=2NaI+Na2S4O6,则依据电子转移守恒有如下关系:ClO3−~6Na2S2O3,则ClO3−的含量为amol/L×v3mL×6×83.5g/mol×1000mg/gv1mL=501000×av3v1mg/L,
故答案为:501000×av3v1;
(7)由于饮用水中含有少量O2,可将KI氧化为I2,使滴定结果偏高,故测定总氯时不用KI直接反应,而是先加入KBr,
故答案为:饮用水中含有少量O2,可将KI氧化为I2,使测定结果偏高。
(1)根据题意,配制vmLamol/LNa2S2O3标准溶液,根据n=c⋅V,m=nM进行计算;
(2)向v1mL的饮用水中加入过量KI溶液,ClO2可将I−氧化为I2,用amol/LNa2S2O3标准溶液滴定,发生反应:I2+2Na2S2O3=2NaI+Na2S4O6,可看出Na2S2O3标准溶液与I2反应,根据I2遇淀粉变蓝可知;
(3)向①中反应后的溶液中,加入盐酸调节溶液pH=2,ClO2−在酸性环境下将I−氧化为I2;
(4)HPO42−既能电离:HPO42−⇌PO43−+H+,又能水解HPO42−+H2O⇌H2PO4−+OH−,且水解程度大于电离程度
(5)向v1mL的饮用水中加入过量KBr溶液,加入浓盐酸调节溶液pH=0.5,ClO2、ClO2−和ClO3−均能将Br−氧化为Br2,然后加入过量KI溶液,Br2可将I−氧化为I2;
(6)由实验Ⅰ②知,ClO3−将I−氧化为I2,I2用Na2S2O3标准溶液滴定,I2+2Na2S2O3=2NaI+Na2S4O6,则依据电子转移守恒有如下关系:ClO3−~6Na2S2O3进行计算;
(7)饮用水中含有少量O2,可将KI氧化为I2。
本题考查饮用水中Cl元素的含量测定,注意掌握氧化还原滴定、氧化还原计算、误差的分析等,题目难度中等。
北京市清华大学附属中学2023-2024学年高三上学期开学考试化学试题: 这是一份北京市清华大学附属中学2023-2024学年高三上学期开学考试化学试题,共9页。
2023-2024学年北京市大兴重点中学高三(上)月考化学试卷(10月份)(含解析): 这是一份2023-2024学年北京市大兴重点中学高三(上)月考化学试卷(10月份)(含解析),共19页。试卷主要包含了单选题,简答题等内容,欢迎下载使用。
安徽重点大学附属中学2024届高三上学期第一次素质测试化学试题 Word版含解析: 这是一份安徽重点大学附属中学2024届高三上学期第一次素质测试化学试题 Word版含解析,文件包含安徽重点大学附属中学2024届高三上学期第一次素质测试化学试题Word版含解析docx、安徽重点大学附属中学2024届高三上学期第一次素质测试化学试题Word版无答案docx等2份试卷配套教学资源,其中试卷共29页, 欢迎下载使用。












