

北京市清华大学附属中学朝阳学校2023-2024学年高三下学期开学考化学试题
展开2024年2月29日
(考试时间90分钟满分100分)
可能用到的相对原子质量:
第一部分(选择题共42分)
每小题只有一个选项符合题意(每小题3分)
1.下列关于及构成微粒的化学用语或图示表达不正确的是( )
A.O的原子结构示意图:B.基态C原子的轨道表示式:
C.C原子杂化轨道示意图:D.的分子结构模型:
2.表示下列反应的方程式正确的是( )
A.铁粉与水蒸气共热,生成可燃性气体:
B.向溶液中加入铜片,溶液由黄色变成蓝色:
C.向浊液中加入溶液,生成红褐色沉淀:
D.向溶液中滴加溶液,溶液由浅绿色变成黄色:
3.下列事实不能用平衡移动原理解释的是( )
A.密闭烧瓶内的和的混合气体,受热后颜色加深
B.溶液将水垢中的转化为
C.的醋酸溶液稀释10倍,溶液的
D.溶液中滴加溶液,促进分解
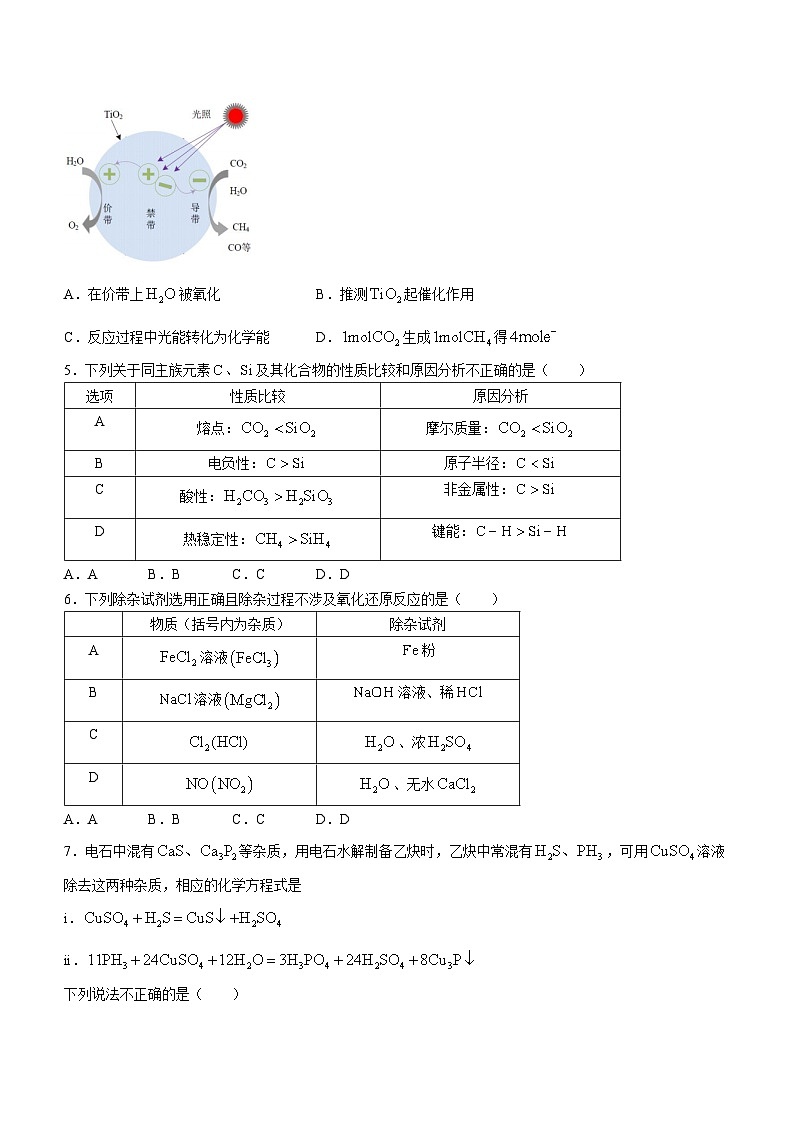
4.光催化反应机理如图所示,当催化剂受到能量大于禁带宽度的光照时,价带上的电子被激发,跃迁到导带,同时形成空穴.导带上的光生电子( eq \\ac(○,-))作还原剂,价带上的光生空穴作氧化剂,下列说法不正确的是( )
A.在价带上被氧化B.推测起催化作用
C.反应过程中光能转化为化学能D.生成得
5.下列关于同主族元素及其化合物的性质比较和原因分析不正确的是( )
A.AB.BC.CD.D
6.下列除杂试剂选用正确且除杂过程不涉及氧化还原反应的是( )
A.AB.BC.CD.D
7.电石中混有等杂质,用电石水解制备乙炔时,乙炔中常混有,可用溶液除去这两种杂质,相应的化学方程式是
i.
ii.
下列说法不正确的是( )
A.反应i不能说明的酸性强于
B.完全反应时,可氧化
C.会干扰酸性溶液对乙炔性质的检验
D.的水解方程式:
水解方程式:
8.用图所示的实验装置,按下列实验设计不能完成的实验是( )
A.AB.BC.CD.D
9.室温下,将溶液与过量固体混合,溶液随时间变化如图所示.
已知:
下列说法不正确的是( )
A.两者混合发生反应:
B.随着反应的进行,逆向移动,溶液下降
C.充分反应后上层清液中约为
D.内上层清液中存在:
10.甲醛水溶液久置会发生聚合,生成低聚甲醛,反应如下(均为放热反应):
下列说法不正确的是( )
A.生成低聚甲醛的过程中,发生了加成、取代反应
B.低聚甲醛的生成可能导致甲醛溶液出现浑浊
C.在回流装置中加热久置的甲醛溶液到一定温度,甲醛可再生
D.向久置的甲醛溶液中加入酸性溶液,若褪色证明甲醛有剩余
11.我国科学家成功制得新型的可化学循环的高分子材料,其合成路线如下(部分试剂和反应条件略去).
下列说法不正确的是( )
A.反应①中,标记*的碳原子被还原B.可用银氨溶液检验化合物Ⅲ中的官能团
C.反应②和反应③都发生了键的断裂D.聚合物Ⅳ可以通过水解反应降解为小分子
12.钛酸钡是电子陶瓷基础母体原料,超细微粉体的制备方法如下.
已知:
下列说法不正确的是( )
A.向中先加入,可防止其水解生成
B.得到溶液1的反应
C.加入过量氨水,有利于提高的产率
D.“煅烧”得到的气体A是和的混合物
13.中国科学家首次用改性铜基催化剂,将草酸二甲酯加氢制乙二醇的反应条件从高压降至常压.草酸二甲酯加氢的主要反应有:
①
草酸二甲酯 乙醇酸甲酯
②
③
其他条件相同时,相同时间内温度对产物选择性的影响结果如图.
已知:i.物质B的选择性
ⅱ.,反应③的平衡常数远大于反应①和反应②的平衡常数
下列说法不正确的是( )
A.制乙二醇适宜的温度范围是
B.实验条件下反应③的活化能最高,升温更有利于反应③
C.减压可提高乙二醇的平衡产率
D.铜基催化剂用改性后反应速率增大,可以降低反应所需的压强
14.小组同学探究和物质A的反应,实验如下.
下列分析不正确的是( )
A.②中铜粉溶解的原因:
B.①中产生的原因:时直接将还原为
C.若向③中加入固体,推测铜粉会溶解
D.①②③现象的差异不仅与物质氧化性(或还原性)强弱有关,也与反应速率有关
第二部分
本部分共5题,共58分.
15.(11分)青蒿素是治疗疟疾的有效药物,白色针状晶体,溶于乙醇和乙醚,对热不稳定.青蒿素晶胞(长方体,含4个青蒿素分子)及分子结构如下图所示.
(1)提取青蒿素
在浸取、蒸馏过程中,发现用沸点比乙醇低的乙醚提取,效果更好.
①乙醚沸点低于乙醇,原因是______________________________.
②用乙醚提取效果更好,原因是______________________________.
(2)确定结构
①测量晶胞中各处电子云密度大小,可确定原子的位置、种类.比较青蒿素分子中的原子核附近电子云密度大小:_____________.
②图中晶胞的棱长分别为,晶体的密度为__________.
(用表示阿伏加德罗常数;;青蒿素的相对分子质量为282)
③能确定晶体中哪些原子间存在化学键、并能确定键长和键角,从而得出分子空间结构的一种方法是______.
a.质谱法b.X射线衍射c.核磁共振氢谱d.红外光谱
(3)修饰结构,提高疗效
一定条件下,用将青蒿素选择性还原生成双氢青蒿素.
①双氢青蒿素分子中碳原子的杂化方式为__________.
②的空间结构为__________,中有__________配位键.
③比较水溶性:双氢青蒿素__________(填“”)青蒿素.
16.(11分)对烟气高效的脱硫、脱硝是防治空气污染的重要方式.
I.尿素液相脱硫脱硝
(1)尿素含有的氨基中的N原子可与形成配位键,原因是____________.
(2)尿素溶液吸收烟气中的,生成一种正盐和,反应的化学方程式是__________.
(3)研究发现,用尿素溶液吸收烟气中的时,脱除率很低.若与尿素溶液联用,将转化为,可大大提高的脱除率.与溶液反应可生成两种无毒无污染的气体,反应的化学方程式是___________________________.
Ⅱ.气相脱硫脱硝
一定温度下,将模拟烟气通入气相氧化反应器中.和的初始浓度相同,改变的浓度,相同时间内,气体的氧化率随与或的物质的量浓度之比的变化如图所示.其中分别为和单独通入反应器时的氧化率,分别为将和同时通入反应器时的氧化率.
已知:对于确定的基元反应,反应速率与速率常数成正比.
气相氧化的关键基元反应:
基元反应1:
基元反应2:
气相氧化的关键基元反应:
基元反应3:
基元反应4:
(4)单独氧化时,氧化率很低.原因是___________________________.
(5)将和同时通入气相氧化反应器中时,和的氧化率与将其单独通入反应器中时不同.原因分别是__________________________________.
(6)当体系中有水蒸气时,单独氧化的氧化率有很大提升.研究表明,此时被氧化不再经历基元反应3和基元反应4,而是生成两种常见的强酸.反应的化学方程式是_______________________.
17.(11分)艾瑞昔布是中国具有自主知识产权的新药,具有低毒、高效的抗炎止痛作用.艾瑞昔布的前体L的一种合成路线如下(部分试剂和反应条件已略去).
(1)A是苯的同系物,其苯环上的一溴代物只有一种.
①A的结构简式是__________________________________________________.
②的反应条件是__________________________________________________.
(2)的反应类型是__________________________________________________.
(3)发生氧化反应.
①若用溶液将D氧化为E,理论上D与的物质的量之比为___________.
②若用一定浓度的将D氧化为E,会生成副产物M.M的相对分子质量比E的相对分子质量大能与溶液反应生成.则D与M反应的化学方程式是_____________________________.
(4)反应的化学方程式是_____________________________________.
(5)发生取代反应.不饱和碳原子上的不易发生取代反应,但F中与硝基相连的不饱和碳原子上的易发生取代反应.原因是_____________________________.
(6)的转化经历如下多步.
已知:Ⅰ.
Ⅱ.
Ⅲ.碳碳双键连接羟基时,可通过重排生成含有“”的同分异构体
中间体1的结构简式是____________________________________________.
18.(11分)及其化合物在工业生产中具有重要的用途.
I.以含的矿石为原料,经硫酸溶解得到含的溶液,再经一系列处理后进行电解,获得金属.
(1)在__________(填“阳极”或“阴极”)生成.
(2)阳极泥中含有,写出产生的电极反应式:________________________.
Ⅱ.阳极泥中除含锰元素外,还含有铅元素,采用如下方法可将它们分别转化为活性和.
已知:在水中难解离.
(3)操作X为_______.
(4)①中反应的离子方程式为________________________________________.
(5)滤液C能循环使用,②中溶液B的溶质为___________.
(6)a.为了将③中完全转化为,理论上④中加入的与,的物质的量之比为_________(已知的还原产物为).
b.加入前,需将溶液调大至6左右.调节的目的是____________.
(7)活性纯度的测定
i.用溶液(酸化)溶解活性样品.
ii.用酸性标准溶液滴定i中剩余的,消耗标准溶液.
样品中的质量分数_________.
19.(14分)某小组同学探究与溶液的反应.
(1)实验I:用如下装置(夹持、加热仪器略)制备,将通入溶液中.
实验现象:A中产生白雾;C中溶液由黄色变成红棕色,静置后,溶液颜色从红棕色变回黄色,检测到;静置后,溶液变为浅绿色.
①浓与反应的化学方程式是______________________________.
②试剂a是_______.
(2)分析C中溶液颜色变化的原因.
①溶液颜色由黄色最终变为浅绿色的原因是____________________写离子方程式.
②针对溶液颜色变为红棕色,提出了两种假设.
假设1:主要与有关.
假设2:主要与有关
实验Ⅱ证实假设1不成立,假设2成立.
实验Ⅲ:向溶液中加入溶液,__________________(填现象),然后滴加____________(填试剂),溶液变为黄色.
(3)进一步探究与显红棕色的原因.
查阅资料:(红棕色)
实验Ⅲ:向溶液中滴加溶液,溶液由黄色变成红棕色,析出大量橙黄色沉淀.
甲同学认为橙黄色沉淀中可能含有,并设计如下检验方案.
①乙同学认为酸性溶液褪色不能证明橙黄色沉淀中含有,理由是_______.
②实验证实橙黄色沉淀中含有、不含,试剂分别是________、________.
(4)实验反思:实验I静置后溶液颜色由红棕色变回黄色可能的原因是___________.
高三二期开学检测答案
15.(11分)3
(1)①乙醇分子间能形成氢键(2分)②乙醚沸点低,蒸馏时所需温度低,青蒿素不易分解.(2分)
(2)①(1分)②(1分)③b(1分)
(3)①(1分)②四面体(1分)1(1分)③(1分)
16.(11分)
(1)N原子有孤电子对,有空轨道(2分)
(2)(2分)
(3)(2分)
(4)小,小,使小,小,导致氧化的总反应速率小(1分)
(5)与将和单独通入反应器比,将和同时通入反应器时,因大,大,使增大,增大,从而使的氧化率提高;又因部分参与了基元反应4,与反应的的浓度减小,减小,使的氧化率降低(2分)
(6)(2分)
17.(11分)
(1)①(1分)②光照(1分)
(2)取代反应(1分)
(3)①(1分)②(2分)
(4)(2分)
(5)受硝基的吸电子作用影响,与硝基相连的不饱和碳原子上的的极性增强,易断裂(2分)
(6)(1分)
18.(11分)(1)阴极(1分)(2)(2分)
(3)过滤(1分)
(4)(2)
(5)(1分)(6)a.(1分)
b.防止较低时(或)将氧化成(2分)(7)(1分)
19.(13分)(1)①(1分)
②饱和溶液(2分)
(2)①(2分)
②溶液变为红棕色(1分)硫酸(或盐酸)(1分)
(3)①溶液A中含有盐酸,也可能使酸性溶液褪色,干扰的检验(2分)
②溶液(1分)(氯水等合理答案)(1分)
(4)与发生氧化还原反应导致减小;反应生成的导致减小;逆向移动,溶液由红棕色变黄色(2分)
选项
性质比较
原因分析
A
熔点:
摩尔质量:
B
电负性:
原子半径:
C
酸性:
非金属性:
D
热稳定性:
键能:
物质(括号内为杂质)
除杂试剂
A
溶液
粉
B
溶液
溶液、稀
C
、浓
D
、无水
选项
实验目的
实验设计
A
减缓铁的腐蚀
X为石墨棒,溶液含,开关K置于A处
B
模拟铁的吸氧腐蚀
X为锌棒,溶液含开关K置于B处
C
在铁棒上镀铜
X为铜棒,溶液含开关K置于A处
D
比较铁和铜的金属活动性强弱
X为铜棒,溶液含,开关K置于B处
装置
序号
物质A
实验现象
①
溶液(调)
铜粉溶解,溶液变为深棕色
[经检验含]
②
溶液
铜粉溶解,溶液变为蓝绿色
③
溶液(调)
无明显变化
1
2
3
4
5
6
7
8
9
10
11
12
13
14
C
B
D
D
A
B
B
B
D
D
D
C
C
B
2023-2024学年清华附中朝阳学校高三2月开学考化学试题及答案: 这是一份2023-2024学年清华附中朝阳学校高三2月开学考化学试题及答案,共11页。
北京市清华大学附属中学2023-2024学年高三上学期12月统练(六)化学试题含答案: 这是一份北京市清华大学附属中学2023-2024学年高三上学期12月统练(六)化学试题含答案,共15页。试卷主要包含了12,5 Fe 56,下列化学用语或图示不正确的是,1 ml氨基中含有NA个质子等内容,欢迎下载使用。
北京市清华大学附属中学2023-2024学年高三上学期开学考试化学试题: 这是一份北京市清华大学附属中学2023-2024学年高三上学期开学考试化学试题,共9页。













