
河南省商丘市柘城县德盛高级中学2023-2024学年高二上学期9月月考化学试题
展开
这是一份河南省商丘市柘城县德盛高级中学2023-2024学年高二上学期9月月考化学试题,共11页。试卷主要包含了5 Fe 56,下列说法正确的是,有关反应热效应的说法正确的是,2NA,3KJ·ml-1,,6kJ/ml等内容,欢迎下载使用。
柘城县德盛高级中学23-24学年高二年级9月月考
化学试题 2023.09.27
(满分100分,时间90分钟)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Fe 56
第I卷(选择题)
一、单选题(每题3分,共42分)
1.化学与生活、科技、社会发展息息相关。下列有关说法正确的是( )
A.节日燃放烟花过程中的焰色试验是化学反应
B.铁磁流体液态机器人中驱动机器人运动的磁铁的主要成分是
C.“天问一号”火星车使用热控保温材料——纳米气凝胶,可产生丁达尔效应
D.“天和”核心舱电推进系统中使用的氮化硼陶瓷基复合材料属于新型有机高分子材料
2.下列说法正确的是( )
A.化学变化中的能量变化都是化学能与热能间的相互转化
B.所有的化学反应都伴有能量的变化
C.伴有能量变化的一定是化学反应
D.加热条件下发生的反应均为吸热反应
3.在相同条件下,体积相等的两份H2与足量的O2充分反应,分别生成液态水(反应①)和水蒸气(反应②)。下列说法正确的是( )
A.反应①放出的的热量多 B.反应②放出的热量多
C.反应①和反应②放出的热量一样多 D.无法比较反应①、反应②放出的热量
4.有关反应热效应的说法正确的是( )
A.氧化还原反应都属于放热反应 B.大多数分解反应都是吸热反应
C.有催化剂参与的反应是放热反应 D.有化学键断裂的反应是吸热
5.设NA为阿伏伽德罗常数的值,下列说法不正确的是( )
A.32 g S8(分子结构:)中的共价键数目为NA
B.2 g由H218O和2H2O组成的物质中含有的质子数为NA
C.8 g CuO与足量H2充分反应生成Cu,该反应转移的电子数为0.2NA
D.标准状况下,11.2 L Cl2溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA
6.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为Zn(s)+2MnO2(s)+2H2O(l)=Zn(OH)2(s)+2MnOOH(s),下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为2MnO2(s)+2H2O(l)+2e-=2MnOOH(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
7.下列依据热化学方程式得出的结论正确的是( )
A.已知,则氢气的燃烧热为
B.已知C(石墨,s)(金刚石,s) ,则石墨比金刚石更稳定
C.、下,将和置于密闭容器中充分反应生成,放热,则其热化学方程式为
D.中和热的测定实验中,氢氧化钠分批加入反应更充分,测定的中和热数值误差更小
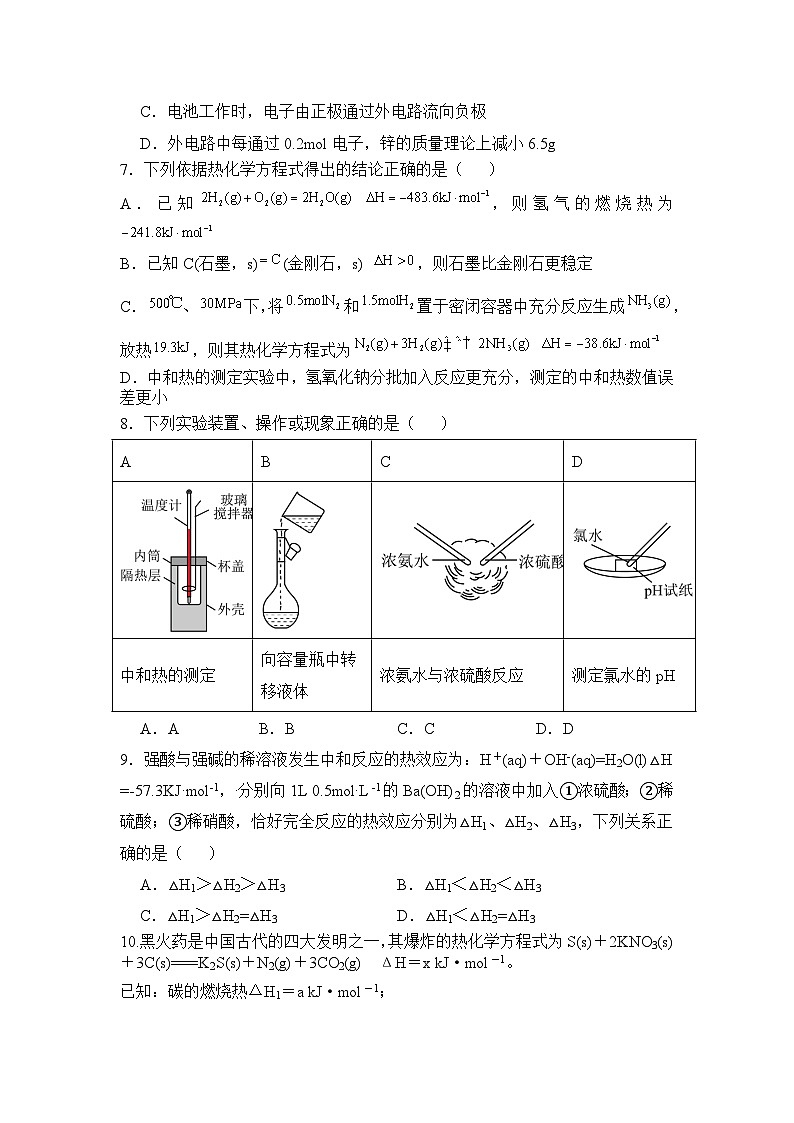
8.下列实验装置、操作或现象正确的是( )
A
B
C
D
中和热的测定
向容量瓶中转移液体
浓氨水与浓硫酸反应
测定氯水的pH
A.A B.B C.C D.D
9.强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)=H2O(l)△H =-57.3KJ·mol-1,.分别向1L 0.5mol·L-1的Ba(OH)2的溶液中加入①浓硫酸;②稀硫酸;③稀硝酸,恰好完全反应的热效应分别为△H1、△H2、△H3,下列关系正确的是( )
A.△H1>△H2>△H3 B.△H1<△H2<△H3
C.△H1>△H2=△H3 D.△H1<△H2=△H3
10.黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为S(s)+2KNO3(s)+3C(s)===K2S(s)+N2(g)+3CO2(g) ΔH=x kJ·mol-1。
已知:碳的燃烧热ΔH1=a kJ·mol-1;
S(s)+2K(s)===K2S(s) ΔH2=b kJ·mol-1;
2K(s)+N2(g)+3O2(g)===2KNO3(s) ΔH3=c kJ·mol-1,则x为( )
A.3a+b-c B.c-3a-b C.a+b-c D.c-a-b
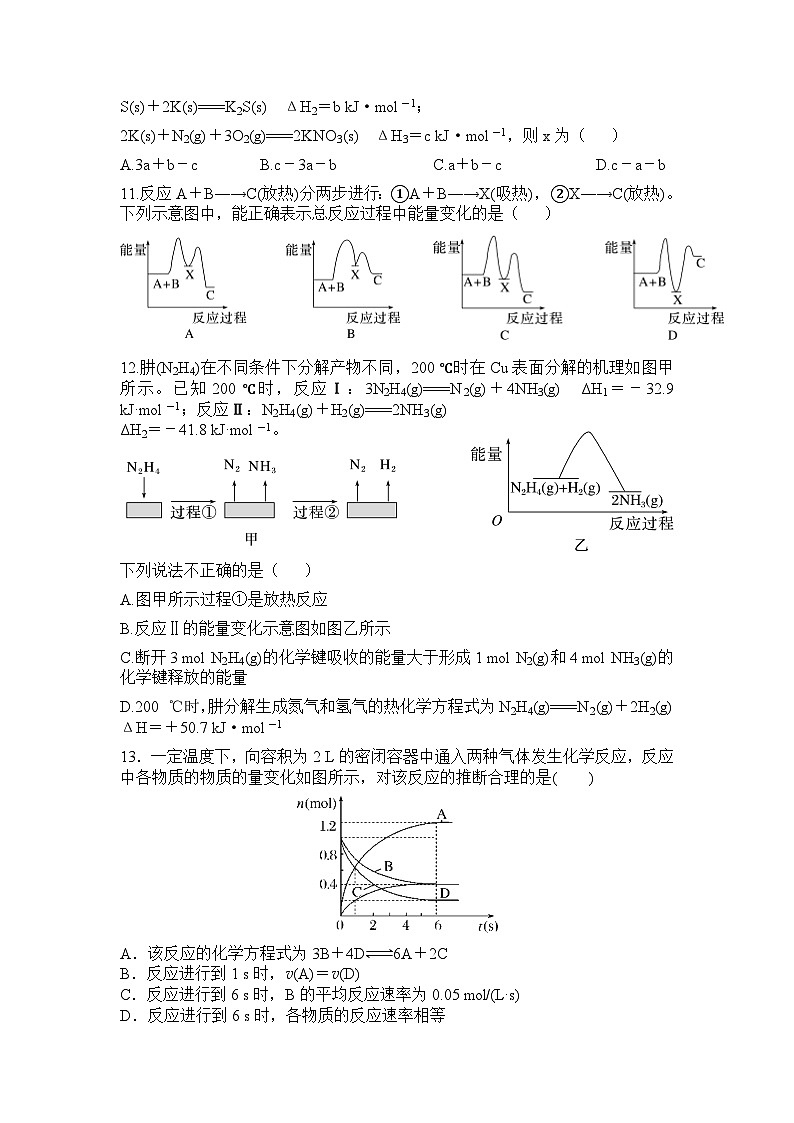
11.反应A+B―→C(放热)分两步进行:①A+B―→X(吸热),②X―→C(放热)。下列示意图中,能正确表示总反应过程中能量变化的是( )
12.肼(N2H4)在不同条件下分解产物不同,200 ℃时在Cu表面分解的机理如图甲所示。已知200 ℃时,反应Ⅰ:3N2H4(g)===N2(g)+4NH3(g) ΔH1=-32.9 kJ·mol-1;反应Ⅱ:N2H4(g)+H2(g)===2NH3(g) ΔH2=-41.8 kJ·mol-1。
下列说法不正确的是( )
A.图甲所示过程①是放热反应
B.反应Ⅱ的能量变化示意图如图乙所示
C.断开3 mol N2H4(g)的化学键吸收的能量大于形成1 mol N2(g)和4 mol NH3(g)的化学键释放的能量
D.200 ℃时,肼分解生成氮气和氢气的热化学方程式为N2H4(g)===N2(g)+2H2(g) ΔH=+50.7 kJ·mol-1
13.一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
A.该反应的化学方程式为3B+4D6A+2C
B.反应进行到1 s时,v(A)=v(D)
C.反应进行到6 s时,B的平均反应速率为0.05 mol/(L·s)
D.反应进行到6 s时,各物质的反应速率相等
14.某反应可有效降低汽车尾气污染物的排放,其反应热∆H=-620.9kJ·mol-1。一定条件下该反应经历三个基元反应阶段,反应历程如图所示(TS表示过渡态)。下列说法正确的是
A.∆E=306.6kJ/mol
B.三个基元反应中只有③是放热反应
C.该化学反应的速率主要由反应②决定
D.该过程的总反应为2CO+2NO=N2+2CO2
第II卷(非选择题,共58分)
15. (14分)50 mL 0.50 mol·L-1的盐酸与50 mL 0.55 mol·L-1的NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应的反应热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是__________。
(2)隔热层的作用是___________________________。
(3)倒入NaOH溶液的正确操作是__ __(填字母)。
a.沿玻璃棒缓慢倒入 b.分三次少量倒入 c.一次迅速倒入
(4)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成的溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和反应反应热,某学生的实验记录数据如下:
实验序号
反应物的温度/℃
反应前体系的温度t1/℃
反应后体系的温度t2/℃
反应后与反应前的温度差t2-t1 /℃
盐酸
氢氧化钠溶液
1
20.0
20.1
20.05
23.2
3.15
2
20.2
20.4
20.3
23.4
3.1
3
20.3
20.3
20.3
24.2
3.9
4
20.5
20.6
20.55
23.6
3.05
计算得反应的中和热ΔH= 。(列式计算)
(5)问题讨论
①某同学通过多次规范操作,实验测得的中和热数值总是略小于57.3kJ·mol-1,其原因可能是 。
②用 0.55 mol·L-1而不是0.50 mol·L-1的NaOH溶液的目的是 。
③某同学利用上述装置重新做实验,测得反应热ΔH偏大,则可能的原因是_____(填字母)。
A.测完盐酸的温度直接测NaOH溶液温度 B.做该实验时室温较高
C.杯盖未盖严 D.NaOH溶液一次性迅速倒入
16.(8分)二氧化碳是一种常见的气体,它不仅是绿色植物光合作用不可缺少的原料,而且在生产、生活中都有重要的用途。近年来,由于人类活动(如化石燃料燃烧)影响,二氧化碳含量逐渐增长,出现温室效应、全球气候变暖、冰川融化等恶劣现象,对二氧化碳的回收利用显得尤为重要。
Ⅰ.(1)已知工业上采用高温煅烧石灰石的方法来制备CO2,其反应的化学方程式为______________________;该反应是_____(填“吸热”或“放热”)反应。
Ⅱ.已知CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)===CH2=CH2(g)+4H2O(g) ΔH
(2) 几种物质的能量如表所示(在25 ℃、101 kPa条件下,规定单质的能量为0,测得其他物质生成时的反应热为其具有的能量):
物质
CO2(g)
H2(g)
CH2=CH2(g)
H2O(g)
能量/kJ·mol-1
-394
0
52
-242
则该反应的ΔH=______ kJ·mol-1。
(3)几种化学键的键能如表所示:
化学键
C=O
H—H
C=C
C—H
H—O
能量/ (kJ·mol-1)
803
436
615
a
463
则a= 。
17.(14分)根据题目给出的条件写出相应的热化学方程式。
(1)P4(s,白磷)+5O2(g)===P4O10(s) ΔH1= —akJ·mol-1
写出P(s,红磷)转化为P4(s,白磷)的热化学方程式: 。
(2)25 ℃、101 kPa时,0.5 mol CH4完全燃烧生成CO2气体和液态H2O时,放出445.15 kJ的热量。写出表示甲烷燃烧热的热化学方程式: 。
(3) H2(g)+Cl2(g)===2HCl(g) ΔH=-184.6 kJ·mol-1,写出HCl(g)分解生成H2(g)和Cl2(g)的热化学方程式: 。
(4)1 mol N2和3 mol H2在一定条件下发生反应生成氨气,NH3的产率为25%,放出的热量为akJ,写出合成氨的热化学方式: 。
(5)25 ℃、101 kPa时,含1molH2SO4 的稀溶液与2molNaOH的稀溶液反应生成2molH2O(l)放出114.6kJ的热量,用离子方程式表示中和热的热化学方程式为
。
(6)如表所示是1 mol有关物质中的化学键断裂时吸收的能量:
H2(g)
I2(g)
HI(g)
436.0 kJ
151.0 kJ
299.0 kJ
写出H2(g)和I2(g)反应生成HI(g)的热化学方程式: 。
(7).汽车排气管内的催化转化器可实现尾气无毒处理。
已知:N2(g)+O2(g)===2NO(g) ΔH=+180.5 kJ·mol-1
2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ·mol-1
CO2(g)===C(s)+O2(g) ΔH=+393.5 kJ·mol-1
则NO(g)与CO(g)反应两种无毒气体的热化学方程式为 。
18(12分).城市使用的燃料,现大多用煤气、液化石油气。煤气的主要成分是一氧化碳和氢气的混合气体,它由煤炭与水(蒸气)反应制得,故又称水煤气。
I.将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一,煤转化为水煤气的主要化学反应为:C+H2O(g)CO+H2。C、CO和H2燃烧热化学方程式分别为:
①C(s)+O2(g)=CO2(g) △H=-393.5kJ•mol-1
②H2(g)+O2(g)=H2O(g) △H=-242.0kJ•mol-1
③CO(g)+O2(g)=CO2(g) △H=-283.0kJ•mol-1
(1)请根据以上数据,写出碳与水蒸气反应的热化学方程式: 。
(2)比较反应热数据可知,1molCO(g)和1molH2(g)完全燃烧放出的热量之和,比1molC(s)完全燃烧放出的热量(填“多”或“少”) 。
(3)甲可学据此认为:“煤炭燃烧时加少量水,可以使煤炭燃烧放出更多的热量”。
乙同学根据盖斯定律作出了下列循环图:
请你写出△H1、△H2、△H3、△H4之间存在的关系式 。
(4)液化石油气的主要成分是丙烷,丙烷的燃烧热△H=-2220.0kJ•mol-1,则相同物质的量的C3H8和CO燃烧产生的热量比值约为 。
Ⅱ.肼(N2H4)又称联氨,在航空航天方面应用广泛,可用作火箭燃料。已知N-H键、O=O键键能分别为391kJ•mol-1、497kJ•mol-1,N2H4(g)与O2(g)反应的能量变化如图所示:
(5) N2H4(g)中N-N键的键能为 。一定条件下,N2H4(g)与O2(g)反应的热化学方程式为: 。
19.(10分)CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式分别为:
①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1;
②2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1;
③C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1。
(1)在深海中存在一种甲烷细菌,它们依靠甲烷与O2在酶的催化作用下产生的能量存活,在甲烷细菌使1 mol甲烷生成CO2气体与液态水的过程中,放出的能量______(填“>”“
相关试卷
这是一份2023-2024学年河南省商丘市柘城县德盛高级中学高一上学期11月月考化学试题,共12页。试卷主要包含了下列说法中不正确的是, 下列有关实验操作正确的是, 下列离子方程式中,正确的是等内容,欢迎下载使用。
这是一份河南省商丘市柘城县德盛高级中学2023-2024学年高二上学期11月月考化学试卷含答案,共12页。试卷主要包含了5 Fe 56,在0,常温下,下列说法错误的是,已知等内容,欢迎下载使用。
这是一份河南省商丘市柘城县德盛高级中学2023-2024学年高一上学期11月月考化学试题,共11页。试卷主要包含了下列说法中不正确的是, 下列有关实验操作正确的是, 下列离子方程式中,正确的是等内容,欢迎下载使用。









