






中考化学二轮复习专项突破(课件)专项一 情境题(含答案)
展开
这是一份中考化学二轮复习专项突破(课件)专项一 情境题(含答案),共53页。PPT课件主要包含了C6H6,化学性质,CO2+H2,CO+H2O,减少温,CuSO4,NaHCO3,Fe2O3+3CO,Fe+3CO2,SiO2等内容,欢迎下载使用。
试题通常以生产生活实践、新闻媒体报道、科技成果介绍、历史事件记载和社会热点问题为背景,以文字、表格、实验仪器或装置、标签、图象等形式提供信息,考查物质的组成、分类,原子的构成,元素化合价,有关化学式的意义,物质的性质或变化的推断,化学实验或某种规律的探究等。
类型一 科技材料类1.试卷中素材的选取和新科技密切联系,凸显化学学科的价值,传递正能量,激发学习兴趣。
2.对初中化学基础知识能正确复述、再现、辨认,并能融会贯通;通过对科技的描述以及实验现象、实物、模型的观察,对图形、图表的阅读,获取有关的感性认识和印象,并进行初步加工、吸收及有序存储;从提供的新信息中,准确地提取实质性内容,并与已有知识整合,解决简单的化学问题。
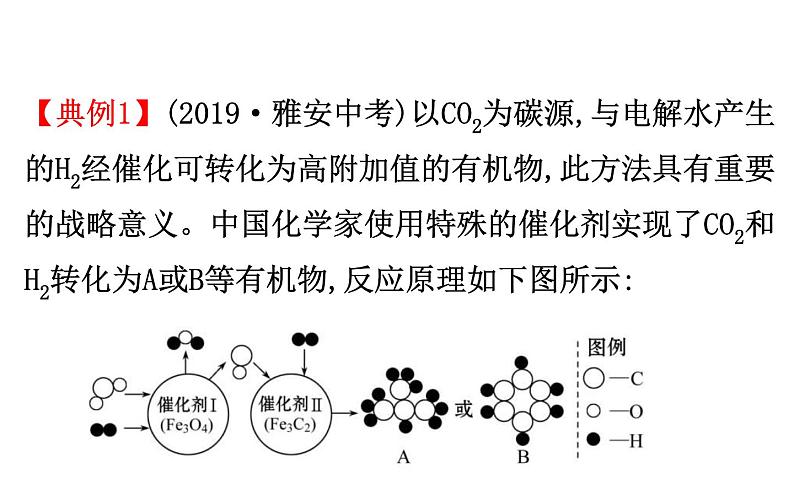
【典例1】(2019·雅安中考)以CO2为碳源,与电解水产生的H2经催化可转化为高附加值的有机物,此方法具有重要的战略意义。中国化学家使用特殊的催化剂实现了CO2和H2转化为A或B等有机物,反应原理如下图所示:
请回答下列问题:(1)B的化学式是________。 (2)根据催化剂的特性可知,催化剂在该反应前后,其质量和_____________不变。
(3)在催化剂Ⅰ中发生反应的化学方程式是________________________。 (4)由CO2 和H2反应生成A的总反应化学方程式是___________________________。 (5)如果该反应工业化生产后的重要意义是_____________________________________。
4CO2+13H2 C4H10+8H2O
室气体,减少化石能源使用等
【针对训练】1.(2018·嘉兴中考)二氧化碳气体既是温室效应的元凶,又是一种潜在的碳资源。实验室里,科学家已成功利用二氧化碳与环氧丙烷(一种简单有机物)在催化剂的作用下合成“二氧化碳塑料”。该新型塑料在投入工业生产前,以下不是科学家重点考虑的问题是 ( )世纪金榜导学号
A.如何提高催化剂的催化效率B.新型塑料是否可降解C.新型塑料的化学性质是否稳定D.新型塑料生产是否影响碳循环
2.(2019·青岛中考)高纯度的单晶硅是制作电子集成电路的基础材料。工业上制备高纯硅的化学反应原理为①SiO2+2C Si+2CO②Si+3HCl HSiCl3+H2③HSiCl3+H2 Si+3X
反应①制得粗硅,通过反应②③进一步得到高纯硅;三氯硅烷(HSiCl3)的沸点是 31.8 ℃。下列有关说法不正确的是世纪金榜导学号( )A.反应③中X 的化学式为HClB.三氯硅烷由氢、硅、氯三种元素组成C.三氯硅烷中硅、氯元素的质量比为1∶3D.反应②③实现了硅元素的富集,将粗硅转化为高纯硅
类型二 生产、生活类1.生产实际分析试题以生产具体的物质为命题背景,将生产原理或实际流程及设备名称以生产流程图的形式进行呈现,帮助学生搭建从理论走向对工业生产实际问题的认知平台。真实问题的复杂性带来了化学试题的综合性,这就要求考生首先捕捉相关化学信息或设备中的物质及变化,弄清流程中的每个设备的作用及关系,才能整体把握试题。
2.生活现象解释题的特点是简单应用所学的化学概念及常见物质性质解释自然和生活现象,说明其中的化学原理,形成科学认识。这类题也体现了小、宽、浅、活的特色。
【典例2】(2019·东营中考 )化学与社会生活(1)从铁、生石灰、烧碱、小苏打、硫酸铜中选择符合题意的物质(用化学式填空)。常用来配制波尔多液的盐是_________,焙制糕点所用的发酵粉的主要成分是__________。
(2)生活中常用二氧化碳灭火而不用氮气灭火的原因是_____________________________。 化学与传统文化(3)北宋《浸铜要略序》载“山麓有胆泉(硫酸铜溶液),土人汲以浸铁,数日辄类朽木,刮取其屑,锻炼成铜”,请用化学方程式表示其原理________________________。
二氧化碳的密度比空气的大
Fe+CuSO4====FeSO4+Cu
(4)《汉代古火井碑序》记载:“诸葛丞相躬莅视察,改进技法,刳斑竹以导气(气指天然气),引井火以煮盐”,请用化学方程式表示其原理________________________。
CH4+2O2 CO2+2H2O
【针对训练】1.(2018·山西中考)科学态度与社会责任,是化学学科素养更高层面的价值追求。在一次实践活动中,小红和同学们一起参观了某钢铁公司。大家对矿石选取、冶铁和炼钢的工艺流程(如图),生铁和钢的区别等有了全新的认识。
(1)用赤铁矿石冶铁的反应原理是_________________________(用化学方程式表示)。 (2)分析工艺流程,三脱装置中发生反应的化学方程式是___________________________________________________(写一个)。
S+O2 SO2(或4P+5O2 2P2O5或Si+O2
(3)向精炼炉中吹入氩气使钢水循环流动,各成分均匀混合,相当于化学实验中___________的作用(填一种仪器的名称)。 (4)在钢水铸件机中,高温钢加工成钢制零件时,充入氮气的作用是_________________________。
作保护气(或隔绝氧气)
2.(2018·广州中考)金属锰(Mn)及其化合物用途广泛。铁锰合金(锰钢)可用作大型体育场馆的网封架屋顶材料、铁轨、桥梁等。部分锰的化合物的颜色及溶解性见下表,回答下列问题。
(1)KMnO4读作_____________,广泛用作医药杀菌剂和防臭剂。
(2)将适当比例的铁矿石(Fe2O3)、软锰矿(MnO2)、焦炭混合加入高炉,通入热空气熔炼,可得到铁锰合金。用化学方程式表示生成金属锰的过程:①C+O2 CO2;②_________________; ③________________________。
CO2+C 2CO
2CO+MnO2 Mn+2CO2
(3)已知:①MnSO4+2NaOH====Mn(OH)2↓+Na2SO4;②2Mn(OH)2+O2====2MnO(OH)2。若向盛有MnSO4溶液的试管中加入少量NaOH溶液,静置,预测可观察到的现象是_________________________________________。
白色沉淀逐渐变为棕色
类型三 高中信息(知识前移)类 题干部分提供解题所需的信息,其来源往往是后续学习的内容。问题部分主要是围绕题干所给的新信息,从不同角度、不同侧面、不同层次进行设问。此类题一般具有“高起点、低落点”的特点,解答时运用题中所给信息,迁移所学知识,经过综合分析,最后得出结论。
解题时要注意以下几点:1.认真审题,获取有用信息。2.结合问题,寻找信息和知识的结合点。3.挖掘隐含条件,进行分析推理。4.类比迁移,从中找出正确答案。
【典例3】(2019·潍坊中考 )在“宏观-微观-符号”之间建立联系,是化学学科特有的思维方式,能帮助我们更好地认识物质变化的本质。请完成下列问题:世纪金榜导学号
(1)晋代葛洪所著《抱朴子》一书中记载有“丹砂烧之成水银”,丹砂指的是HgS。该反应的微观示意图可以表示为(如图1所示):
请写出该反应的化学方程式_____________________,微粒“ ”表示的物质属于_________(填“单质”或“化合物”)。
HgS+O2 Hg+SO2
(2)由初中学习可知:中和反应的微观实质是氢离子和氢氧根离子结合生成水分子,即H++OH-====H2O。像这种用实际参加反应的离子符号来表示化学反应的式子叫离子方程式。离子方程式的书写一般按以下步骤(以氯化镁溶液与氢氧化钾溶液反应为例):
Ⅰ.写出氯化镁溶液与氢氧化钾溶液反应的化学方程式:________________________________; Ⅱ.把易溶于水、易电离的物质写成离子形式,难溶的物质、气体和水等仍用化学式表示。上述方程式可改写成:Mg2++2Cl-+2K++2OH-====Mg(OH)2↓+2Cl-+2K+;
MgCl2+2KOH====Mg(OH)2↓+2KCl
Ⅲ.删去两边不参加反应的离子,即得离子方程式: Mg2++2OH-====Mg(OH)2↓。请回答:
①如图2是碳酸钠溶液和稀盐酸反应的微观示意图,请写出该反应的离子方程式:__________________________; ②写出一个与Fe+Cu2+====Fe2++Cu相对应的化学方程式 ______________________。
2H++ C ====H2O+CO2↑
Fe+CuSO4====FeSO4+Cu
③下列各组离子,在pH=3的无色水溶液中能大量共存的是______(填序号)。 A.K+、Fe2+、Cl-、S B.Na+、Ca2+、N 、OH-C.Na+、Ca2+、Cl-、C D.N 、Ba2+、Cl-、N
【针对训练】1.(2018·岳阳中考)小金做了如下实验:将4.2克铁粉和4.0克氧化铜粉末均匀混合,然后一次性投入盛有200克9.8%稀硫酸的大烧杯中。观察到如下现象:立即出现红色固体,前阶段没有明显的气泡产生,后阶段产生大量无色气泡,充分反应后上层清液是浅绿色。由此小金做出下列判断,其中不合理的是( )
A.“立即出现红色固体”是由于很快发生了如下转化:CuO CuSO4 CuB.“产生大量无色气泡”是由于发生了如下反应:Fe +H2SO4====FeSO4+H2↑C.该实验条件下,硫酸铜比稀硫酸更容易跟铁粉发生反应D.在不同浓度的硫酸铜和稀硫酸的混合溶液中投入铁粉,都是硫酸铜先跟铁粉反应
2.(2018·泰安中考)宏观和微观相联系是化学独特的思维方式。世纪金榜导学号
(1)微观探析化学反应的规律是化学科学的核心任务。根据下列微观示意图回答问题:①从微粒的角度说明图A反应的实质是__________________________________________________________; ②图B所示反应中,参加反应的微粒是___________ (写出微粒的符号)。
生成H2O(或氢离子和氢氧根离子结合生成水分子)
(2)化学上有一种能将微观粒子数目与宏观物质质量联系起来的量,叫物质的量,其单位是摩尔。1摩尔任何物质中含有构成它的微粒个数都是6.02×1023,1摩尔任何物质的质量都是以克为单位,数值上都等于该物质的化学式量。例如1摩尔水的各种量关系如下:
①1摩尔水中氢原子数目是__________________________________个; ②1摩尔水中氧元素质量为_______g。
1.204 ×1024(或2×
6.02 ×1023)
类型四 其他类 新情境题一直是中考化学试题中的重要题型,试题构思巧妙,题材鲜活,命题角度新颖,思维富于灵活性和创造性,能较好地考查学生对信息的提取、加工、处理及解决问题的能力。随着课改的深入实施,这种突显时代与生活气息的试题,已成为中考命题的一个热点,在未来的中考中,该类试题将会有增无减,所占分值,将逐年递增。
【典例4】(2019·广州中考)2019 年是国际元素周期表年。俄国化学家门捷列夫在公布元素周期表时,就预言了当时还未发现的相对原子质量约为68的元素的存在,且性质与铝相似,称为“类铝”。如图是元素周期表中“类铝”元素镓的相关信息,请回答下列问题:
(1)镓原子核外电子数为_______。 (2)金属镓与稀硫酸反应,产物中Ga的化合价为+3,反应的化学方程式是______________________________。
2Ga+3H2SO4====Ga2(SO4)3+3H2↑
(3)高纯氧化镓广泛用于生产半导体材料,其一种制备方法如下:步骤Ⅰ:向含有硫酸的硫酸镓溶液中通入氨气(NH3),冷却,生成Ga(NH4)(SO4)2固体。步骤Ⅱ:在一定条件下灼烧Ga(NH4)(SO4)2固体,制得高纯氧化镓。
①Ga(NH4)(SO4)2中含有的带电的原子团(根)是_______________(填化学符号)。 ②步骤Ⅰ反应的化学方程式是___________________________________________。
N 、S
Ga2(SO4)3+2NH3+H2SO4
====2Ga(NH4)(SO4)2↓
【针对训练】1.(2018·赤峰中考)稀土元素是指元素周期表中ⅢB族的钪(Sc)、钇(Y)以及镧系元素。这些元素的氧化物都不溶于水,外形像泥土,而且又稀少,因而人们喜欢称它们为”稀土元素”。稀土元素的化学性质较为活泼,若与其他元素结合,便可组成种类繁多、功能多样、用途
广泛的新型材料,且性能会有较大提高,被称作当代的“工业味精”。稀土元素的镧(La)、铈(Ce)、镨(Pr)、钕(Nd)在元素周期表中的位置如图所示。
稀土元素的化合物还是生产特种玻璃和陶瓷的重要原料。如将三氧化二铈(Ce2O3)加入玻璃中,可制成低散射、高折射的光学玻璃,用于生产精密的光学器材。根据上述内容,回答下列问题:
(1)从材料中可得出,稀土元素的化学性质_________。 (2)铈元素的质子数是_______。 (3)三氧化二铈(Ce2O3)中铈元素的化合价是___价。 (4)三氧化二铈(Ce2O3)的用途是___________________________________________________________________。
射、高折射的光学玻璃,用于生产精密的光学器材
2.H2O2可作增氧剂。常温下,用4%的H2O2溶液进行实验,研究pH对H2O2分解所得溶液中溶氧量的影响,测定结果如图。
相关课件
这是一份中考化学二轮复习专项突破(课件)专项五 常见气体的制备与净化(含答案),共46页。PPT课件主要包含了气体制备方案流程,气体的干燥,长颈漏斗,从长颈漏,难溶于水,玻璃棒,+H2O,酒精灯,燃则氧气已满,集气瓶等内容,欢迎下载使用。
这是一份中考化学二轮复习专项突破(课件)专项四 物质的推断(含答案),共60页。PPT课件主要包含了3常见物质的用途,6特征现象①,7特征反应条件,钠的化合物的三角关系,三酸间的转化关系,复分解反应,CuO,置换反应,Na2CO3,不一定等内容,欢迎下载使用。
这是一份中考化学二轮复习专项突破(课件)专项三 物质的鉴别与除杂(含答案),共55页。PPT课件主要包含了②常见气体的检验方法,③常见离子的检验方法,b化肥的检验,除杂原则,2化学方法,相关物质的除杂等内容,欢迎下载使用。








