

化学必修第二册乙酸课后复习题
展开7.3乙醇和乙酸同步练习-沪科版高中化学必修第二册
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列说法正确的是
A.丙烯(CH3—CH=CH2)中的所有原子都在同一平面内
B.相同质量的C2H4和CH3CH2OH完全燃烧时耗氧量相等
C.1 mol乙醇能与足量Na反应生成1 mol H2
D.食醋可清除水壶中的少量水垢,说明乙酸(CH3COOH)的酸性强于碳酸
2.下列实验操作以及对应的结论均正确的是
| 实验 | 结论 |
A | 向某无色溶液中滴加稀NaOH溶液,未观察到明显现象 | 原溶液中一定不存在 |
B | 淀粉加入稀硫酸催化水解后,再加入新制氢氧化铜悬浊液并加热,没有出现砖红色沉淀 | 淀粉未水解 |
C | 铜丝在酒精灯上灼烧后插入乙醇,可以看到铜丝由红色变为黑色,又变为红色 | 铜丝参与反应,是该反应的催化剂 |
D | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有 |
A.A B.B C.C D.D
3.番木鳖酸具有一定的抗炎、抗菌活性,结构简式如图。下列说法错误的是
A.lmol该物质最多可与2molH2发生加成反应
B.该物质可被酸性KMnO4溶液氧化
C.1mol该物质与足量饱和NaHCO3溶液反应,可放出22.4L(标准状况)CO2
D.一定量的该物质分别与足量Na、NaOH反应,消耗二者物质的量之比为6:1
4.客家黄酒是广东名酒,有活气养血、活络通经之功效,黄酒中含有丰富的维生素、氨基酸等营养成分。下列有关说法中错误的是
A.黄酒微酸是因为黄酒中的乙醇电离出了氢离子
B.酒越陈越香与生成的酯类物质有关
C.粮食酿黄酒涉及反应
D.氨基酸中均含有氮元素
5.将等质量的四块铜片在酒精灯上加热后分别插入下列物质中,放置片刻后铜片质量与加热前相同的是
A.醋酸溶液 B.稀硝酸 C.石灰水 D.乙醇
6.有关和的不正确说法是
A.都能与金属钠反应产生氢气,反应时都会断H-O键
B.都可以发生酯化反应生成酯
C.前者是非电解质,后者是电解质
D.都可使酸性高锰酸钾溶液褪色
7.山梨酸的结构如图所示,下列有关山梨酸的叙述不正确的是
A.分子式为
B.分子中所有的原子共平面
C.一定条件下能发生取代反应、加成反应和氧化反应
D.1mol山梨酸分别与足量的Na、溶液反应,相同状况下产生气体的体积不同
8.下列关于元素及其化合物的性质说法不正确的是
A.和乙醇反应可生成 B.工业上煅烧黄铁矿生产
C.工业上用氨的催化氧化制备 D.常温下铁与浓硝酸反应可制备
9.在乙醇和乙酸的反应中,浓硫酸是
①催化剂 ②氧化剂 ③吸水剂 ④反应物
A.①② B.②③ C.①③ D.②④
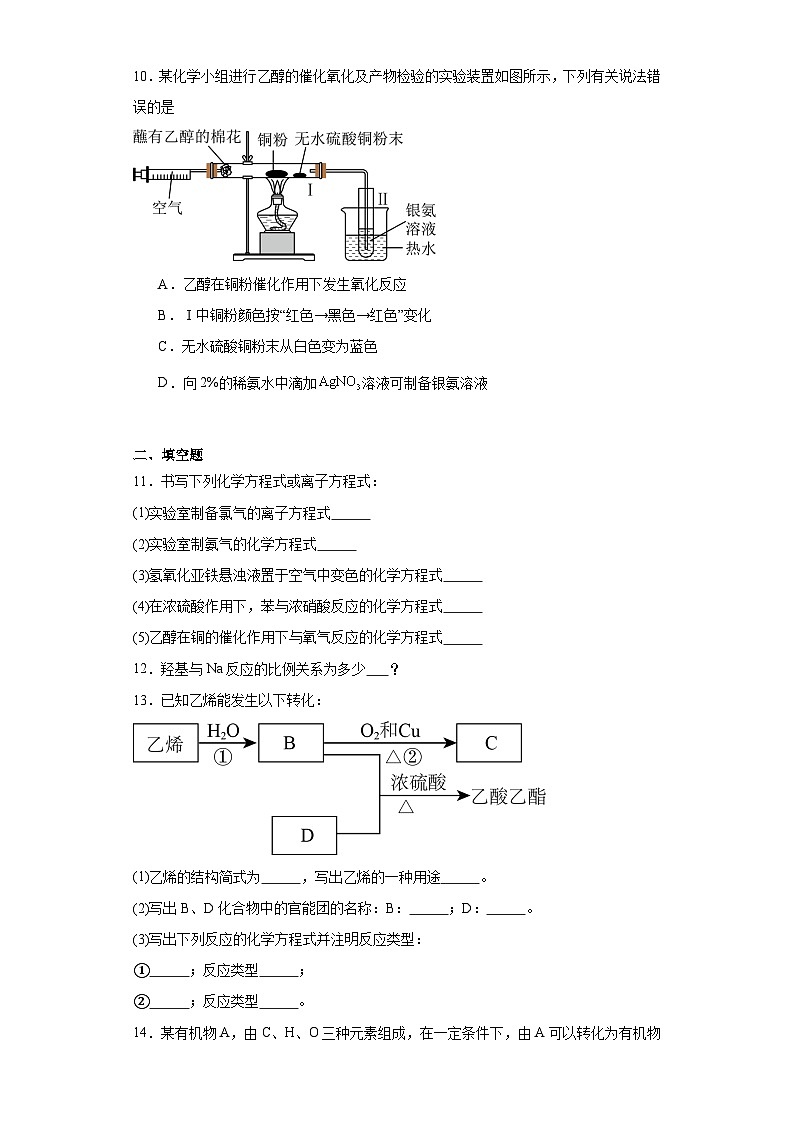
10.某化学小组进行乙醇的催化氧化及产物检验的实验装置如图所示,下列有关说法错误的是
A.乙醇在铜粉催化作用下发生氧化反应
B.Ⅰ中铜粉颜色按“红色→黑色→红色”变化
C.无水硫酸铜粉末从白色变为蓝色
D.向2%的稀氨水中滴加溶液可制备银氨溶液
二、填空题
11.书写下列化学方程式或离子方程式:
(1)实验室制备氯气的离子方程式
(2)实验室制氨气的化学方程式
(3)氢氧化亚铁悬浊液置于空气中变色的化学方程式
(4)在浓硫酸作用下,苯与浓硝酸反应的化学方程式
(5)乙醇在铜的催化作用下与氧气反应的化学方程式
12.羟基与Na反应的比例关系为多少 ?
13.已知乙烯能发生以下转化:
(1)乙烯的结构简式为 ,写出乙烯的一种用途 。
(2)写出B、D化合物中的官能团的名称:B: ;D: 。
(3)写出下列反应的化学方程式并注明反应类型:
① ;反应类型 ;
② ;反应类型 。
14.某有机物A,由C、H、O三种元素组成,在一定条件下,由A可以转化为有机物B、C和D、E;C又可以转化为B、A。它们的转化关系如下:
已知D的蒸气密度是氢气的22倍,并可以发生银镜反应。
(1)写出A、B、C、D、E、F的结构简式和名称;
A
B
C
D
E
F
(2)写出实现①、⑥转化的化学方程式,并注明反应类型。
①
⑥
15.“宏观—微观—符号”三重表征是化学独特的表示物质及其变化的方法。请按照要求用正确的化学用语回答下列问题:
(1)H2O的电子式 HCN的电子式
(2)Fe与NaHSO4溶液反应的离子方程式
(3)Al与NaOH溶液反应的化学方程式
(4)乙醇催化氧化反应的方程式
(5)乙醇和乙酸的酯化反应方程式
16.乙醇在能源、生产及日常生活等许多方面都有十分广泛的应用。请回答关于乙醇的若干问题:
(1)用物理、化学方法各一种鉴别乙醇和汽油
方法① ;
方法② 。
(2)用乙醇为主要原料(无机试剂任选),根据要求,分别写出相应的化学方程式(注明反应条件)。
①氧化反应 ;
②消去反应 ;
③置换反应 。
(3)在焊接铜漆包线的线头时,常先把线头放在火上烧一下,以除去漆层,并立即在酒精中蘸一下,再焊接。为什么要用酒精处理后再焊接? 。发生反应的化学方程式为 。
17.乙酸的结构
分子式 ;结构式 ;结构简式 ;官能团 。
18.共价键与有机反应的关系
(1)π键与有机反应
键的轨道重叠程度比 键的 ,比较容易 ,π键更 ,有机物中若含有π键,能发生 。
(2)共价键的极性与有机反应
由于不同的成键原子间 的差异,共用电子对会发生偏移。偏移的程度 ,共价键极性 ,越容易 。因此有机化合物的 及其 往往是发生化学反应的活性部位。
实例分析
①乙醇、水分别与钠反应的比较
实验操作 | ||
实验现象 | 金属钠 ,反应 | 金属钠 ,反应平稳 |
化学方程式 | 2Na+2H2O=2NaOH+H2↑ | →+H2↑ |
实验结论 | CH3CH2—OH中氢氧键的极性比H—OH中氢氧键的极性 , 之间的相互影响使官能团中化学键的极性发生变化,从而影响官能团和物质的性质 | |
②乙醇与氢溴酸的反应
由于羟基中氧原子的电负性较大,乙醇分子中的碳氧键极性也较强,也可断裂,如乙醇与氢溴酸的反应:
+H—Br+H2O。
19.回答下列问题:
(1)①重晶石的化学式 ;②乙酸的结构简式 。
(2)实验室制氨气的化学反应方程式 。
(3)乙烯和氢气的化学反应方程式 。
20.分别写出下列物质的分子式、结构式和结构简式:
物质名称 | 乙烷 | 丙烷 | 乙醇 |
分子式 |
|
|
|
结构式 |
|
|
|
结构简式 |
|
|
|
三、实验题
21.红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯。在实验室也可以用如下图所示的装置制取乙酸乙酯,请回答下列问题。
(1)乙醇分子中官能团的名称是 。
(2)试管a中加入几块碎瓷片的目的是 。
(3)试管a中发生反应的化学方程式为 。
(4)浓硫酸的作用 。
(5)试剂b作用为 。
22.“酒是陈的香”就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室也可以用如图所示的装置制取乙酸乙酯。回答下列问题:
(1)写出制取乙酸乙酯的化学方程式: 。
(2)饱和碳酸钠溶液的主要作用有 。
(3)装置中通蒸气的导管要在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是 。
(4)若要把制得的乙酸乙酯分离出来,应采用的分离方法是 。
(5)做此实验时,在加热前需向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的 。
(6)浓硫酸的作用为: 。
23.乙酸乙酯是一种用途广泛的精细化工产品,被广泛用于醋酸纤维、乙烯树脂、合成橡胶、涂料及油漆等的生产过程中。
Ⅰ.乙酸乙酯的制备。
(1)球形干燥管有冷凝的作用外,还能起到的作用为 。
(2)按图连接好装置,依次在试管①中装入乙醇、浓硫酸、乙酸、碎瓷片,②中盛装的试剂是 。
Ⅱ.乙酸乙酯的反应机理探究。
用乙醇羟基氧示踪:___________+___________。
用醋酸羟基氧示踪:+H3C-CH2-OH+H218O。
(3)模仿醋酸羟基氧示踪法,写出乙醇羟基氧示踪法的产物为 和 。
(4)已知醋酸羟基氧示踪法中,产物含氧18水占到总水量的一半,酯也一样。该实验说明酯化反应 (填“是”或“不是”)简单的取代反应。
(5)在投料1:1的情况下,测得120℃时,平衡转化率为65%,该温度下反应的平衡常数K= 。(保留三位有效数字)
Ⅲ.乙酸乙酯的催化水解(酯化反应的逆反应)探究。
已知:①乙酸乙酯的沸点约77℃;
②酸和碱均可用作酯水解的催化剂。
实验步骤:向试管中加入溶液,再加入2mL乙酸乙酯,量出乙酸乙酯的高度。再把试管放入70℃的水浴中,每隔1min将其取出,振荡,静置,立即测量并记录剩余酯层的高度,再迅速放回水浴中继续加热,如此反复进行。改变NaOH溶液的浓度,重复实验。乙酸乙酯水解后剩余高度/mm数据如下:
组别 | 时间/min | |||||||||
0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
1 | 0.5 | 10.0 | 9.0 | 8.0 | 7.5 | 7.0 | 6.5 | 6.5 | 6.5 | 6.5 |
2 | 1.0 | 10.0 | 8.5 | 7.0 | 6.0 | 5.0 | 4.5 | 4.5 | 4.5 | 4.5 |
3 | 2.0 | 10.0 | 8.0 | 6.0 | 4.5 | 3.0 | 2.0 | 1.5 | 1.5 | 1.5 |
回答下列问题:
(6)分析上述数据,得到乙酸乙酯水解速率的规律是:
①NaOH溶液浓度越大,水解速率越 ;
② 。
(7)结论②的理论解释是 。
(8)该实验必须严格控制NaOH溶液的体积、乙酸乙酯的用量和反应的温度。为了达到实验的目的,有同学建议用 代替NaOH溶液重复试验,对数据进行修正。
参考答案:
1.D
2.C
3.A
4.A
5.D
6.D
7.B
8.D
9.C
10.D
11.(1)
(2)
(3)
(4)
(5)
12.1:1
13.(1) CH2=CH2 催熟或制聚乙烯塑料
(2) 羟基 羧基
(3) CH2=CH2+H2OCH3CH2OH 加成反应 2CH3CH2OH+O22CH3CHO+2H2O 氧化反应
14. CH3CH2OH,乙醇 CH2=CH2,乙烯; CH3CH2Br,溴乙烷 CH3CHO,乙醛 CH3COOH,乙酸 CH3COOCH2CH3,乙酸乙酯 ,消去反应 ,氧化反应
15.(1)
(2)Fe + 2H+ = Fe2+ + H2↑
(3)2Al+2NaOH+2H2O=2NaAlO2+3H2↑
(4)
(5)
16.(1) 各取两种液体少量于试管中,加入少量水,分层者为汽油,不分层者为乙醇 各取两种液体少量于试管中,加入一小块钠,反应的为乙醇,不反应的为汽油
(2) O2+2CH3CH2OH2H2O+2CH3CHO CH3CH2OHCH2=CH2↑+H2O 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
(3) 用火烧法除去漆层后,铜表面可生成一层黑色CuO,会影响焊接质量。在酒精中蘸一下,发生反应,排除了CuO对焊接质量的影响 CuO+CH3CH2OHCu+H2O+CH3CHO
17. C2H4O2 CH3COOH 羧基 -COOH
18.(1) π σ 小 断裂 活泼 加成反应
(2) 电负性 越大 越强 断裂 官能团 邻近的化学键 浮在水面上 剧烈 沉在水底 弱 基团
19.(1) BaSO4 CH3COOH
(2)Ca(OH)2+2NH4ClCaCl2+2NH3↑+2H2O
(3)CH2=CH2+H2CH3CH3
20. C2H6 C3H8 C2H6O CH3CH3; CH3CH2CH3 CH3CH2OH
21.(1)羟基
(2)防止暴沸
(3)CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O
(4)催化剂、吸水剂
(5)吸收乙酸、溶解乙醇,降低乙酸乙酯的溶解度
22.(1)CH3COOH+C2H5OH CH3COOC2H5 +H2O
(2)吸收乙醇,中和乙酸,降低乙酸乙酯的溶解度,利于分层
(3)防止由于乙醇和乙酸的吸收而造成液体回流(倒吸)
(4)分液
(5)防止暴沸
(6)催化剂、吸水剂
23.(1)防倒吸
(2)饱和溶液
(3)
(4)不是
(5)3.45
(6) 快 乙酸乙酯水解速率先快后慢,一段时间后停止水解
(7)NaOH能与水解产物醋酸发生中和反应,随着反应的进行,NaOH浓度逐渐减小直到完全消耗,其催化作用也逐渐减弱直到没有催化作用
(8)蒸馏水
高中化学人教版 (2019)必修 第二册第七章 有机化合物第三节 乙醇与乙酸同步测试题: 这是一份高中化学人教版 (2019)必修 第二册<a href="/hx/tb_c4000048_t7/?tag_id=28" target="_blank">第七章 有机化合物第三节 乙醇与乙酸同步测试题</a>,共24页。试卷主要包含了单选题,填空题,判断题,解答题等内容,欢迎下载使用。
高中化学沪科技版(2020)必修第二册乙酸课时练习: 这是一份高中化学沪科技版(2020)必修第二册乙酸课时练习,共21页。PPT课件主要包含了糖分水果中的糖分,空间充填模型,球棍模型,弱酸性,乙醇+浓硫酸+乙酸,吸水剂,酯化反应,取代反应等内容,欢迎下载使用。
人教版 (2019)必修 第二册第三节 乙醇与乙酸课后复习题: 这是一份人教版 (2019)必修 第二册第三节 乙醇与乙酸课后复习题,共13页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。













