2024届高三新高考化学大一轮专题训练题----盐类的水解
展开2024届高三新高考化学大一轮专题训练题----盐类的水解
一、单选题
1.(2023·浙江·统考高考真题)NA为阿伏加德罗常数的值,下列说法正确的是
A.4.4gC2H4O中含有σ键数目最多为0.7NA
B.1.7gH2O2中含有氧原子数为0.2NA
C.向1L0.1mol/LCH3COOH溶液通氨气至中性,铵根离子数为0.1NA
D.标准状况下,11.2LCl2通入水中,溶液中氯离子数为0.5NA
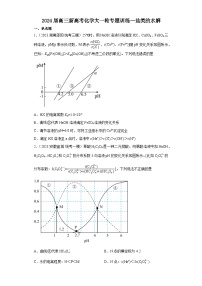
2.(2023·湖南·统考高考真题)常温下,用浓度为的标准溶液滴定浓度均为的和的混合溶液,滴定过程中溶液的随()的变化曲线如图所示。下列说法错误的是
A.约为
B.点a:
C.点b:
D.水的电离程度:
3.(2023·宁夏吴忠·统考模拟预测)由下列实验操作及现象所得结论或解释正确的是
选项
实验操作
现象
结论或解释
A
向5mL0.1mol·L-1KI溶液中加入10mL0.01mol·L-1FeCl3溶液,充分反应后滴加KSCN溶液
溶液变红
I-与Fe3+的反应是可逆反应
B
常温下,测定等浓度NaHCO3溶液和NaHSO3溶液的pH
前者大于后者
非金属性S>C
C
将某溶液滴在KI一淀粉试纸上
试纸变蓝
原溶液中一定含有Cl2
D
向蛋白质溶液中加入醋酸铅溶液
产生白色沉淀
蛋白质发生了盐析
A.A B.B C.C D.D
4.(2023秋·云南大理·高三统考期末)下列解释事实的离子方程式正确的是
A.向溶液中滴加足量的氨水:
B.硫化钠溶液水解显碱性:
C.澄清石灰水中滴加少量的碳酸氢钠:
D.等物质的量浓度的和溶液混合至中性:
5.(2022秋·江西宜春·高三上高三中校考期中)为配制NH的浓度与的浓度比为1∶1的溶液,可在溶液中加入
①适量的HCl②适量的NaCl③适量的④适量的浓氨水
A.①② B.③ C.③④ D.④
6.(2023秋·河南平顶山·高三统考期末)室温下,下列各溶液中微粒的物质的量浓度关系正确的是
A.溶液中:
B.氨水与氯化铵的混合溶液中可能存在:
C.溶液和溶液等浓度等体积混合后的溶液中(忽略体积变化,混合后):
D.溶液与溶液中都存在关系式:
7.(2023·全国·高三假期作业)常温下,向的溶液中滴入NaOH溶液,随着pH变化溶液中浓度最大的含磷微粒如图所示。下列说法正确的是
A.时,
B.时,
C.时,
D.若用的溶液进行实验,将向左移动
8.(2023·山西临汾·统考二模)25℃时,向0.1mol/LNH4HCO3溶液中通HCl(g)或加NaOH(s),溶液中含碳、含氮粒子分布分数δ[指某含氮(或碳)粒子的浓度占各含氮(或碳)粒子浓度之和的分数]随溶液的pH变化关系如图所示。下列说法错误的是
A.常温下,Kb(NH3·H2O)>Ka1(H2CO3)
B.NH4HCO3溶液中存在:c(NH3·H2O)+c()+c(OH-)=c(H+)+c(H2CO3)
C.反应+NH3·H2O++H2O的平衡常数K=10−0.9
D.pH=10.2时,溶液中存在:3c()+c(OH-)=c()+c(H+)
9.(2023春·重庆渝中·高三重庆巴蜀中学校考阶段练习)根据实验目的,下列实验及现象、结论都正确的是
选项
实验目的
实验及现象
结论
A
比较和的水解常数
分别测浓度均为的CH3COONH4和NaHCO3溶液的pH,后者大于前者
B
探究氢离子浓度对、相互转化的影响
向K2CrO4溶液中缓慢滴加硫酸,黄色变为橙红色
增大氢离子浓度,转化平衡向生成的方向移动
C
探究反应物浓度对反应速率的影响
分别向体积为20mL浓度为的稀硫酸和的浓硫酸中加入2g锌粉,比较收集相同体积的气体所需的时间
反应物浓度越大,收集相同体积的气体所需的时间越短,反应速率越快
D
检验是否变质
向溶液中加入硫酸酸化的KSCN溶液,溶液呈血红色
说明已变质
A.A B.B C.C D.D
10.(2022秋·湖南常德·高三常德市一中校考期中)2022年诺贝尔化学奖青睐“点击化学”,凸显了化学广泛应用于生活,下列叙述错误的是
A.天然气(主要成分CH4)已经成为居民的生活用气
B.泡沫灭火剂的主要成分为Na2CO3和Al2(SO4)3
C.催化作用可以为化学工业带来巨大的经济效益
D.碱性废水可通过投加酸性废水或利用烟道气中和
11.(2023秋·云南丽江·高三统考期末)下列事实不能证明CH3COOH是弱电解质的是
A.CH3COONa的水溶液pH>7
B.0.1mol/L的CH3COOH溶液的pH为2
C.CH3COOH溶液中滴加紫色石蕊试液,溶液变红
D.相同浓度的醋酸溶液导电能力比盐酸弱
12.(2023秋·浙江杭州·高三浙江省桐庐中学校联考期末)某酸性废水中含有大量的和少量,利用该废水为原料制备纳米级的流程如图:
下列说法正确的是
A.通发生的反应:
B.流程中可用替代
C.开始向滤液1中加入时,观察到有少量气泡产生,该气体为
D.该流程中使用了漏斗、玻璃棒、酒精灯、坩埚和分液漏斗等
13.(2023秋·浙江杭州·高三浙江省桐庐中学校联考期末)室温下,取某二元酸,滴加溶液。已知:,,下列说法不正确的是
A.溶液中有
B.当滴加至中性时,溶液中,用去溶液的体积大于
C.当用去溶液体积时,溶液的,此时溶液中有
D.当用去溶液体积时,此时溶液中有
二、多选题
14.(2022秋·湖南常德·高三常德市一中校考期中)25℃时,在20.0mL中滴入的盐酸,溶液的pH与所加盐酸的体积关系如图所示。
下列有关叙述错误的是
A.MOH为强碱
B.N点存在关系:
C.pH=9时,
D.混合溶液的导电能力:O点>N点
三、非选择题
15.(2021秋·山西朔州·高三怀仁市第一中学校校考期中)填空。
(1)某温度时,测得0.01mol·L-1NaOH溶液的pH=11,该温度下水的离子积Kw= 。该温度下,将pH=12的NaOH溶液VamL与pH=2的H2SO4溶液VbmL混合,混合后溶液的pH=11,则Va:Vb= 。
(2)用物质的量分别为0.1mol的HCN和NaCN配成1L混合溶液,已知其中c(CN-)小于c(Na+),则溶液中c(H+) (填“>”“<”或“=”)c(OH-),c(HCN)+c(CN-)= mol·L-1。
(3)室温下将amol·L-1的HCN与0.1mol·L-1的NaOH溶液等体积混合,反应后溶液中c(Na+)=c(CN-),则溶液显 (填“酸”“碱”或“中”)性;用含a的代数式表示HCN的电离常数Ka= 。
16.(2022秋·四川泸州·高三四川省泸县第四中学校考期中)常温下,有浓度均为0.1mol·L-1的下列6种溶液:
①NaCN溶液②NaOH溶液③CH3COONa溶液④NH3·H2O溶液⑤HCl溶液⑥FeCl3溶液
HCN
H2CO3
CH3COOH
Ka=4.9×10-10
Ka1=4×10-7 Ka2=5.6×10-11
Ka=1.7×10-5
(1)溶液③pH=10的原因是 (用离子方程式表示,下同);溶液④pH=11的原因是 。
(2)溶液①中各离子浓度由大到小的顺序是 。
(3)溶液①和③相比较,pH (NaCN) pH (CH3COONa) (填“>”“<”或“=”)。
(4)25℃时,V1L⑤HCl溶液和V2L②NaOH溶液混合后,混合溶液的pH=12,则V1:V2= 。
(5)实验室配制⑥FeCl3溶液时,通常加入少量盐酸,原因是 。
(6)25℃时,向①NaCN溶液中通入少量CO2,发生反应的离子方程式为 。
(7)常温下若③CH3COONa和④CH3COOH的混合溶液中c(Na+) =c(CH3COO-),则该溶液呈 性。(填“酸”“碱”或“中”)
17.(2022·全国·高三假期作业)I.已知:在相同条件下醋酸与氨水电离程度相同。浓度均为的下列溶液:
①硫酸②醋酸③氢氧化钠④氯化铵⑤醋酸铵⑥硫酸铵⑦硫酸氢铵⑧氨水
(1)写出醋酸溶液与氨水反应的离子方程式
(2)①、②、③、④四种溶液中由水电离出的浓度由大到小的顺序是(填序号) 。
(3)④、⑤、⑥、⑦、⑧五种溶液中浓度由大到小的顺序是(填序号) 。
II.已知时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式
电离平衡常数
(4)浓度相等的下列溶液,它们的值由大到小排列的顺序是___________(用编号填写)
A. B. C. D.
(5)根据表中平衡常数数据,写出亚硫酸与碳酸氢钠溶液反应的离子方程式
(6)时,与的混合溶液,若测得混合液,则溶液中c(CH3COO-)-c(Na+) (填准确数值)。
18.(2022春·四川雅安·高三雅安中学校考期中)草酸(H2C2O4)是一种常见二元弱酸,常用来做还原剂、沉淀剂、媒染剂、络合剂等。常温下草酸的电离平衡常数;。
(1)的溶液与的的溶液等体积混合后所得溶液呈 性(填“酸”、“碱”、“中”),该溶液中各离子浓度由大到小的顺序为 。
称取1.000 g软锰矿试样(主要含MnO2),加入1.260 g H2C2O4·2H2O配制的溶液及稀硫酸,加热至反应完全,过程中伴有无色无味气体产生。恢复至常温后用0.2000 mol/L的KMnO4标准溶液滴定过量的草酸至终点。
(2)滴定前涉及的反应的离子方程式为 ,达到滴定终点的现象: 。
(3)滴定起始和终点的液面如图所示,则消耗KMnO4标准溶液 mL。计算可知,MnO2在该软锰矿试样中的质量分数为 。
(4)下列操作可能造成测量结果偏低的是___________。
A.滴定终点读数时俯视 B.滴定前有气泡,滴定后气泡消失
C.没有润洗锥形瓶 D.滴定过程中加入少量蒸馏水冲洗瓶壁
参考答案:
1.A
【详解】A.1个C2H4O中含有6个σ键和1个π键(乙醛)或7个σ键(环氧乙烷),4.4gC2H4O的物质的量为0.1mol,则含有σ键数目最多为0.7NA,A正确;
B.1.7gH2O2的物质的量为=0.05mol,则含有氧原子数为0.1NA,B不正确;
C.向1L0.1mol/LCH3COOH溶液通氨气至中性,溶液中存在电荷守恒关系:c(CH3COO-)+c(OH-)=c(NH)+c(H+),中性溶液c(OH-)=c(H+),则c(CH3COO-)=c(NH),再根据物料守恒:n(CH3COO-)+n(CH3COOH)=0.1mol,得出铵根离子数小于0.1NA,C不正确;
D.标准状况下,11.2LCl2的物质的量为0.5mol,通入水中后只有一部分Cl2与水反应生成H+、Cl-和HClO,所以溶液中氯离子数小于0.5NA,D不正确;
故选A。
2.D
【分析】NaOH溶液和HCl、CH3COOH混酸反应时,先与强酸反应,然后再与弱酸反应,由滴定曲线可知,a点时NaOH溶液和HCl恰好完全反应生成NaCl和水,CH3COOH未发生反应,溶质成分为NaCl和CH3COOH;b点时NaOH溶液反应掉一半的CH3COOH,溶质成分为NaCl、CH3COOH和 CH3COONa;c点时NaOH溶液与CH3COOH恰好完全反应,溶质成分为NaCl、CH3COONa;d点时NaOH过量,溶质成分为NaCl、CH3COONa和NaOH,据此解答。
【详解】A.由分析可知,a点时溶质成分为NaCl和CH3COOH,c(CH3COOH)=0.0100mol/L,c(H+)=10-3.38mol/L,==10-4.76,故A正确;
B.a点溶液为等浓度的NaCl和CH3COOH混合溶液,存在物料守恒关系c(Na+)=c(Cl-)=c(CH3COOH)+c(CH3COO-),故B正确;
C.点b溶液中含有NaCl及等浓度的CH3COOH和 CH3COONa,由于pH<7,溶液显酸性,说明CH3COOH的电离程度大于CH3COO-的水解程度,则c(CH3COOH)
答案选D。
3.A
【详解】A.根据化学方程式2Fe3++2I-=2Fe2++I2中的系数关系,实验操作中所给的FeCl3是不足的,所以溶液变红说明溶液中依然有Fe3+,说明该反应是可逆反应,A正确;
B.测定等浓度NaHCO3溶液和NaHSO3溶液的pH,前者大于后者是因为的水解程度大于电离程度,溶液呈碱性,的水解程度小于电离程度,溶液呈酸性,根据越弱越水解,说明碳酸酸性<亚硫酸酸性,但亚硫酸不是S元素的最高价氧化物对应的水化物,所以不能说明非金属性S>C,B错误;
C.将某溶液滴在KI一淀粉试纸上,试纸变蓝,说明原溶液中含有氧化性物质,但不一定是氯气,C错误;
D.向蛋白质溶液中加入醋酸铅溶液,产生白色沉淀,醋酸铅溶液是重金属盐溶液,所以是蛋白质发生了变性,D错误;
故选A。
4.C
【详解】A.一水合氨为弱碱,不能写成离子,正确离子方程式为Al3++3NH3·H2O═Al(OH)3↓+3NH,故A错误;
B.硫化钠的水解的离子反应为S2﹣+H2OHS﹣+OH﹣,故B错误;
C.石灰水足量,反应生成碳酸钙沉淀,离子方程式为,故C正确;
D.等物质的量浓度的和溶液混合至中性离子方程式为:Ba2++2OH-+2H++SO=BaSO4↓+2H2O,故D错误;
故选C。
5.C
【分析】溶液中会发生水解反应,使得浓度降低,所以为配制NH的浓度与的浓度比为1∶1的溶液,应在溶液中加入使浓度增大的物质。
【详解】①加入HCl可以抑制的水解,但不能使浓度增大到和的浓度比为1∶1,故①错误;
②加入NaCl不影响水解平衡,不能增大浓度,故②错误;
③加入可以增大浓度,故③正确;
④加入浓氨水,氨水电离,可以增大浓度,故④正确;
故选C。
6.D
【详解】A.溶液中的水解程度较小,,同时,A项错误;
B.氨水与氯化铵的混合溶液中不可能存在:,因不符合电荷守恒,B项错误;
C.和溶液等浓度等体积混合后,说明的电离程度大于的水解程度,则,C项错误;
D.愘液与溶液中存在的离子种类相同,则根据电荷守恒可知,都存在关系式:,D项正确。
故选D。
7.A
【详解】A.时,,则,A正确;
B.时,,此时溶液中主要含有,溶液显酸性,其电离程度大于水解程度,故,B错误;
C.时,根据电荷守恒可知,,C错误;
D.平衡常数只受温度的影响,故不移动,D错误;
故选A。
8.D
【详解】A.常温下,根据图中曲线pH=9.3时,铵根和一水合氨物质的量浓度相等,则Kb(NH3·H2O)=10−4.7,图中曲线pH=6.4时,碳酸和碳酸氢根物质的量浓度相等,则Ka1(H2CO3)=10−6.4,因此Kb(NH3·H2O)>Ka1(H2CO3),故A正确;
B.NH4HCO3溶液中存在电荷守恒c()+c(H+) = 2c()+c(OH-) + c(),还存在物料守恒c(NH3·H2O)+ c()=c()+c()+c(H2CO3),前者减去后者得到c(NH3·H2O)+c()+c(OH-)=c(H+)+c(H2CO3),故B正确;
C.pH=10.2时,则Ka2(H2CO3)=10−10.2,反应+NH3·H2O++H2O的平衡常数,故C正确;
D.pH=10.2时,根据电荷守恒c()+c(H+) +c(Na+) = 2c()+c(OH-) + c(),c()=c(),则溶液中存在:3c()+c(OH-)=c()+c(H+)+c(Na+),故D错误。
综上所述,答案为D。
9.B
【详解】A.CH3COONH4中水解,,会消耗CH3COO−水解生成的OH−,测定相同浓度的CH3COONH4和NaHCO3溶液的pH,后者大于前者,不能说明Kh(CH3COO−)
C.浓硫酸和稀硫酸与锌反应不同,不能用来相互比较反应速率,C错误;
D.Fe(NO3)2溶液中加入硫酸,酸性条件下的硝酸根会氧化亚铁离子而无法检验出原物质中是否含有Fe3+,D错误;
故答案为:B。
10.B
【详解】A.天然气(主要成分CH4)是一种清洁能源,已经成为居民的生活用气,A正确;
B.泡沫灭火剂的主要成分为NaHCO3和Al2(SO4)3两种溶液相互促进水解生成沉淀和气体,可作泡沫灭火剂,B错误;
C.催化剂能够通过降低反应需要的活化能而加快反应速率,降低反应所需的温度、压强等条件,故催化作用可以为化学工业带来巨大的经济效益,C正确;
D.碱性废水可通过投加酸性废水来中和,烟道气中常含有二氧化硫气体,能与碱发生反应,可用于环保领域中处理碱性废水,D正确;
故答案为:B。
11.C
【详解】A.盐类的水解规律为强碱弱酸盐显碱性,所以可根据CH3COONa的水溶液pH>7得出CH3COOH为弱电解质,A项不符合题意;
B.0.1mol/L的CH3COOH溶液的pH为2,即没有完全电离可判断它为弱电解质,B项不符合题意;
C.CH3COOH使石蕊变红只能说明其为酸性,无法确定是否为强弱电解质,C项符合题意;
D.相同浓度的醋酸和盐酸到电能离有电离度决定,醋酸弱说明没有完全电离,可判断它为弱电解质,D项不符合题意;
故选C。
12.A
【分析】由题给流程可知,向酸性废水中通入氧气将亚铁离子氧化为铁离子,向反应后的溶液中加入氢氧化铜将铁离子转化为氢氧化铁沉淀,过滤得到含有氢氧化铁的滤渣和滤液1;向滤液1中加入碳酸氢铵溶液将溶液中的铜离子转化为碱式碳酸铜沉淀,过滤得到碱式碳酸铜和滤液2;碱式碳酸铜灼烧分解生成氧化铜、二氧化碳和水,则氧化铜经多步处理得到纳米氧化铜;滤液1经处理得到硫酸铵。
【详解】A.由分析可知,向酸性废水中通入氧气的目的是将亚铁离子氧化为铁离子,反应的离子方程式为,故A正确;
B.由分析可知,加入氢氧化铜的目的是将铁离子转化为氢氧化铁沉淀,若用碳酸钙替代氧化铜,反应生成的钙离子会与碳酸氢铵溶液反应生成碳酸钙沉淀,导致所得碱式碳酸铜中混有杂质,导致所得氧化铜不纯,故B错误;
C.向滤液1中加入碳酸氢铵溶液时,溶液中铜离子与碳酸氢根离子可能发生双水解反应生成二氧化碳气体,不可能生成氨气,故C错误;
D.由分析可知,该流程中的分离操作涉及过滤、灼烧,需要用到的仪器为漏斗、玻璃棒、酒精灯、坩埚,不涉及分液操作,不可能用到仪器分液漏斗,故D错误;
故选A。
13.D
【分析】由电离方程式可知,二元酸H2A在溶液中第一步电离完全、第二步部分电离,则溶液中不存在H2A微粒。
【详解】A.0.1mol/LH2A溶液中存在电荷守恒关系c(H+)=c(OH-)+2c(A2-)+ c(HA-)和物料守恒关系c(A2−)+ c(HA−)=0.1mol/L,整合可得c(H+)-c(OH-)-c(A2-)= c(A2-)+ c(HA-)=0.1mol/L,故A正确;
B.由分析可知,二元酸H2A在溶液中第二步部分电离,则20mL0.1mol/LH2A溶液与20mL0.1mol/L氢氧化钠溶液恰好反应生成NaHA,NaHA在溶液中电离使溶液呈酸性,则加入氢氧化钠溶液得到的中性溶液为NaHA和Na2A的混合溶液,所以用去NaOH氢氧化钠溶液的体积小于20mL,故B正确;
C.20mL0.1mol/LH2A溶液与20mL0.1mol/L氢氧化钠溶液恰好反应生成NaHA,NaHA在溶液中电离使溶液呈酸性,溶液中存在质子守恒存在如下关系c(H+)-c(A2-)=c(OH-),则溶液中存在c(A2-)=c(H+)-c(OH-)-c(OH-),故C正确;
D.20mL0.1mol/LH2A溶液与40mL0.1mol/L氢氧化钠溶液恰好反应生成Na2A,Na2A溶液,根据物料守恒故选c(Na+)=2c(HA-)+2c(A2-),故D错误;
故选D。
14.AC
【分析】溶液的pH=11,说明该碱部分电离为弱碱,此时pOH=3,,;
【详解】A.由分析可知,MOH为弱碱,A错误;
B.N点溶质为等量的MOH、MCl,此时溶液显碱性,MOH电离大于MCl的水解,故存在关系:,B正确;
C.pH=9时,pOH=5,,则,C错误;
D.O点存在弱碱MOH分子,加入盐酸后的O点主要溶质为MOH生成的强电解质MCl,故混合溶液的导电能力:O点>N点,D正确;
故选AC。
15.(1) 1×10 -13 2:9
(2) < 0.2
(3) 中
【解析】(1)
某温度时,测得0.01mol·L-1NaOH溶液的pH=11,说明c(H+)=1×10-11、c(OH-)=1×10-2,该温度下水的离子积Kw=1×10-13。该温度下,将pH=12的NaOH溶液VamL与pH=2的H2SO4溶液VbmL混合,混合后溶液的pH=11,则,所以Va:Vb=2:9。
(2)
用物质的量分别为0.1mol的HCN和NaCN配成1L混合溶液,根据电荷守恒c(CN-)+c(OH-)= c(Na+)+c(H+),其中c(CN-)小于c(Na+),则溶液中c(H+)
室温下将amol·L-1的HCN与0.1mol·L-1的NaOH溶液等体积混合,根据电荷守恒c(CN-)+c(OH-)= c(Na+)+c(H+),反应后溶液中c(Na+)=c(CN-),所以c(H+)=c(OH-),则溶液显中性;反应后溶液中c(Na+)=c(CN-)=0.05 mol·L-1,c(HCN)=(-0.05) mol·L-1,HCN的电离常数Ka=。
16.(1) CH3COO-+ H2O⇌CH3COOH+OH- NH3·H2O⇌+OH-
(2)c(Na+)>c(CN-)>c(OH-)>c(H+)
(3)>
(4)9:11
(5)Fe3++3H2O⇌Fe(OH)3+3H+;加入盐酸后,增加了c(H+),使平衡向左移动,抑制Fe3+的水解
(6)CN-+CO2+H2O=HCN+
(7)中
【详解】(1)醋酸钠是强碱弱酸盐,醋酸根离子水解CH3COO-+ H2O⇌CH3COOH+OH-,所以CH3COONa溶液pH=10;NH3·H2O是弱碱,NH3·H2O电离出氢氧根离子,NH3·H2O⇌+OH-,所以溶液④pH=11。
(2)NaCN是强碱弱酸盐,CN-水解,溶液呈碱性,NaCN溶液中各离子浓度由大到小的顺序是c(Na+)>c(CN-)>c(OH-)>c(H+);
(3)HCN酸性小于CH3COOH,根据“越弱越水解”,同浓度的NaCN、CH3COONa,NaCN水解程度大于CH3COONa,所以溶液①和③相比较,pH (NaCN)>pH (CH3COONa)。
(4)25℃时,V1L⑤HCl溶液和V2L②NaOH溶液混合后,混合溶液的pH=12,则,所以V1:V2=9:11。
(5)Fe3+易水解,Fe3++3H2O⇌Fe(OH)3+3H+,加入盐酸后,c(H+)增大,使平衡向左移动,抑制Fe3+的水解,所以实验室配制⑥FeCl3溶液时通常加入少量盐酸。
(6)25℃时,Ka1(H2CO3)> Ka(HCN)>Ka2(H2CO3),向①NaCN溶液中通入少量CO2生成碳酸氢钠和HCN,发生反应的离子方程式为CN-+CO2+H2O=HCN+;
(7)常温下若③CH3COONa和④CH3COOH的混合溶液中c(Na+) =c(CH3COO-),根据电荷守恒c(H+) =c(OH-),则该溶液呈中性。
17.(1)CH3COOH+NH3•H2O=NH+ CH3COO—+H2O
(2)④②③①
(3)⑥⑦④⑤⑧
(4)BCDA
(5)SO2+HCO= CO2+HSO
(6)9.9×10—7mol/L
【详解】(1)醋酸溶液与氨水反应生成醋酸铵和水,反应的离子方程式为CH3COOH+NH3•H2O=NH+ CH3COO—+H2O,故答案为:CH3COOH+NH3•H2O=NH+ CH3COO—+H2O;
(2)氯化铵是强酸弱碱盐,铵根离子在溶液中水解促进水的电离,四种等浓度的溶液中,水电离出的氢离子浓度最大;硫酸、醋酸在溶液中电离出的氢离子和氢氧化钠在溶液中电离出的氢氧根离子都抑制水的电离,抑制水的电离程度越大,水电离出的氢离子浓度越小,硫酸是二元强酸,溶液中电离出的氢离子浓度大于等浓度的氢氧化钠溶液电离出的氢氧根离子浓度,抑制水的电离程度大于氢氧化钠溶液,醋酸是弱酸,溶液中电离出的氢离子浓度小于等浓度的氢氧化钠溶液电离出的氢氧根离子浓度,抑制水的电离程度小于氢氧化钠溶液,所以四种等浓度的溶液中,由水电离出的氢离子浓度由大到小的顺序为④②③①,故答案为:④②③①;
(3)等浓度的五种溶液中,硫酸铵溶液中铵根离子浓度最大;氨水在溶液中部分电离出铵根离子,五种溶液中,氨水中铵根离子浓度最小;铵根离子在溶液中水解使溶液呈酸性,硫酸氢铵电离出的氢离子抑制铵根离子的水解,溶液中的铵根离子浓度大于等浓度的氯化铵溶液,醋酸铵中醋酸根水解使溶液呈碱性,会促进铵根离子的水解,溶液中的铵根离子浓度小于等浓度的氯化铵溶液,所以五种溶液中铵根离子浓度由大到小的顺序为⑥⑦④⑤⑧,故答案为:⑥⑦④⑤⑧;
(4)由电离常数的大小可知,弱酸和弱酸根在溶液中的电离程度大小为CH3COOH>HSO>HClO>HCO,弱酸和弱酸根在溶液中的电离程度越大,对应盐在溶液的水解程度越小,等浓度的盐溶液的pH越小,所以等浓度的四种盐溶液的pH由大到小排列的顺序为BCDA,故答案为:BCDA;
(5)由电离常数的大小可知,弱酸和弱酸根在溶液中的电离程度大小为H2SO3>H2CO3>HSO>HCO,由强酸制弱酸的原理可知,亚硫酸与碳酸氢钠溶液反应生成亚硫酸氢钠和碳酸,反应的离子方程式为SO2+HCO= CO2+HSO,故答案为:SO2+HCO= CO2+HSO;
(6)醋酸和醋酸钠的混合溶液中存在电荷守恒关系c(Na+)+ c(H+)=c(CH3COO—)+ c(OH—),若溶液的pH为6,则溶液中c(CH3COO—)—c(Na+)= c(H+)—c(OH—)=10—6 mol/L—10—8mol/L=9.9×10—7mol/L,故答案为:9.9×10—7mol/L。
18.(1) 酸 c(K+)>c(HC2O)>c(H+)>c(C2O)>c(OH−)
(2) MnO2+H2C2O4+2H+=Mn2++2CO2↑+2H2O 当滴入最后一滴KMnO4标准溶液,溶液由无色变为浅红色且半分钟不褪色
(3) 10.00 43.5%
(4)B
【详解】(1)的溶液与的的溶液等体积混合,所得溶液溶质为KHC2O4,草酸的电离平衡常数,,草酸氢根离子的水解常数Kh==
(2)滴定前二氧化锰和草酸发生氧化还原反应,依据得失电子守恒、电荷守恒和原子守恒可知,反应的离子方程式为:MnO2+H2C2O4+2H+=Mn2++2CO2↑+2H2O;高锰酸钾溶液为紫红色,因此当滴入最后一滴KMnO4标准溶液,溶液由无色变为浅红色且半分钟不褪色,说明反应达到滴定终点。
(3)滴定前读数为0.30mL,滴定后读数为10.30mL,所消耗KMnO4标准溶液的体积为10.00mL,1.260 g H2C2O4·2H2O的物质的量为:=0.01mol,高锰酸钾和草酸反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O, n(H2C2O4)=0.2000mol/L0.01L=0.005mol,结合MnO2+H2C2O4+2H+=Mn2++2CO2↑+2H2O可知,n(MnO2)=0.01mol-0.005mol=0.005mol,质量为0.005mol87g/mol=0.435g,则MnO2在该软锰矿试样中的质量分数为:100%=43.5%。
(4)A.滴定终点读数时俯视,消耗标准液体积偏小,剩余草酸的量偏小,二氧化锰消耗草酸的量偏高,测量结果偏高,A错误;
B.滴定前有气泡,滴定后气泡消失,消耗标准液体积偏大,剩余草酸的量偏高,二氧化锰消耗草酸的量偏低,测量结果偏低,B正确;
C.没有润洗锥形瓶,不能改变待测液中溶质的物质的量,对测定结果无影响,C错误;
D.滴定过程中加入少量蒸馏水冲洗瓶壁,不能改变待测液中溶质的物质的量,对测定结果无影响,D错误;
答案选B。
2024届高三新高考化学大一轮专题训练题---盐类的水解: 这是一份2024届高三新高考化学大一轮专题训练题---盐类的水解,共22页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。
2024届高三新高考化学大一轮专题训练-盐类的水解: 这是一份2024届高三新高考化学大一轮专题训练-盐类的水解,共26页。试卷主要包含了单选题,多选题,非选择题等内容,欢迎下载使用。
2024届高三新高考化学大一轮专题训练-盐类的水解: 这是一份2024届高三新高考化学大一轮专题训练-盐类的水解,共23页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。