



江苏省南通市如皋市2023-2024学年高三上学期期初考试押题化学试题
展开江苏省南通市如皋市2024届上学期期初考试押题卷
化学学科
一、单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。
1. 新型冠状病毒可通过气溶胶传播,气溶胶属于胶体的一种。下列关于胶体的叙述,不正确的是
A. 明矾净水利用了胶体的吸附性
B. 依据丁达尔效应可将分散系分为溶液、胶体与浊液
C. 雾是气溶胶,在阳光下可观察到丁达尔效应
D. 用渗析法分离胶体与溶液
2. 化学与生活密切相关。下列化学用语或描述表达正确的是
A. 基态硫原子的轨道表示式:
B. H2S的电子式:
C. SO2的VSEPR模型:
D. 中子数为9的氮原子N
3. X、Y、Z、N是原子序数依次增大的4种短周期元素,其元素性质或原子结构如下表。下列说法正确的是
元素 | 元素性质或原子结构 |
X | 原子核外s能级上的电子总数与p能级上的电子总数相等,但第一电离能低于同周期相邻元素 |
Y | 原子核外s能级上的电子总数与p能级上的电子总数相等,但第一电离能高于同周期相邻元素 |
Z | 其价电子中,在不同形状的原子轨道中运动的电子数相等 |
N | 只有一个不成对电子 |
A. 原子半径:
B. 元素的电负性:
C. 元素的第一电离能:
D. X的基态原子的电子轨道表示式:
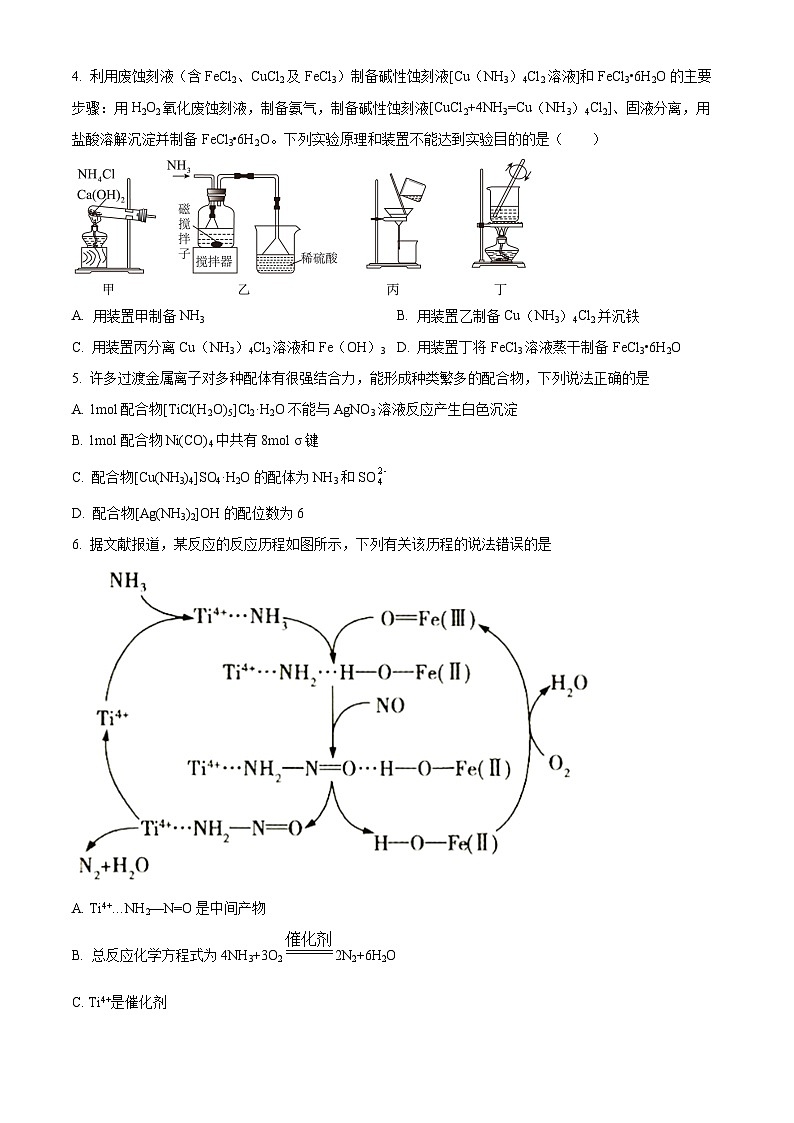
4. 利用废蚀刻液(含FeCl2、CuCl2及FeCl3)制备碱性蚀刻液[Cu(NH3)4Cl2溶液]和FeCl3•6H2O的主要步骤:用H2O2氧化废蚀刻液,制备氨气,制备碱性蚀刻液[CuCl2+4NH3=Cu(NH3)4Cl2]、固液分离,用盐酸溶解沉淀并制备FeCl3•6H2O。下列实验原理和装置不能达到实验目的的是( )
A. 用装置甲制备NH3 B. 用装置乙制备Cu(NH3)4Cl2并沉铁
C. 用装置丙分离Cu(NH3)4Cl2溶液和Fe(OH)3 D. 用装置丁将FeCl3溶液蒸干制备FeCl3•6H2O
5. 许多过渡金属离子对多种配体有很强结合力,能形成种类繁多的配合物,下列说法正确的是
A. 1mol配合物[TiCl(H2O)5]Cl2·H2O不能与AgNO3溶液反应产生白色沉淀
B. 1mol配合物Ni(CO)4中共有8mol σ键
C. 配合物[Cu(NH3)4]SO4·H2O的配体为NH3和SO
D. 配合物[Ag(NH3)2]OH的配位数为6
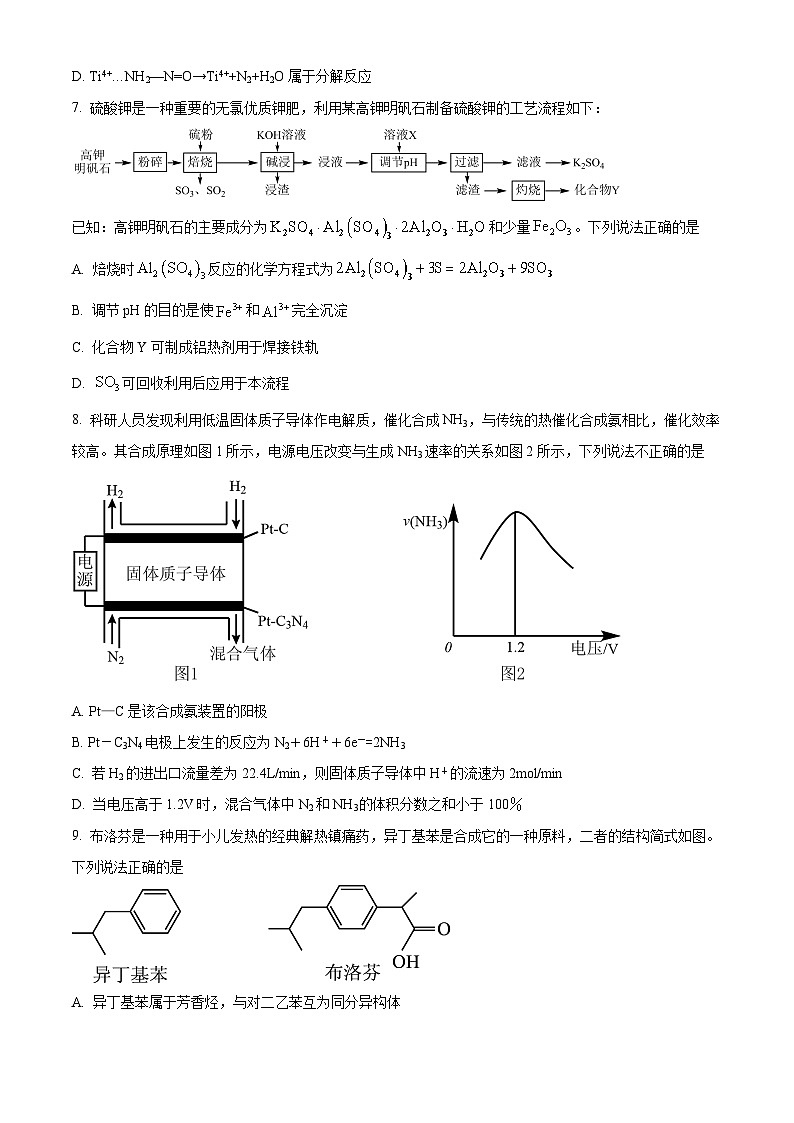
6. 据文献报道,某反应的反应历程如图所示,下列有关该历程的说法错误的是
A. Ti4+…NH2—N=O是中间产物
B. 总反应化学方程式为4NH3+3O22N2+6H2O
C. Ti4+是催化剂
D. Ti4+…NH2—N=O→Ti4++N2+H2O属于分解反应
7. 硫酸钾是一种重要的无氯优质钾肥,利用某高钾明矾石制备硫酸钾的工艺流程如下:
已知:高钾明矾石的主要成分为和少量。下列说法正确的是
A. 焙烧时反应的化学方程式为
B. 调节pH的目的是使和完全沉淀
C. 化合物Y可制成铝热剂用于焊接铁轨
D. 可回收利用后应用于本流程
8. 科研人员发现利用低温固体质子导体作电解质,催化合成NH3,与传统的热催化合成氨相比,催化效率较高。其合成原理如图1所示,电源电压改变与生成NH3速率的关系如图2所示,下列说法不正确的是
A. Pt—C是该合成氨装置的阳极
B. Pt-C3N4电极上发生的反应为N2+6H++6e-=2NH3
C. 若H2的进出口流量差为22.4L/min,则固体质子导体中H+的流速为2mol/min
D. 当电压高于1.2V时,混合气体中N2和NH3体积分数之和小于100%
9. 布洛芬是一种用于小儿发热的经典解热镇痛药,异丁基苯是合成它的一种原料,二者的结构简式如图。下列说法正确的是
A. 异丁基苯属于芳香烃,与对二乙苯互为同分异构体
B. 异丁基苯和布洛芬中碳原子均有和杂化
C. 1mol布洛芬与足量溶液反应生成
D. 两者均能发生加成、取代和消去反应
10. 含氮物质可发生如下反应:①
②
③
下列说法正确的是
A. 常温下,NO与混合能立即看到红棕色气体,说明该反应已达平衡
B. 反应②的
C. 反应③消耗,理论上会生成标准状况下约
D. 利用反应①、②、③可以同时处理含量较高的废气和含的废水
11. 室温下进行下列实验,根据实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向X溶液中滴加几滴新制氯水,振荡,再加入少量KSCN溶液,溶液变为红色 | X溶液中一定含有Fe2+ |
B | 向3mLKI溶液中滴加几滴溴水,振荡,再滴加1mL淀粉溶液,溶液显蓝色 | Br2的氧化性比I2的强 |
C | 用pH试纸测得: CH,COONa溶液的pH约为9,NaNO2溶液的pH约为8 | HNO2电离出H+的能力一定比CH3COOH的强 |
D | 将Na2SO3样品溶于水,滴加稀盐酸酸化Ba( NO3)2溶液,产生白色沉淀 | Na2SO3样品已变质 |
A. A B. B C. C D. D
12. 室温下,通过下列实验探究的性质。已知:25℃时,的、的。
实验1:配制溶液,测得溶液约为12;
实验2:取溶液,向其中加入少量固体充分搅拌,一段时间后过滤。向滤渣中加入足量稀盐酸,固体完全溶解;
实验3:取溶液,向其中缓慢滴入等体积稀盐酸。
下列说法正确的是
A. 实验1所得溶液中,
B. 根据实验2,可推测
C. 实验3反应后溶液中存在:
D. 25℃时,反应平衡常数
13. 碳热还原氧化锌反应可用于循环制氢。碳热还原氧化锌的主要反应如下:
反应I ;
反应Ⅱ
在不同容器中分别发生反应I、反应Ⅱ,不同压强(P1或P2)下分别达平衡时,两个反应中随温度变化的关系如图所示。下列说法正确的是
A. 压强大小:
B. 在如图所示条件下,反应I可表示为
C. 选择反应Ⅱ的小于反应I的条件,将C与ZnO置于同一密闭容器中,碳热还原氧化锌反应能顺利进行
D. 一定条件下将C与ZnO置于同一密闭容器中反应,当时,增大的值,可减少平衡时气体中的含量
二、非选择题:共4题,共61分。
14. 五氧化二钒是广泛用于冶金、化工等行业的催化剂。工业上以石煤(主要成分为,含有少量、等杂质)为原料制备,主要经过“焙烧、水浸、除杂、沉钒、灼烧”等过程。
已知:①溶于水,难溶于水。
②,。
回答下列问题:
(1)向石煤中加纯碱,在通入空气的条件下焙烧,转化为,该反应的化学方程式为_______。
(2)向水浸后的溶液中加入生成、沉淀以除去硅、磷,除杂后的溶液中的浓度为,此时溶液中_______;磷、硅去除率随温度变化的曲线如图所示,随着温度升高除磷率下降而除硅率升高,可能的原因是_______。
(3)“沉矾”时加入析出,沉钒温度需控制在50℃左右,温度不能过高的原因为_______。
(4)在空气中灼烧得。称取0.80g灼烧后的产物,加入稀硫酸溶解后,向其中加入溶液25mL,再用溶液滴定过量的溶液至终点,消耗溶液的体积为4.00mL,则产物中的质量分数为_______(写出计算过程)。已知:
(5)还原可制得,如图为的晶胞,该晶胞中钒的配位数为_______。
15. 化合物J是一种昆虫生长调节剂,其人工合成路线如下:
(1)C的分子式,其结构简式为___________。
(2)合成时不采用的方法,原因是___________。
(3)F→G反应需控制在130℃左右,温度过高会有一种分子式为的副产物生成,该副产物的结构简式为___________。
(4)H的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:___________。
①能发生银镜反应,能与溶液发生显色,碱性条件水解
②分子中含有4种不同化学环境的氢原子;
(5)已知:。写出以甲苯、为原料制备的合成路线流程图_____________(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
16. 汽车尾气已成为城市空气主要污染源,治理汽车尾气的SCR(选择性催化还原)和NSR (NOx储存还原)技术均可有效降低柴油发动机工作过程中排放的NOx。
(1)SCR工作原理
①尿素[CO(NH2)2]水溶液热分解为NH3和CO2,该反应的化学方程式是___________。
②反应器中NH3还原NO2的化学方程式是___________。
(2)NSR(NOx储存还原)的工作原理如下图所示,柴油发动机工作时在稀燃(O2充足、柴油较少)和富燃(O2不足、柴油较多)条件下交替进行,通过BaO和Ba(NO3)2的相互转化实现NOx 的储存和还原。
①BaO吸收NO2的反应中氧化剂与还原剂的物质的量之比是___________。
②富燃条件下Pt表面反应的化学方程式是___________。
③若柴油中硫含量较高,在稀燃过程中,BaO吸收氮氧化物的能力下降至很低水平,结合化学方程式解释原因:___________。
④研究发现:尾气中的CO2对BaO吸收氮氧化物有影响。一定温度下,测得气体中CO2的体积分数与氮氧化物吸收率的关系如下图所示。则:一定范围内,氮氧化物吸收率随CO2体积分数的增大而下降,原因是___________;当CO2体积分数达到10%~20%时,氮氧化物吸收率依然较高,原因可能是___________。
17. CuCl用作有机合成催化剂等工业。CuCl露置于潮湿的空气中易被氧化和水解,酸性条件下易歧化,难溶于水,易溶于浓盐酸并生成[CuCl2]-。
(1)基态Cu+核外电子排布式是_______。
(2)实验测得:CuCl属于共价化合物,气态CuCl分子的相对分子质量为199,该分子中含有配位键,则气态CuCl分子的结构式可能为_______。
(3)已知:①Ksp(CuCl)≈1×10-7,②反应2Cu+=Cu+Cu2+平衡常数K≈1×106。有人预设用反应Cu(s)+Cu2++2Cl-=2CuCl(s)制备CuCl (s),试预测该反应进行的程度大小:_______ (填写“几乎完全反应”或“几乎不反应”)。
工业上有多种制备CuCl的方法:
方法一:将废铜粉与食盐水、浓盐酸料液混合,在60~70℃缓慢通入空气进行氧化。静置,取上层清液加水稀释,生成CuCl沉淀,过滤,沉淀经洗涤、干燥得CuCl产品并真空保存。
方法二:将Na2SO3的水溶液逐滴加入CuCl2的水溶液中,再加入少量浓盐酸混匀,充分反应后过滤,沉淀经洗涤、干燥得CuCl产品并真空保存。
(4)“方法一”中:
①反应温度控制在60~70℃,目的是_______。
②加入浓盐酸的目的是_______。
(5)“方法二”中:
①总反应的离子方程式是_______。
②加入Na2SO3溶液体积(V)与溶液pH关系如图1。当Na2SO3溶液体积大于500 mL时,溶液pH增大的原因是_______。
③用酸或碱液调控反应混合液的pH,则CuCl产率见图2。pH<2.5时,CuCl产率相对较低;pH>3.5时,CuCl产率又迅速下降。试分析原因: _______。
江苏省泰州中学2023-2024学年高三上学期期初调研考试化学试题: 这是一份江苏省泰州中学2023-2024学年高三上学期期初调研考试化学试题,共11页。试卷主要包含了单项选择题,非选择题等内容,欢迎下载使用。
江苏省泰州中学2023-2024学年高三上学期期初调研考试化学试题: 这是一份江苏省泰州中学2023-2024学年高三上学期期初调研考试化学试题,共11页。试卷主要包含了单项选择题,非选择题等内容,欢迎下载使用。
2021-2022学年江苏省南通市如皋市高二下学期期初调研化学试题(Word版): 这是一份2021-2022学年江苏省南通市如皋市高二下学期期初调研化学试题(Word版),共11页。试卷主要包含了 下列图示与对应的叙述相符的是等内容,欢迎下载使用。












