





高考化学一轮复习课件8 铝、镁及其化合物(含解析)
展开1.掌握铝、镁的主要性质及其应用2.掌握铝、镁的重要化合物的主要性质及其应用3.了解铝、镁及其化合物的制备方法
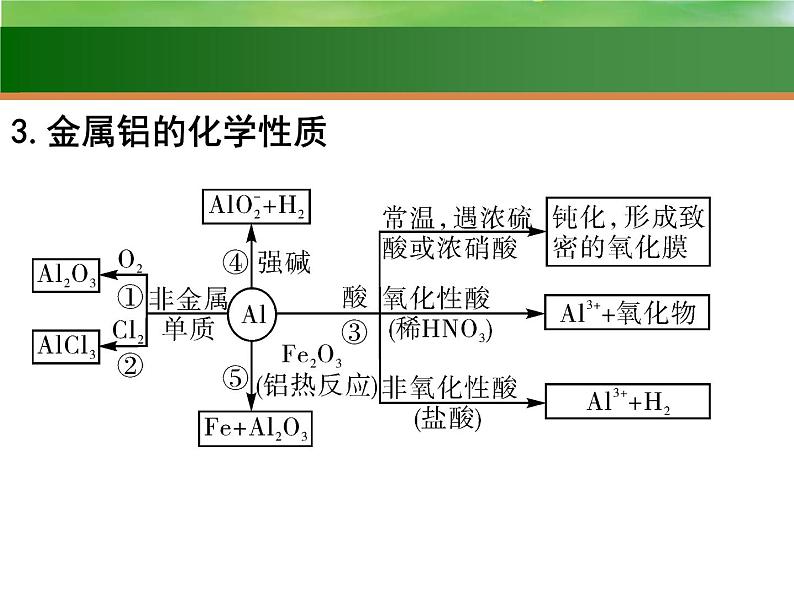
铝位于元素周期表 ,原子结构示意图为 。铝是地壳中含量最多的金属元素。 自然界中的铝全部以化合态的形式存在。
铝是 有金属光泽的固体,密度较 (属轻金属),质地柔软,熔、沸点 ,有良好的延展性、导电性和传热性等。
②______________________________________。③______________________________________; ______________________________________。④______________________________________。⑤______________________________________。
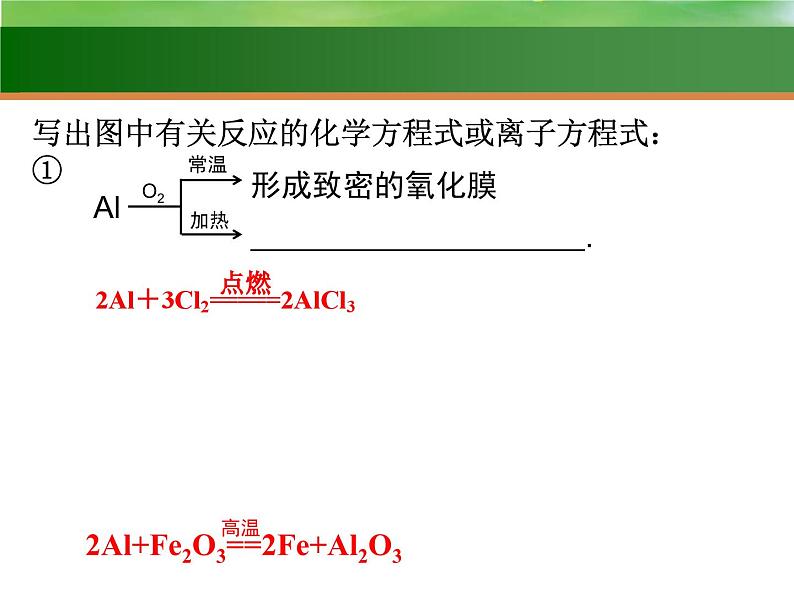
写出图中有关反应的化学方程式或离子方程式:①
.
2Al+6H+===2Al3++3H2↑
纯铝用作导线,铝合金用于制造汽车、飞机、生活用品等。
反应现象:镁条剧烈燃烧,放出大量热,发出耀眼白光,纸漏斗内剧烈反应,纸漏斗被烧穿,有红热的熔融物落入沙中。
铝—还原剂(活泼金属—可作还原剂)
铝热反应的应用:(1)焊接钢轨(2)冶炼难熔的金属
判断正误(正确的画“√”,错误的画“×”)。(1)只有Al粉与Fe2O3的混合物才可称为铝热剂。( )(2)1 ml铝分别与含足量的盐酸或NaOH溶液充分反应,产生氢气的量相同。( )(3)工业上可用电解AlCl3溶液的方法冶炼铝。( )(4)将铝片放入到浓硝酸或浓硫酸中没有明显现象,说明铝与这两种溶液不能发生化学反应。( )(5)Al既能溶于强酸,又能溶于强碱,所以说“Al既有金属性,又有非金属性” 属于两性物质。( )
1.(2019·福州质检)科技工作者提出用铝粉处理含亚硝酸盐废水的思路:调节亚硝酸盐废水的酸碱性,使其pH>12,然后加入适量的铝粉、搅拌,从而达到预期目的。下列判断错误的是( )A.处理废水时铝单质转化为Al3+B.处理废水时亚硝酸盐被还原C.处理过程中,OH-参与了反应D.铝粉颗粒大小影响废水处理的速率
2.(2018·四川眉山模拟)下列除去杂质的方法不正确的是( )A.镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥B.用过量氨水除去Fe3+溶液中的少量Al3+C.Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤D.MgO中混有少量Al2O3:加入足量烧碱溶液,充分反应,过滤、洗涤、干燥得到MgO
5.铝是中学化学学习阶段的唯一一种既能与酸(非氧化性酸)反应又能与强碱溶液反应放出H2的金属。就铝的这一特殊性质回答下列问题:(1)等质量的两份铝分别与足量的盐酸、氢氧化钠溶液反应,所得H2的体积之比是________。(2)足量的两份铝分别投入到等体积、等物质的量浓度的盐酸、氢氧化钠溶液中,产生H2的体积之比是________。(3)足量的两份铝分别投入到等体积、一定物质的量浓度的HCl、NaOH溶液中,二者产生H2的体积相等,则HCl和NaOH的物质的量浓度之比是_____________。
(1)铝与盐酸、氢氧化钠反应的化学方程式分别为:2Al+6HCl=2AlCl3+3H2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑。(2)铝与盐酸、氢氧化钠反应的实质都是:Al——→Al3+,2H+——→H2。所以无论与酸还是与碱反应,Al与H2的关系都是2Al~3H2,也可以直接利用得失电子守恒直接计算。
铝与酸、碱反应生成H2的量的关系
(3)①等量铝分别与足量盐酸和氢氧化钠溶液反应,产生氢气体积比VHCl(H2):VNaOH(H2)=1∶1。
②足量的铝分别与等物质的量的盐酸和氢氧化钠溶液反应,产生氢气的体积比VHCl(H2):VNaOH(H2)=1∶3。
③一定量的铝分别与一定量的盐酸和氢氧化钠溶液反应,产生氢气的体积比1/3<VHCl(H2):VNaOH(H2)<1,则必定是铝与盐酸反应时,铝过量而盐酸不足,铝与NaOH溶液反应时,铝不足而NaOH溶液过量。
(1)物理性质:白色固体,难溶于水,有很高的熔点。
.
.
Al2O3+6HCl===2AlCl3+3H2O
Al2O3+2NaOH==2NaAlO2+H2O
(3)用途:利用其高熔点常用作耐火材料,如制坩埚、高温炉管等。
(1)物理性质:白色胶状不溶于水的固体,有较强的______性。
(2)化学性质(用化学方程式表示):
Al(OH)3的电离方程式:
Al(OH)3+3HCl==AlCl3+3H2O
Al(OH)3+NaOH==NaAlO2+2H2O
(3)用途:吸附剂、胃酸中和剂
(4)制备(用离子方程式表示):
(1)向铝盐中加入氨水:______________________________________________________。(2)NaAlO2溶液中通入足量CO2:_____________________________________________________。(3)NaAlO2溶液与AlCl3溶液混合:_____________________________________________________。
3.常见的铝盐——明矾
(1)硫酸铝钾是由两种不同的金属离子和一种酸根离子组成的复盐。(2)明矾的化学式为_____________,它是无色晶体,可溶于水,水溶液pH__(填“<”“>”或“=”)7。明矾可以净水,其净水的原理是Al3++3H2O=Al(OH)3(胶体)+3H+,Al(OH)3胶体吸附水中杂质形成沉淀而净水。(3)明矾溶液与Ba(OH)2溶液反应的离子方程式:①Al3+恰好完全沉淀: _______________________________________________,②SO42-恰好完全沉淀:_______________________________________________。
KAl(SO4)2·12H2O
2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O
3.常见的铝盐——Al3+
(1)Al3+易发生水解,生成胶状的氢氧化铝胶体,水解的离子方程式为: 。(2)Al3+与AlO2-、HS-、S2-、HCO3-、CO32-等会发生双水解反应。(可用于判断离子共存问题)
Al3++3H2O=Al(OH)3(胶体)+3H+
4.偏铝酸盐——AlO2-
(1)偏铝酸钠与盐酸反应
NaAlO2+ HCl (少量) + H2O == Al(OH)3↓+ NaCl
NaAlO2+ 4HCl (过量) ==AlCl3+ NaCl + 2H2O
2NaAlO2+ CO2 (少量) + 3H2O = 2Al(OH)3↓ + Na2CO3
NaAlO2+ CO2(过量) + 2H2O = Al(OH)3↓+ NaHCO3
(2)往偏铝酸钠溶液中通入二氧化碳
3NaAlO2+AlCl3+6H2O == 4Al(OH)3↓+ 3NaCl
(3)偏铝酸钠与氯化铝溶液反应
(4)AlO2-水解呈碱性,与H+、HCO3-、Al3+、Fe3+等不能大量共存。与OH-可以共存!
(1)Al2O3熔点高,所以可用作耐高温材料。( )(2)实验室制备Al(OH)3是用可溶性铝盐与过量氨水反应而不是过量NaOH溶液。( )(3) 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成。( )(4)向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全,此时反应的离子方程式为2Al3++3SO42-+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓。( )(5)明矾的净水作用与液氯对自来水的消毒作用原理相同。( )
1.工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
下列叙述正确的是( )A.试剂X可以是氢氧化钠溶液,也可以是盐酸B.反应①过滤后所得沉淀为氢氧化铁C.图中所示转化反应都不是氧化还原反应D.反应②的化学方程式为NaAlO2+CO2+2H2O= Al(OH)3↓+NaHCO3
2.用含少量镁粉的铝粉制取纯净的氢氧化铝,下列操作步骤中最恰当的组合是( )①加盐酸溶解 ②加烧碱溶液溶解 ③过滤 ④通入过量CO2生成Al(OH)3沉淀 ⑤加入盐酸生成Al(OH)3沉淀 ⑥加入过量烧碱溶液A.①⑥⑤③ B.②③④③C.②③⑤③ D.①③⑤③
1.Al3+、Al(OH)3、AlO之间的转化关系
写出实现上述各步转化的离子方程式。
(1)①________________________________; ②_________________________________; ③_________________________________。(2)__________________________________。(3)__________________________________。(4)__________________________________。(5)①_________________________________; ②_________________________________。(6)___________________________________。
Al3++3OH-===Al(OH)3↓
Al(OH)3+3H+===Al3++3H2O
2.与Al(OH)3沉淀生成有关的图象分析
(1)可溶性铝盐溶液与NaOH溶液反应的图象
先有白色沉淀产生,然后沉淀逐渐溶解
先无明显现象,然后逐渐产生大量的白色沉淀
Al3++3OH-=Al(OH)3↓
Al(OH)3+OH-=AlO2-+2H2O
Al3++4OH-=AlO2-+2H2O
Al3++AlO2-+6H2O=4Al(OH)3↓
(2)偏铝酸盐溶液与盐酸反应的图象。
先生成白色沉淀,随后沉淀逐渐溶解
先无明显现象,反应一段时间后逐渐产生白色沉淀
Al(OH)3+3H+=Al3++3H2O
AlO2-+H++H2O=Al(OH)3↓
AlO2-+4H+=Al3++2H2O
1.如图表示AlCl3溶液与NaOH溶液相互滴加过程中微粒的量的关系曲线。下列判断错误的是( )A.①线表示Al3+的物质的量的变化B.x表示AlCl3的物质的量C.③线表示Al(OH)3的物质的量的变化D.④线表示AlO2-的物质的量的变化
2.现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如右图所示。原溶液中Cl-与SO42-的物质的量之比为( ) A.1∶3 B.2∶3 C.6∶1 D.3∶1
铝是地壳中含量最多的金属元素,在自然界主要以化合态的形式存在于氧化铝中。铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,冶炼金属铝很重要的一个过程是Al2O3的提纯。由于Al2O3是两性氧化物,而杂质SiO2是酸性氧化物,Fe2O3是碱性氧化物,因而可设计出两种提纯氧化铝的方案。
讨论回答下列问题:(1)写出①③两步骤中可能发生反应的离子方程式:①______________________________________,______________________________________。③______________________________________,______________________________________。
Al2O3+2OH-==2AlO2-+H2O
SiO2+2OH-==SiO32-+H2O
AlO2-+CO2+2H2O==Al(OH)3↓+HCO3-
SiO32-+2CO2+2H2O==H2SiO3↓+2HCO3-
(2)步骤③中不用盐酸(或H2SO4)酸化的理由是___________________________________________________________________________________________________________________________________________。(3)步骤④中得到较纯的Al2O3,可能含有________杂质,在电解时它不会影响铝的纯度的原因:___________________________________________________________________。
因为AlO2(-)与酸反应生成的Al(OH)3具有两性,可溶于强酸,不易控制酸的量;CO2廉价而且生成的副产物NaHCO3用途广泛,经济效益好
由于SiO2的熔点很高,在加热到1000 ℃ 左右时不会熔化,因而不影响铝的纯度
讨论回答下列问题:(1)写出①②中可能发生反应的离子方程式:①_____________________________________________________。②_____________________________________________________。(2)步骤②中不用氨水沉淀Fe3+的原因:__________________________________________________________________________________。
Al2O3+6H+===2Al3++3H2O
Fe2O3+6H+===2Fe3++3H2O
Al3++4OH-===AlO2-+2H2O
Fe3++3OH-===Fe(OH)3↓
Al(OH)3只能溶于强碱,不能溶于氨水,用氨水不能将Fe(OH)3和Al(OH)3分离
1.以Al2O3为原料(含FeO杂质)制备高纯铝单质的一种工艺流程如下,下列说法正确的是( )
A.灼烧滤渣需要用到的硅酸盐仪器有酒精灯、蒸发皿、玻璃棒B.通入过量CO2发生的反应的离子方程式为AlO2-+CO2+2H2O==Al(OH)3↓+HCO3-C.操作Ⅱ后所得滤渣需要洗涤,证明滤渣已洗涤干净,可用CaCl2溶液D.操作Ⅰ后的滤渣中铁元素的价态可用盐酸和KMnO4溶液检验
具有银白色金属光泽的固体,密度、硬度均较小,熔点较低,有良好的导电性、传热性和延展性。
(1)与非金属反应:①与O2反应:②与Cl2反应:③与N2反应:
Mg+2H+ == Mg2++H2↑
镁制造信号弹和焰火;镁合金用于制造火箭、导弹和飞机的部件;氧化镁用于制耐高温材料。
(2)主要化学反应。①制石灰乳:CaCO3===CaO+CO2↑、 CaO+H2O==Ca(OH)2;②沉淀Mg2+:Mg2++Ca(OH)2==Mg(OH)2↓+Ca2+;③制备MgCl2:Mg(OH)2+2HCl==MgCl2+2H2O;④电解MgCl2:MgCl2(熔融)==Mg+Cl2↑。
1.氧化镁:碱性氧化物,熔点很高,可用作耐火材料,难溶于水,与酸反应:MgO+2H+ == Mg2++H2O
2.氢氧化镁:中强碱,难溶于水,存在溶解平衡:Mg(OH)2(s) ⇌Mg2+(aq)+2OH-(aq),溶解度小于碳酸镁,故碳酸镁水解生成氢氧化镁:MgCO3+H2O == Mg(OH)2+CO2↑
3.氯化镁:MgCl2可发生水解,由MgCl2·6H2O制备MgCl2时,要在HCl的气氛中脱水。
3.氮化镁:在水中剧烈水解,生成Mg(OH)2和NH3Mg3N2 +6H2O ==3Mg(OH)2+2NH3↑
(1)工业用电解熔融MgCl2得到的镁。( )(2)镁在空气中燃烧的产物只有氧化镁。( )(3)向粗盐溶液中加入Na2CO3以除去含有的Mg2+杂质。( )(4)镁条在空气中易与氧气反应,保存时应浸泡于煤油中。( )(5)将MgCl2溶液加热蒸干制备无水MgCl2固体。( )
1.某同学通过系列实验探讨Mg及其化合物的性质,操作正确且能达到目的的是( )A.将水加入浓硫酸中得到稀硫酸,置镁片于其中探讨Mg的活泼性B.将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成C.将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀D.将Mg(OH)2沉淀转入表面皿中,加足量稀盐酸,加热蒸干得无水MgCl2固体
2.从海水中提取镁的工艺流程如下图所示:
下列说法错误的是( )A.用此法提取镁的优点之一是原料来源丰富B.步骤⑥电解MgCl2时阴极产生氯气C.步骤⑤可将晶体置于HCl气体氛围中脱水D.上述工艺流程中涉及化合、分解和复分解反应
3.镁及其化合物是实验设计的热点载体,查阅资料。
Ⅰ.探究镁的性质。某学习小组设计实验探究镁与二氧化氮反应的产物,实验装置如图所示。
(1)B中试剂是______; D装置的作用是__________________________。(2)实验时,先启动A中反应,当C装置中充满红棕色气体时点燃酒精灯,这样操作的目的是______________________________________________________。(3)确定有N2生成的实验现象是__________________________________________________________________。(4)实验完毕后,设计实验确认产物中有Mg3N2,取少量C中残留固体于试管中,滴加蒸馏水,_____________________________________,则产物中有氮化镁。(5)经测定,Mg与NO2反应生成MgO、Mg3N2和N2,其中Mg3N2和N2的物质的量相等。C中发生反应的化学方程式为_________________________________________。
吸收E中挥发出来的水蒸气
排尽装置内的空气,避免O2、CO2、N2等与镁反应
E中产生气泡,瘪气球缓慢鼓起
产生的气体能使湿润的红色石蕊试纸变蓝
Ⅱ.探究Mg(OH)2在氯化铵溶液中溶解的原因。供选试剂有:氢氧化镁、蒸馏水、硝酸铵溶液、盐酸、醋酸铵溶液。取少量氢氧化镁粉末投入氯化铵溶液中,振荡、白色粉末全部溶解。为了探究其原因,他们提出两种假设。假设1:氯化铵溶液呈酸性,H++OH-===H2O,促进Mg(OH)2溶解。假设2:NH4++OH-===NH3·H2O,促进Mg(OH)2溶解。(6)请你帮他们设计实验,探究哪一种假设正确: _________________________________________________________________________________________________________________。
取少量氢氧化镁于试管中,加入足量CH3COONH4溶液,若白色固体溶解,则假设2正确;若白色固体不溶解,则假设1正确
新高考化学一轮复习精品课件 第4章 第17讲 铝、镁及其化合物 (含解析): 这是一份新高考化学一轮复习精品课件 第4章 第17讲 铝、镁及其化合物 (含解析),共60页。PPT课件主要包含了内容索引,铝及其化合物,铝单质,必备知识,Al2O3+,AlOH3,方案二酸溶法,关键能力,FeOH3,镁海水提镁等内容,欢迎下载使用。
第14讲 铝、镁及其化合物-2024年高考化学一轮复习高频考点精讲(新教材新高考)课件PPT: 这是一份第14讲 铝、镁及其化合物-2024年高考化学一轮复习高频考点精讲(新教材新高考)课件PPT,共35页。PPT课件主要包含了复习目标,铝及其化合物,考点一,必备知识,易错辨析,专项突破,归纳提升,镁海水提镁,考点二,特别提醒等内容,欢迎下载使用。
第17讲 铝、镁及其化合物-2024年高考化学大一轮复习课件(新教材): 这是一份第17讲 铝、镁及其化合物-2024年高考化学大一轮复习课件(新教材),共60页。PPT课件主要包含了专项突破,归纳整合等内容,欢迎下载使用。












