
2024届高三新高考化学大一轮专题练习--碳族元素及其化合物
展开2024届高三新高考化学大一轮专题练习--碳族元素及其化合物
一、单选题
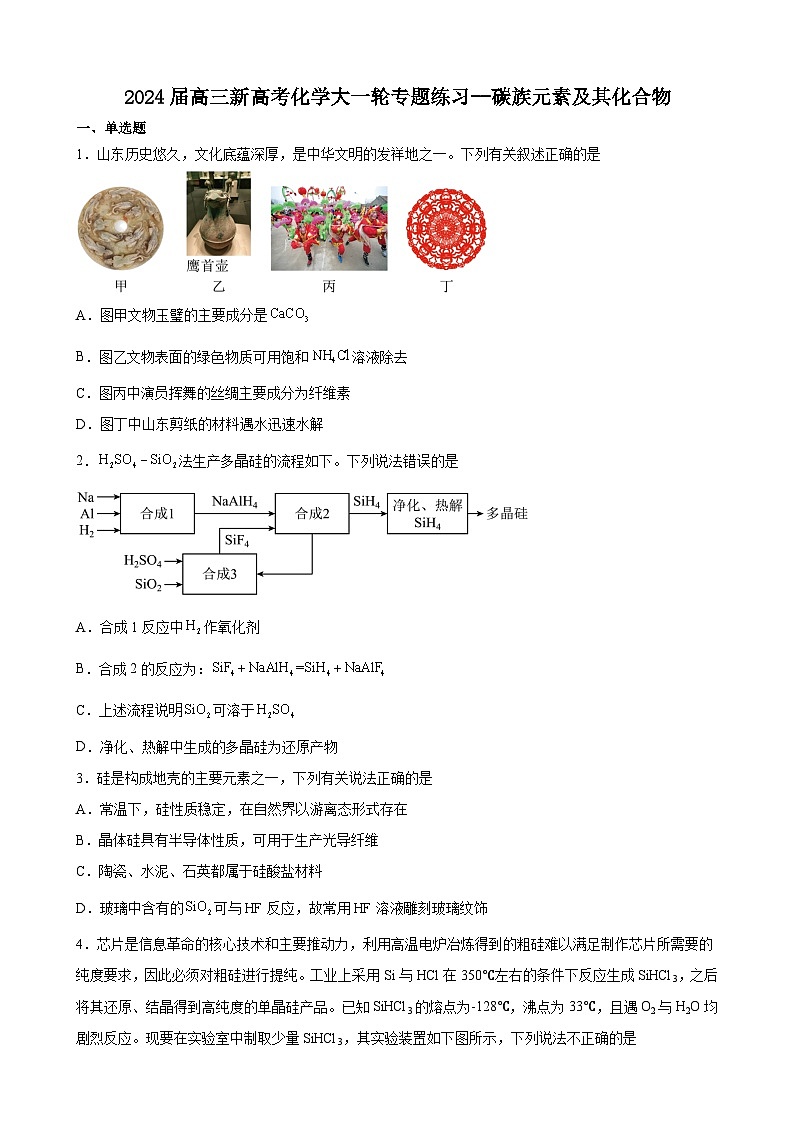
1.山东历史悠久,文化底蕴深厚,是中华文明的发祥地之一。下列有关叙述正确的是
A.图甲文物玉璧的主要成分是
B.图乙文物表面的绿色物质可用饱和溶液除去
C.图丙中演员挥舞的丝绸主要成分为纤维素
D.图丁中山东剪纸的材料遇水迅速水解
2.法生产多晶硅的流程如下。下列说法错误的是
A.合成1反应中作氧化剂
B.合成2的反应为:
C.上述流程说明可溶于
D.净化、热解中生成的多晶硅为还原产物
3.硅是构成地壳的主要元素之一,下列有关说法正确的是
A.常温下,硅性质稳定,在自然界以游离态形式存在
B.晶体硅具有半导体性质,可用于生产光导纤维
C.陶瓷、水泥、石英都属于硅酸盐材料
D.玻璃中含有的可与HF反应,故常用HF溶液雕刻玻璃纹饰
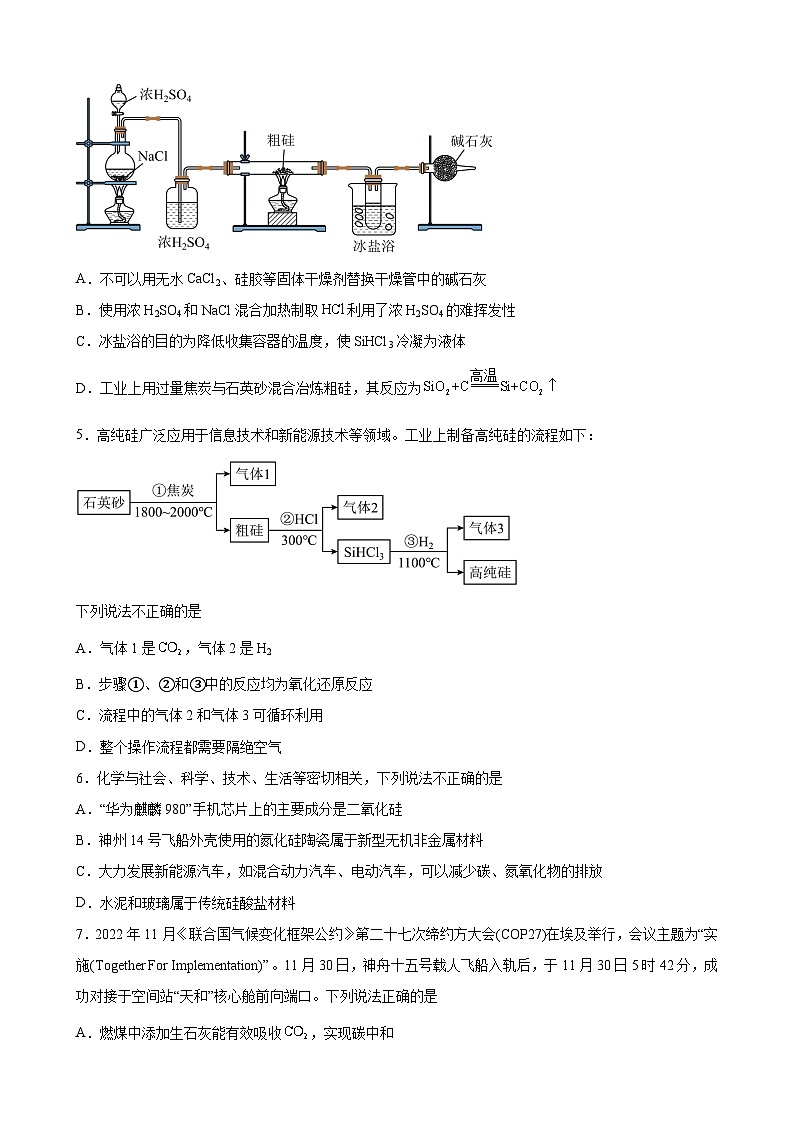
4.芯片是信息革命的核心技术和主要推动力,利用高温电炉冶炼得到的粗硅难以满足制作芯片所需要的纯度要求,因此必须对粗硅进行提纯。工业上采用Si与HCl在350℃左右的条件下反应生成SiHCl3,之后将其还原、结晶得到高纯度的单晶硅产品。已知SiHCl3的熔点为-128℃,沸点为33℃,且遇O2与H2O均剧烈反应。现要在实验室中制取少量SiHCl3,其实验装置如下图所示,下列说法不正确的是
A.不可以用无水CaCl2、硅胶等固体干燥剂替换干燥管中的碱石灰
B.使用浓H2SO4和NaCl混合加热制取利用了浓H2SO4的难挥发性
C.冰盐浴的目的为降低收集容器的温度,使SiHCl3冷凝为液体
D.工业上用过量焦炭与石英砂混合冶炼粗硅,其反应为
5.高纯硅广泛应用于信息技术和新能源技术等领域。工业上制备高纯硅的流程如下:
下列说法不正确的是
A.气体1是,气体2是H2
B.步骤①、②和③中的反应均为氧化还原反应
C.流程中的气体2和气体3可循环利用
D.整个操作流程都需要隔绝空气
6.化学与社会、科学、技术、生活等密切相关,下列说法不正确的是
A.“华为麒麟980”手机芯片上的主要成分是二氧化硅
B.神州14号飞船外壳使用的氮化硅陶瓷属于新型无机非金属材料
C.大力发展新能源汽车,如混合动力汽车、电动汽车,可以减少碳、氮氧化物的排放
D.水泥和玻璃属于传统硅酸盐材料
7.2022年11月《联合国气候变化框架公约》第二十七次缔约方大会(COP27)在埃及举行,会议主题为“实施(Together For Implementation)”。11月30日,神舟十五号载人飞船入轨后,于11月30日5时42分,成功对接于空间站“天和”核心舱前向端口。下列说法正确的是
A.燃煤中添加生石灰能有效吸收,实现碳中和
B.“天和”核心舱其腔体使用的氮化硼陶瓷属于无机非金属材料
C.空气中的含量越高越有利于人体健康
D.核心舱搭载的柔性太阳能电池,二氧化硅是太阳能电池板的核心材料
8.化学与生活密切相关,下列有关说法正确的是
A.电池体积很小,所含污染物有限,可随意丢弃
B.可用作计算机芯片
C.具有氧化性,可用作食品抗氧化剂
D.S粉可除去温度计破碎时洒落的
9.下列离子方程式中书写正确的是
A.水玻璃中通入少量的二氧化碳:
B.二氧化硅放入澄清石灰水中:
C.二氧化硅与氢氟酸反应:
D.单质硅溶于烧碱溶液中:
10.神舟十五号3名航天员顺利进驻中国空间站,两个航天员乘组首次实现“太空会师”,发射火箭的燃料常用联氨、液氢,氧化剂有液氧、液态等。下列叙述错误的是
A.液氢和液氧燃烧放出大量热量,产物对环境友好
B.发射场因液态产生大量而呈红棕色
C.宇宙飞船返回舱外表面使用的高温结构陶瓷的主要成分是硅酸盐
D.和反应中产物的总能量小于反应物的总能量
11.硅及其化合物在材料领域中应用广泛。下列叙述中正确的是
A.水晶、玛瑙的主要成分都是二氧化硅
B.晶体硅主要用途是制造光导纤维
C.硅是地壳中含量最多的元素
D.硅的化学性质很稳定,因此硅在自然界中以游离态形式存在
12.下列物质性质与应用对应关系正确的是
A.氨气极易溶于水,可用作制冷剂
B.晶体硅硬度大,可用于半导体材料
C.二氧化硫有漂白性,可用于杀菌消毒
D.明矾溶于水能形成胶体,可用作净水剂
13.石棉尾矿中主要含有,可用作润滑油添加剂。其中X、Y、Z、W为原子序数依次增大的短周期主族元素;X的原子半径在周期表中最小;Y的p轨道上自旋方向不同的电子数之比为3∶1;W是地壳中含量第二的元素。下列说法正确的是
A.离子半径:
B.Y和W形成的化合物不与酸反应
C.X和Z形成的化合物能与水反应生成一种不溶物和气体
D.X和Y两元素形成的化合物中,一定不含非极性键
14.我国众多的古代文物凝聚了中华劳动人民的匠心、气度和灵性。下列有关说法错误的是
A.战国曾侯乙编钟是青铜制品,青铜是最早使用的合金
B.秦国金柄铁剑的剑柄和剑身分别用纯金和纯铁制作
C.唐朝镶金兽首玛瑙杯的杯体材料玛瑙与水晶的主要成分相同
D.元朝玻璃莲花托盏的主要成分为二氧化硅和硅酸盐
二、非选择题
15.写出下列方程式
(1)将SO2通入足量的澄清石灰水中的化学方程式:_________________
(2)过量铁粉与稀硝酸反应的离子方程式:________________________
(3)工业上制备粗硅的化学方程式:_____________
(4)焦亚硫酸钠(Na2S2O5)可用作食品的抗氧化剂,在测定某葡萄酒中Na2S2O5残留量时,用碘溶液(I2)进行滴定,已知氧化产物为SO,该反应的离子方程式:______________________
16.Ⅰ、某同学用下图所示装置(固定、加热仪器和橡胶管略)进行有关氨制取的实验探究。回答下列问题:
(1)实验室常用装置①制取NH3,其反应的化学方程式为___________;
(2)若用装置②制取并收集干燥的NH3,烧瓶内装的试剂可能是___________,分液漏斗中装的试剂可能是___________。
Ⅱ、硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。请回答下列问题:
(3)下列物质不属于硅酸盐的是___________(填标号)。
A.陶瓷 B.玻璃 C.水泥 D.生石灰
(4)SiO2是玻璃的主要成分之一,SiO2与氢氧化钠溶液反应的化学方程式为SiO2+2NaOH=Na2SiO3+H2O,工艺师常用___________(填物质名称)来雕刻玻璃。
(5)用Na2SiO3溶液浸泡过的棉花不易燃烧,说明Na2SiO3可用作___________,Na2SiO3可通过SiO2与纯碱混合高温熔融反应制得,高温熔融纯碱时下列坩埚可选用的是___________(填标号)。
A.普通玻璃坩埚 B.石英玻璃坩埚 C.氧化铝坩埚 D.铁坩埚
(6)工业上常用2C+SiO2Si+2CO↑制备硅单质,该反应中有元素化合价升高的物质是___________(填化学式,下同),氧化剂是___________。
17.请根据要求书写出方程式。
(1)2021年3月18日,在由全球权威电子行业媒体ASPENCORE主办的2021年中国IC领袖峰会上,苏州芯联成软件有限公司获优异表现,芯片的主要成分是___________,写出其工业用二氧化硅制备其粗产品的化学反应方程式___________
(2)精美的雕花玻璃使我们的世界变得绚丽多彩,雕花玻璃涉及的主要反应的化学方程式为___________。
(3)1754年,Briestly用硵砂(主要成分NH4Cl)和熟石灰共热制得了氨,化学反应方程式为___________。
(4)可利用CH4等气体除去烟气中的氮氧化物,生成物为可参与大气循环的气体,请写出CH4与NO反应的化学方程式___________。
(5)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应可以回收S,其物质转化如图所示。该图示的总反应为___________。
18.A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去):
(1)若A是一种金属C是淡黄色固体,则B的化学式为______;A→C反应的化学方程式为______;写出C的一种用途______(用化学方程式表示)。
(2)若A是一种非金属,其常见单质为黑色固体,C是最主要的温室气体,则C的分子式为______,电子式为______。B→C反应的化学方程式为______。A和C是否能反应?______(填“能”或“不能”),若能,写出反应的化学方程式:______(若不能,此空不填)。
参考答案:
1.B
【详解】A.玉璧主要成分是、等,故A错误;
B.图乙文物的主要成分是铜的合金,表面绿色物质是碱式碳酸铜,碱式碳酸铜易溶于酸性溶液,可以用饱和氯化铵溶液除去,故B正确;
C.丝绸的主要成分是蛋白质,故C错误;
D.纸的成分是纤维素,水解缓慢且需要一定条件,故D错误;
选B。
2.C
【分析】合成1中发生Na+Al+2H2=NaAlH4,合成2中发生NaAlH4+SiF4=SiH4+NaAlF4,合成3制备四氟化硅,净化、热解SiH4步骤中四氢化硅分解为晶体硅和氢气,据此分析;
【详解】A.合成1中发生Na+Al+2H2=NaAlH4,H由0价转化成-1价,化合价降低,氢气作氧化剂,故A说法正确;
B.根据上述分析,合成2中发生NaAlH4+SiF4=SiH4+NaAlF4,故B说法正确;
C.合成3中NaAlF4与硫酸反应生成HF,HF与二氧化硅反应生成SiF4,因此题中不能说明二氧化硅溶于硫酸,故C说法错误;
D.四氢化硅分解为晶体硅和氢气,根据电负性分析,氢的电负性强于硅,硅元素显+4价,化合价降低,因此晶体硅为还原产物,故D说法正确;
答案为C。
3.D
【详解】A.硅的化学性质不活泼,但硅属于亲氧元素,在自然界中以化合态存在,不能以游离态存在,故A错误;
B.单质硅是半导体材料,常用来制作计算机芯片,二氧化硅可用于生产光导纤维,故B错误;
C.陶瓷、水泥属于硅酸盐材料,石英的主要成分是二氧化硅,不属于硅酸盐材料,故C错误;
D.可与HF反应,玻璃中含有,故常用HF溶液雕刻玻璃纹饰,故D正确;
故选D。
4.D
【分析】浓硫酸与NaCl固体混合加热发生复分解反应产生Na2SO4和HCl,HCl气体经浓硫酸干燥后与粗硅发生反应产生SiHCl3,然后经冰盐浴降温后冷凝为液体物质,多余的HCl可以被干燥管的碱石灰吸收然后排放,碱石灰还可以吸收空气中的H2O蒸气,防止SHCl3遇水剧烈反应导致变质。
【详解】A.干燥管中的碱石灰是碱性干燥剂,可以吸收HCl尾气,并可以防止空气中的水分进入收集容器,而不能用无水CaCl2、硅胶等固体干燥剂替换,A正确;
B.使用浓H2SO4和NaCl混合加热制取HCl利用了浓H2SO4的高沸点、难挥发性,B正确;
C,由于SiHCl3的熔点为-128C,沸点为-33C,所以冰盐浴的目的为降低收集容器的温度,使SiCl3冷凝为液体,C正确;
D.工业上用过量的焦炭与石英砂混合冶炼粗硅,发生反应产生Si、CO,反应的化学方程式为,D错误;
故答案为:D。
5.A
【分析】二氧化硅和焦炭反应生成粗硅和一氧化碳,粗硅和氯化氢在300℃下反应生成SiHCl3和氢气,SiHCl3和氢气在1100℃下反应生成高纯硅和氯化氢。
【详解】A.二氧化硅和焦炭反应生成粗硅和一氧化碳,气体1是CO,故A错误;
B.步骤①反应中Si、C元素化合价改变;②反应中Si、H元素化合价改变;③反应中Si、H元素化合价改变,所以均为氧化还原反应,故B正确;
C.气体2是氢气,可循环到步骤③利用;气体3是氯化氢,可循环到步骤②利用,故C正确;
D.为防止硅被氧化,以及防止氢气发生爆炸,整个操作流程都需要隔绝空气,故D正确;
选A。
6.A
【详解】A.手机芯片的主要成分为单质硅,不是二氧化硅,A错误;
B.氮化硅陶瓷是新型无机非金属材料,B正确;
C.大力发展新能源汽车,如混合动力汽车,电动汽车等,可以减少汽车尾气的排放,减少碳、氮氧化物的排放,C正确;
D.水泥和玻璃都属于传统硅酸盐材料,D正确;
故答案选A。
7.B
【详解】A.燃煤中添加生石灰能有效吸收二氧化硫,减少污染物排放,生石灰虽然也能吸收二氧化碳,但高温下又会分解生成二氧化碳,所以不能减少二氧化碳的排放,故A说法错误;
B.氮化硼陶瓷属于新型无机非金属材料,故B说法正确;
C.臭氧是空气污染物之一,空气中的含量不是越高越有利于人体健康,故C说法错误;
D.单晶硅是太阳能电池板的核心材料,故D说法错误;
故选B。
8.D
【详解】A.虽然电池体积很小,也会对水体或土壤进行污染,数量较多的电池污染就比较大,因此不可随意丢弃,故A错误;
B.Si可用作计算机芯片,不是,常作光导纤维,故B错误;
C.可用作食品抗氧化剂,利用具有还原性,故C错误;
D.汞蒸气有毒,S和Hg反应生成HgS,因此S粉可除去温度计破碎时洒落的,故D正确。
综上所述,答案为D。
9.D
【详解】A.水玻璃是硅酸钠的水溶液,该物质是易溶于水的强电解质,以离子形式存在,向其中通入少量CO2反应产生Na2CO3和H2SiO3,反应的离子方程式为:+CO2+H2O=H2SiO3↓+,选项A错误;
B.澄清石灰水中Ca(OH)2以离子形式存在,该反应方程式不符合质量守恒定律和物质存在形式,正确的离子方程式为:Ca2++2OH-+SiO2=CaSiO3+H2O,选项B错误;
C.氢氟酸是弱酸,应该用化学式表示,选项C错误;
D.单质硅溶于烧碱溶液中,生成硅酸钠和H2,反应符合反应事实,遵循电子守恒、原子守恒、电荷守恒,选项D正确;
答案选D。
10.C
【详解】A.液氢和液氧燃烧是放热反应,产物为水,不污染环境,A项正确;
B.液体气化过程中,部分转化成释放,产生红棕色雾,B项正确;
C.高温结构陶瓷耐高温、耐腐蚀,是新型无机非金属材料,不是传统的硅酸盐,C项错误;
D.和反应是放热反应,反应物总能量高于产物总能量,D项正确;
故选C。
11.A
【详解】A.SiO2结晶完美时就是水晶,SiO2胶化脱水后就是玛瑙,因此水晶、玛瑙的主要成分都是SiO2,A正确;
B.光导纤维是用二氧化硅制造的,B错误;
C.地壳中含量最高的元素是氧,C错误;
D.Si在自然界中以SiO2、硅酸盐等化合态形式存在,D错误;
故选A。
12.D
【详解】A.氨气极易液化,常用作制冷剂,与氨气极易溶于水无关,故A错误;
B.硅导电性介于金属和非金属之间,因此晶体硅可用于半导体材料,与硬度无关,故B错误;
C.二氧化硫有漂白性,可用于漂白纸浆,不能用于杀菌消毒,故C错误;
D.明矾溶于水能形成胶体,胶体具有吸附性,因此常用作净水剂,故D正确。
综上所述,答案为D。
13.C
【分析】X的原子半径在周期表中最小,X为H;W是地壳中含量第二的元素,W是Si;Y的p轨道上自旋方向不的电子数之比为3:1,Y的原子序数比Si小,Y是O;根据和正负化合价相等,Z为Mg。
【详解】A.由分析可知,Y是O,Z是Mg,则离子半径:,A错误;
B.由分析可知,Y是O,W是Si,二者形成的化合物为SiO2,SiO2能与氢氟酸反应,B错误;
C.由分析可知,X是H,Z是Mg,二者形成的化合物为MgH2,MgH2与水反应生成和H2,C正确;
D.由分析可知,X是H,Y是O,二者形成的化合物有H2O和H2O2,H2O2中含有非极性键,D错误;
故选C。
14.B
【详解】A.青铜属于合金,是最早使用的合金材料,故A正确;
B.纯铁的硬度小,不适合做剑身,故B错误。
C.玛瑙与水晶的主要成分均为二氧化硅,故C正确;
D.玻璃的主要成分为硅酸盐合二氧化硅,故D正确;
故选:B。
15.(1)SO2+Ca(OH)2=CaSO3↓+H2O
(2)3Fe+8H++2NO=3Fe2++2NO↑+4H2O
(3)
(4)S2O+2I2+3H2O═2SO+4I-+6H+
【详解】(1)SO2为酸性氧化物,能与氢氧化钙反应生成亚硫酸钙,反应方程式为:SO2+Ca(OH)2=CaSO3↓+H2O,故答案为:SO2+Ca(OH)2=CaSO3↓+H2O;
(2)过量铁粉与稀硝酸反应生成亚铁离子和NO,反应离子方程式为:3Fe+8H++2NO=3Fe2++2NO↑+4H2O,故答案为:3Fe+8H++2NO=3Fe2++2NO↑+4H2O;
(3)工业上制备粗硅原理是C单质在高温条件下与二氧化硅反应生成Si和CO,反应方程式为:,故答案为:;
(4)S2O被碘单质氧化为SO,1mol S2O失4mol电子,1mol I2的2mol电子生成碘离子,根据得失电子守恒及元素守恒得离子方程式:S2O+2I2+3H2O═2SO+4I-+6H+,故答案为:S2O+2I2+3H2O═2SO+4I-+6H+。
16.(1)2NH4Cl+2Ca(OH)2CaCl2+2NH3↑+2H2O
(2) CaO(或固体NaOH或碱石灰) 浓氨水
(3)D
(4)氢氟酸
(5) 阻燃剂 D
(6) C SiO2
【详解】(1)装置①为固体加热反应装置,故由此制取NH3,反应物为氯化铵和氢氧化钙,化学方程式为:2NH4Cl+2Ca(OH)2CaCl2+2NH3↑+2H2O。
(2)装置②为固液混合,且没有加热装置,由于氧化钙可与水反应,反应放热(或氢氧化钠溶于水放热),使溶液中c(OH-)增大的同时,促使NH3·H2O的分解生成氨气,故烧瓶内装的试剂可能是CaO(或NaOH或碱石灰)。
(3)在无机非金属材料中,硅及其化合物是密切联系生产生活的一类重要物质,陶瓷、玻璃、水泥等都是硅酸盐产品,生石灰的成分是CaO不属于硅酸盐材料,故选D。
(4)氢氟酸能够与二氧化硅反应生成四氟化硅和水,能够腐蚀玻璃,可用来雕刻玻璃。
(5)Na2SiO3的水溶液俗称水玻璃;硅酸钠不能燃烧,可以用作阻燃剂;SiO2和Na2CO3在高温下反应生成Na2SiO3和CO2,故含SiO2的材料以及Al2O3等都能与Na2CO3在高温下反应,故要用铁坩埚熔融纯碱,故选D。
(6)反应2C+SiO2Si+2CO↑中,C元素化合价升高,Si元素化合价降低,氧化剂是SiO2。
17.(1) Si
(2)4HF+SiO2=SiF4↑+2H2O
(3)
(4)
(5)2H2S+O2=2S↓+2H2O
【详解】(1)硅芯片主要为Si单质。工业利用碳还原SiO2制得,反应为。答案为Si;;
(2)玻璃雕花利用HF与SiO2反应实现,反应为4HF+SiO2=SiF4↑+2H2O。答案为4HF+SiO2=SiF4↑+2H2O;
(3)硵砂(主要成分NH4Cl)和熟石灰[Ca(OH)2]共热制得了氨。答案为;
(4)甲烷除氮氧化物产生CO2和N2,反应为。答案为;
(5)从图看Cu2+和Fe3+为催化剂,而CuS为中间体,则反应为2H2S+O2=2S↓+2H2O。答案为2H2S+O2=2S↓+2H2O。
18.(1) Na2O 2Na+O2Na2O2 2+2H2O=4NaOH+O2↑、2+2CO2=2Na2CO3+O2↑
(2) CO2 2CO+O22CO2 能 C+CO22CO
【分析】(1)A是一种金属,C是淡黄色固体,则A为Na,B为Na2O ,C为Na2O2;(2)A是一种非金属,其单质为黑色固体,C是最主要的温室气体,则A为C,B为CO,C为CO2。
【详解】(1)由分析可知B为Na2O;Na在氧气中燃烧生成,则A→C反应的化学方程式为2Na+O2Na2O2;C为,可以在呼吸面具和潜水艇里作为供氧剂,化学方程式为2+2H2O=4NaOH+O2↑、2+2CO2=2Na2CO3+O2↑;
(2)由分析可知C的分子式为CO2,其电子式为;CO在O2中燃烧生成CO2,则B→C反应的化学方程式为2CO+O22CO2;C能和CO2发生归中反应生成CO,所以 A和C反应的化学方程式为: C+CO22CO。
2024届高三新高考化学大一轮专题练习—碳族元素及其化合物: 这是一份2024届高三新高考化学大一轮专题练习—碳族元素及其化合物,共14页。试卷主要包含了单选题,多选题,非选择题等内容,欢迎下载使用。
2024届高三新高考化学大一轮专题练习:碳族元素及其化合物: 这是一份2024届高三新高考化学大一轮专题练习:碳族元素及其化合物,共14页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。
2024届高三新高考化学大一轮专题练习----碳族元素及其化合物: 这是一份2024届高三新高考化学大一轮专题练习----碳族元素及其化合物,共16页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。













