



【同步讲义】高中化学(苏教版2019)选修第一册--3.3.1 盐类水解的原理 讲义
展开第三单元 盐类的水解
第1课时 盐类水解的原理
目标导航
课程标准
课标解读
1.通过实验探究,认识盐类水解的原理。
2.能用化学用语表示盐类的水解,能通过实验证明盐类水解的存在。
3.结合真实情境中的应用实例,能应用盐类水解原理判断盐溶液的酸碱性。
1.认识盐类水解有一定限度,理解盐类水解的概念,能正确书写盐类水解的离子方程式。(变化观念与平衡思想)
2.通过实验分析、推理等方法认识盐类水解的实质、掌握盐溶液呈现酸、碱性的原因和规律,能根据盐的组成判断溶液的酸、碱性。(证据推理与模型认知)
知识精讲
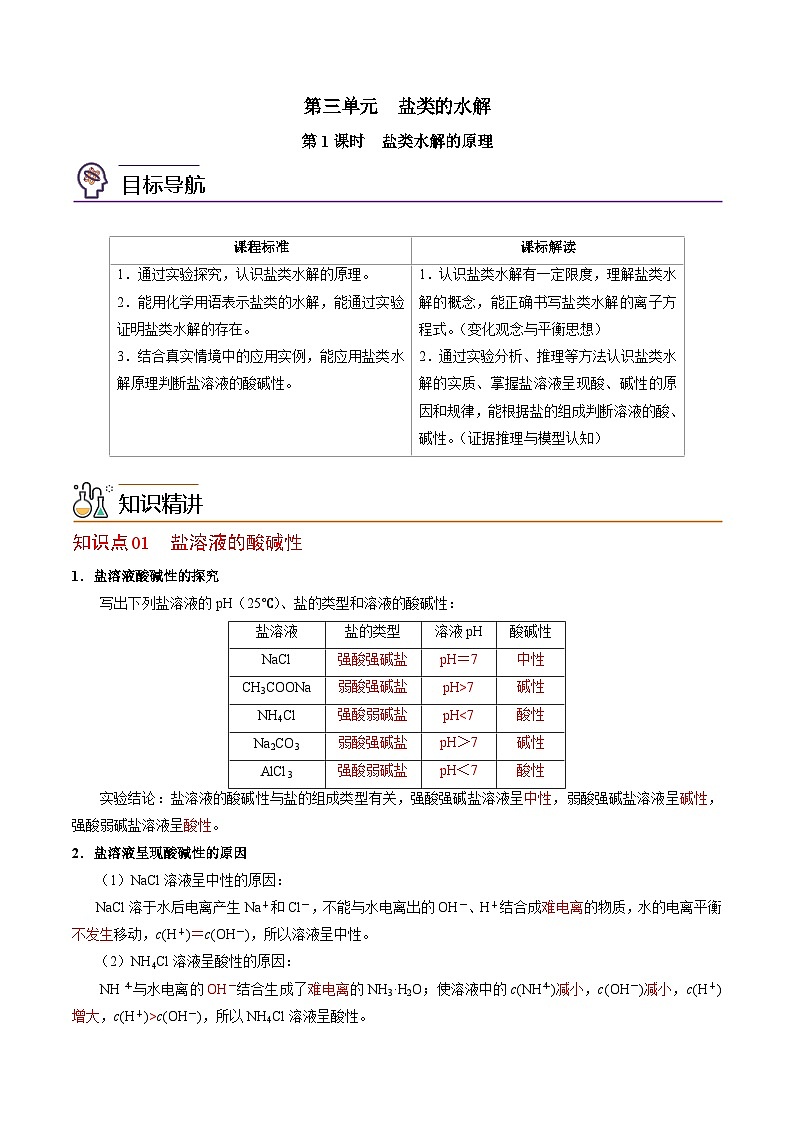
知识点01 盐溶液的酸碱性
1.盐溶液酸碱性的探究
写出下列盐溶液的pH(25℃)、盐的类型和溶液的酸碱性:
盐溶液
盐的类型
溶液pH
酸碱性
NaCl
强酸强碱盐
pH=7
中性
CH3COONa
弱酸强碱盐
pH>7
碱性
NH4Cl
强酸弱碱盐
pH<7
酸性
Na2CO3
弱酸强碱盐
pH>7
碱性
AlCl3
强酸弱碱盐
pH<7
酸性
实验结论:盐溶液的酸碱性与盐的组成类型有关,强酸强碱盐溶液呈中性,弱酸强碱盐溶液呈碱性,强酸弱碱盐溶液呈酸性。
2.盐溶液呈现酸碱性的原因
(1)NaCl溶液呈中性的原因:
NaCl溶于水后电离产生Na+和Cl-,不能与水电离出的OH-、H+结合成难电离的物质,水的电离平衡不发生移动,c(H+)=c(OH-),所以溶液呈中性。
(2)NH4Cl溶液呈酸性的原因:
NH与水电离的OH-结合生成了难电离的NH3·H2O;使溶液中的c(NH)减小,c(OH-)减小,c(H+)增大,c(H+)>c(OH-),所以NH4Cl溶液呈酸性。
离子方程式为:NH+H2ONH3·H2O+H+。
(3)CH3COONa溶液呈碱性的原因:
CH3COO-能与水中的H+结合生成难电离的CH3COOH,从而使水的电离平衡向电离的方向移动,使溶液的c(CH3COO-)减小,c(H+)减小,c(OH-)增大,c(H+)
【即学即练1】下列关于盐溶液呈酸碱性的说法错误的是( )
A.盐溶液呈酸碱性的原因是破坏了水的电离平衡
B.NH4Cl溶液呈酸性是由于溶液中c(H+)>c(OH-)
C.在CH3COONa溶液中,由水电离的c(OH-)≠c(H+)
D.水电离出的H+和OH-与盐中弱离子结合,造成盐溶液呈酸碱性
答案:C
解析:盐溶液呈酸碱性的原因,就是破坏了水的电离平衡,使溶液中c(H+)≠c(OH-),故A对;溶液显酸性则一定有c(H+)>c(OH-),故B对;根据水的电离方程式:H2OH++OH-,水在任何溶液中电离出的c(OH-)=c(H+),但在CH3COONa溶液中,由于生成了弱电解质CH3COOH,使得c(OH-)>c(H+),故显碱性,所以C项说法错误;水电离出的H+和OH-与盐中弱酸阴离子或弱碱阳离子结合生成弱电解质,正是造成盐溶液呈酸碱性的原因,所以D对。
知识点02 盐类水解的原理
1.盐类水解的概念
在水溶液中盐电离产生的阳离子或阴离子跟水电离出来的OH-或H+结合生成弱电解质的反应。
2.盐类水解的实质
在溶液中盐电离出来的弱碱的阳离子或弱酸的阴离子结合水电离出的OH-或H+生成弱电解质,破坏了水的电离平衡,促进了水的电离,使溶液显示不同的酸性、碱性或中性。
3.盐类水解的特点
①与酸碱中和反应互为可逆反应,是吸热反应。
②一般情况下,盐类水解程度极其微弱。
③符合化学平衡移动的原理。
4.盐类水解反应离子方程式的书写
盐类的水解一般程度很小,水解产物也很少,通常不生成沉淀或气体,书写水解方程式时,一般不用“↑”或“↓”。盐类水解是可逆反应,除发生强烈双水解的盐外,一般离子方程式中不写“=”号,而写“”号。
【即学即练2】有下列五种盐溶液:①NaClO、②(NH4)2SO4、③Na2CO3、④AlCl3、⑤KNO3。回答下列问题:
(1)不能破坏水的电离平衡的是_____,溶液呈酸性的是_____,pH>7的是_____。
(2)写出下列盐类水解的离子方程式:
①NaClO:______________________________;
②(NH4)2SO4:______________________________;
③Na2CO3:______________________________、______________________________;
④AlCl3:______________________________。
答案:(1)⑤ ②④ ①③
(2)①ClO-+H2OHClO+OH- ②NH+H2ONH3·H2O+H+
③CO+H2OHCO+OH- HCO+H2OH2CO3+OH-
④Al3++3H2OAl(OH)3+3H+
能力拓展
考法01 盐类水解的原理
1.盐类水解的实质
(1)盐类水解的实质:
盐电离出的离子(弱碱阳离子或者弱酸阴离子)跟水电离出来的OH-或H+结合生成弱碱或弱酸,从而破坏了水的电离平衡,导致溶液中c(OH-)和c(H+)不相等,则溶液表现一定的酸碱性。
(2)盐类水解对水的电离平衡的影响:
弱碱阳离子或者弱酸阴离子在溶液中水解,因此水的电离程度增大,因此水电离出的c(H+)和c(OH-)增大。
弱碱阳离子或者弱酸阴离子在溶液中水解,因此水的电离程度增大,因此水电离出的c(H+)和c(OH-)增大。
如25℃时,pH=4的NH4Cl溶液中,c(H+)=10-4mol·L-1,则水电离出的c(H+)=c(OH-)= 10-4mol·L-1;pH=11的CH3COONa溶液中,c(OH-)=10-3 mol·L-1,则水电离出的c(H+)=c(OH-)= 10-3mol·L-1。
2.盐类水解的特点
(1)可逆反应:盐类水解生成酸和碱,所以盐类的水解反应是酸碱中和反应的逆反应。
(2)吸热反应:盐的水解是吸热过程,温度升高,盐的水解程度增大。
(3)程度微弱:通常情况下,盐水解的程度很小,但对溶液酸碱性的影响较大。
(4)动态平衡:盐类的水解平衡状态属于动态平衡。
3.盐类水解的规律
(1)盐类水解的规律
在可溶性盐溶液中:有弱才水解,无弱不水解,越弱越水解,都弱都水解,谁强显谁性,同强显中性。
(2)常见的弱碱离子:NH、Al3+、Fe3+、Cu2+、Ag+、Zn2+等。
常见的弱酸根离子:CO、HCO、AlO、SO、S2-、HS-、SiO、ClO-、CH3COO-、F-等。
(3)酸式盐溶液酸碱性要看酸式酸根离子的电离和水解程度的相对大小:
只电离不水解(如NaHSO4等)的显酸性;
电离大于水解(如NaHSO3、NaH2PO4等)的显酸性;
水解大于电离(如NaHCO3、NaHS等)的显碱性。
【典例1】NH4Cl溶于重水(D2O)后,产生的一水合氨和水合氢离子均表示正确的是( )
A.NH2D·H2O和D3O+ B.NH3·D2O和HD2O+
C.NH3·HDO和D3O+ D.NH2D·HDO和H2DO+
答案:C
解析:NH4Cl水解的实质是其电离出的NH与重水电离出的OD-结合生成一水合氨的过程。即NH4Cl===NH+Cl-,D2OD++OD-,NH+OD-NH3·HDO,D+再与D2O结合生成D3O+,故C项正确。
考法02 盐类水解离子方程式的书写
1.一般形式:
弱离子+H2O弱电解质+H+(或OH-)
2.方法要求:
一判断:判断弱离子,书写化学式。
二规范:写“”,不标“↑”、“↓”。
三注意:多元弱酸根分步书写,多元弱碱阳离子一步完成。
例如Na2CO3的水解:
第一步:CO32-+H2OHCO3-+OH-。
第二步:HCO3-+H2OH2CO3+OH-。
Fe3+的水解:Fe3++3H2OFe(OH)3+3H+
3.盐的电离方程式和水解方程式的区别
要将盐的电离方程式与盐类水解的离子方程式区别开来。
如HCO3-+H2OCO32-+H3O+是HCO3-的电离方程式,而HCO3-+H2OH2CO3+OH-是HCO3-水解的离子方程式。
【典例2】下列离子方程式中,属于水解反应的是( )
A.HCOOH+H2OHCOO-+H3O+
B.CO2+H2OHCO+H+
C.CO+H2OHCO+OH-
D.HS-+H2OS2-+H3O+
答案:C
解析:A是HCOOH的电离方程式;B项不正确,正确式如下:CO2+H2OH2CO3HCO+H+;C是CO第一步水解反应;D是HS-的电离方程式。
分层提分
题组A 基础过关练
1.下列关于酸性溶液的叙述中正确的是( )
A.可能是盐的水溶液 B.一定是酸的水溶液
C.溶液中c(H+)
解析:强酸弱碱盐的水溶液呈酸性,如NH4Cl溶液、AlCl3溶液等。
2.下列说法正确的是( )
A.盐溶液都是中性的
B.盐溶液的酸碱性与盐的类型无关
C.NaHCO3溶液显酸性
D.Na2CO3溶液显碱性,是因为溶液中c(OH-)>c(H+)
答案:D
解析:B项,盐溶液的酸碱性与盐的类型有关,如Na2CO3溶液呈碱性,NH4Cl溶液呈酸性。
3.下列各式中属于正确的水解反应离子方程式的是( )
A.NH+H2ONH3·H2O+H+
B.S2-+2H2OH2S+2OH-
C.CH3COOH+H2OCH3COO-+H3O+
D.CH3COOH+OH-===CH3COO-+H2O
答案:A
解析:B项,应用分步水解方程式表示或只写第一步;C是电离方程式,不是水解方程式;D是醋酸与可溶性强碱发生中和反应的离子方程式。故选A。
4.下列水解离子方程式正确的是( )
A.Na2CO3:CO+2H2OH2CO3+2OH-
B.NH4Cl:NH+H2ONH3·H2O+OH-
C.NaF:F-+H2O===HF+OH-
D.CuSO4:Cu2++2H2OCu(OH)2+2H+
答案:D
解析:多元强碱弱酸盐水解应分步写,A错;一元强酸弱碱盐水解显酸性,B错;水解一般用“”号,C错;多元弱碱水解应一步完成,D正确。
5.下列物质的水溶液由于水解而呈碱性的是( )
A.NaHSO4 B.Na2SO4 C.NaHCO3 D.NH3
答案:C
解析:A项,NaHSO4是强酸的酸式盐,不发生水解;B项,Na2SO4是强酸强碱盐,不水解;C项是弱酸的酸式盐,水解使溶液呈碱性;D项NH3是非电解质,溶于水后生成弱碱。
6.能使水的电离平衡正向移动,而且所得溶液呈酸性的是( )
A.将水加热到100 ℃时,水的pH=6
B.向水中滴加少量稀H2SO4
C.向水中加入少量NaHCO3
D.向水中加入少量胆矾晶体
答案:D
解析:B使水的电离平衡逆向移动,A、C、D使水的电离平衡正向移动,但A仍为中性,C为碱性,D为酸性。故应选D。
7.下列有关盐类水解的说法不正确的是( )
A.盐类水解过程破坏了纯水的电离平衡
B.盐类水解反应是酸碱中和反应的逆反应
C.盐类水解的结果使溶液不一定呈中性
D.Na2S溶液中c(Na+)是c(S2-)的2倍
答案:D
解析:由于盐电离出的离子与水电离出的H+或OH-结合,从而促进了水的电离,使溶液不一定呈中性;盐类水解与酸碱中和反应互为逆反应;D项中,Na2S溶液中若无S2-水解,则c(Na+)=2c(S2-)成立,由于S2-水解,故c(Na+)>2c(S2-),因此应选D。
8.在盐类水解的过程中,下列说法正确的是( )
A.盐的电离平衡被破坏
B.水的电离程度一定会增大
C.溶液的pH一定会增大
D.c(H+)与c(OH-)的乘积一定会增大
答案:B
解析:大多数的盐为强电解质,在水中完全电离,A项错误;盐类水解促进水的电离,B项正确;强酸弱碱盐水解溶液呈酸性,pH减小,C错;一定温度下的稀溶液中,c(H+)与c(OH-)乘积是一个常数,D错。
9.下列物质的水溶液中,除了水分子外,不存在其他分子的是( )
A.HCl B.NH4NO3 C.Na2S D.HClO
答案:A
解析:A项HCl完全电离;B项NH水解:NH+H2ONH3·H2O+H+,有NH3·H2O分子;C项S2-水解,产生H2S分子;D项HClO是弱电解质,不完全电离,有HClO分子。
10.写出下列盐溶于水后发生水解反应的离子方程式。
(1)CH3COONa__________________________________。
(2)NH4Cl______________________________________。
(3)Na2CO3_____________________________________。
(4)Al2(SO4)3______________________________________。
答案:(1)CH3COO-+H2OCH3COOH+OH-
(2)NH+H2ONH3·H2O+H+
(3)CO+H2OHCO+OH-,HCO+H2OH2CO3+OH-
(4)Al3++3H2OAl(OH)3+3H+
题组B 能力提升练
1.物质的量浓度相同的下列各溶液,由水电离出的c(H+)由大到小的顺序是( )
①NaHSO4 ②NaHCO3 ③Na2CO3 ④Na2SO4
A.④③②① B.①②③④ C.③②④① D.③④②①
答案:C
解析:水中存在的电离平衡:H2OH++OH-,对于能电离出H+或OH-的物质,加入水中使水的电离程度减小,反之对于能结合水中H+或OH-的物质,加入水中则使水的电离程度增大。NaHSO4抑制水的电离,而Na2CO3、NaHCO3均能促进水的电离,且Na2CO3较NaHCO3更大。
2.常温下,在pH=11的某溶液中,由水电离出的c(OH-) 可能为( )
①1.0×10-3 mol·L-1 ②1.0×10-6 mol·L-1 ③1.0×10-7 mol·L-1 ④1.0×10-11mol·L-1
A.①③ B.③ C.④ D.①④
答案:D
解析:常温下,该溶液若为碱的溶液,则水电离出的c(OH-)=1.0×10-11mol·L-1,若为强碱弱酸盐溶液,水电离出的c(OH-)=1.0×10-3 mol·L-1。
3.下列关于盐溶液呈酸碱性的说法错误的是( )
A.盐溶液呈酸碱性的原因是破坏了水的电离平衡
B.NH4Cl溶液呈酸性是由于溶液中c(H+)>c(OH-)
C.在CH3COONa溶液中,由水电离的c(OH-)≠c(H+)
D.水电离出的H+和OH-与盐中弱离子结合,造成盐溶液呈酸碱性
答案:C
解析:盐溶液呈酸碱性的原因,就是破坏了水的电离平衡,使溶液中c(H+)≠c(OH-),故A对;溶液显酸性则一定有c(H+)>c(OH-),故B对;根据水的电离方程式:H2OH++OH-,水在任何溶液中电离出的c(OH-)=c(H+),但在CH3COONa溶液中,由于生成了弱电解质CH3COOH,使得c(OH-)>c(H+),故显碱性,所以C项说法错误;水电离出的H+和OH-与盐中弱酸阴离子或弱碱阳离子结合生成弱电解质,正是造成盐溶液呈酸碱性的原因,所以D对。
4.物质的量浓度相同的下列溶液中,含粒子种类最多的是( )
A.CaCl2 B.CH3COONa C.NH3 D.K2S
答案:D
解析:CaCl2不水解,溶液中存在的粒子有Ca2+、Cl-、OH-、H+、H2O 5种;CH3COONa发生水解,溶液中存在Na+、CH3COO-、CH3COOH、H+、OH-、H2O 6种粒子;氨水中存在NH3、NH3·H2O、NH、OH-、H+、H2O 6种粒子;K2S中S2-发生两步水解,溶液中存在K+、S2-、HS-、H2S、OH-、H+、H2O 7种粒子。
5.(1)常温下,0.10 mol·L-1 NH4Cl溶液pH______7(填“>”、“=”或“<”)。
(2)NaHCO3溶液呈碱性的原因是____________________________________________________(用文字说明并写出有关的离子方程式)。
(3)相同物质的量浓度的Na2S溶液与NaHS溶液,pH大小:Na2S________NaHS(填“>”、“=”或“<”),两种溶液中粒子种类:Na2S________NaHS(填“>”、“=”或“<”)。
答案:(1)< (2)> =
解析:(1)NH发生水解反应NH+H2ONH3·H2O+H+,使溶液显酸性,溶液pH<7。
(2)NaHCO3电离出的HCO水解:HCO+H2OH2CO3+OH-,而使溶液呈碱性
(3)S2-分两步水解,HS-只有一步水解,且水解程度S2->HS-,因此等浓度时溶液pH:Na2S>NaHS;Na2S溶液:Na2S===2Na++S2-、S2-+H2OHS-+OH-、HS-+H2OH2S+H+、H2OH++OH-,故溶液中存在七种粒子:Na+、S2-、HS-、H2S、H2O、H+、OH-。
NaHS溶液中:NaHS===Na++HS-、HS-+H2OH2S+OH-、HS-H++S2-、H2OH++OH-,故溶液中含有:Na+、HS-、H2O、H2S、OH-、S2-、H+七种粒子。
(3)NaHCO3溶于水时发生电离:NaHCO3===Na++HCO,电离出的HCO水解:HCO+H2OH2CO3+OH-,而使溶液中c(OH-)>c(H+),显碱性。
题组C 培优拔尖练
1.NH4Cl溶液的pH和稀HCl的pH均为5,其中由水电离出的c(H+)分别为x mol·L-1和y mol·L-1,则x与y的比值正确的是( )
A.1 B.10 C.104 D.10-4
答案:C
解析:NH4Cl的pH=5,c(H+)水=10-5 mol·L-1,盐酸的pH=5,c(H+)水=c(OH-)水=10-9 mol·L-1,则x∶y=10-5∶10-9=104∶1。
2.广义的水解观认为,无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质。根据上述观点下列说法不正确的是( )
A.CaO2的水解产物是Ca(OH)2和H2O2
B.NaClO的水解产物之一是HClO
C.PCl3的水解产物是PH3和HClO
D.Mg3N2水解生成NH3和Mg(OH)2
答案:C
解析:PCl3的水解产物是H3PO4和HCl。
3.有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液、盐酸和Na2SO4溶液中的一种。
(1)已知A、B的溶液中水的电离程度相同,A、C溶液的pH相同。A是________溶液,B是________溶液,C是________溶液。
(2)若B溶液中c(OH-)与C溶液中的c(H+)相同,现将B的溶液稀释10倍后溶液的pH用pHB表示,C溶液的pH用pHC表示,则pHB+pHC________(填大于或等于某个数)。
答案:(1)NH4Cl CH3COONa 盐酸 (2)>13
解析:(1)由于CH3COONa、NH4Cl对水的电离起促进作用,且CH3COONa溶液的pH>7、NH4Cl溶液的pH<7;盐酸对水的电离起抑制作用,且盐酸的pH<7;Na2SO4对水的电离无影响,且Na2SO4溶液的pH=7。综合分析,满足题目要求时,A为NH4Cl溶液、B为CH3COONa溶液、C为盐酸、D为Na2SO4溶液。
(2)设B溶液中c(OH-)与C溶液中的c(H+)均为10-amol·L-1,则pHC=-lg10-a=a。
由于将B溶液稀释10倍(假设水解平衡不移动),则稀释后的c(OH-)=10-amol·L-1×=10-a-1mol·L-1;而稀释过程中水解平衡右移,导致稀释后的c(OH-)>10-a-1mol·L-1,则c(H+)=<=10a-13 mol·L-1,所以pHB>-lg10a-13=13-a。
故pHB+pHC>(13-a)+a=13。
4.某盐或“类盐”的化学式为XmYn最简结构,将一定量的该盐溶于足量的水时:
(1)若m≠n,测得溶液的pH为5,则该盐与水反应的离子方程式可能为_____________________________。
(2)若m≠n,测得该盐溶液的pH为9,则该盐与水反应的离子方程式可能主要为______________________。
答案:(1)Xn++nH2OX(OH)n+nH+
(2)Ym-+H2OHY(m-1)-+OH-
解析:盐在水中能完全电离:XmYn=== mXn++nYm-。
(1)溶液的pH=5,说明该盐为强酸弱碱盐,因此发生水解:Xn++nH2OX(OH)n+nH+。
(2)溶液的pH=9,说明该盐为强碱弱酸盐,因此发生水解:Ym-+H2OHY(m-1)-+OH-。
化学选择性必修1第三单元 盐类的水解同步测试题: 这是一份化学选择性必修1第三单元 盐类的水解同步测试题,共17页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
高中化学盐类水解优秀同步达标检测题: 这是一份高中化学盐类水解优秀同步达标检测题,文件包含332盐类水解沪科版2020选择性必修第一册学生版docx、332盐类水解沪科版2020选择性必修第一册教师版docx等2份试卷配套教学资源,其中试卷共61页, 欢迎下载使用。
【同步讲义】高中化学(鲁科版2019)选修第一册--第18讲 盐类水解的应用 讲义: 这是一份【同步讲义】高中化学(鲁科版2019)选修第一册--第18讲 盐类水解的应用 讲义,文件包含同步讲义高中化学鲁科版2019选修第一册--第18讲盐类水解的应用学生版docx、同步讲义高中化学鲁科版2019选修第一册--第18讲盐类水解的应用教师版docx等2份试卷配套教学资源,其中试卷共15页, 欢迎下载使用。













