2024届高三新高考化学大一轮专题练习 电解池
展开2024届高三新高考化学大一轮专题练习-电解池
一、单选题
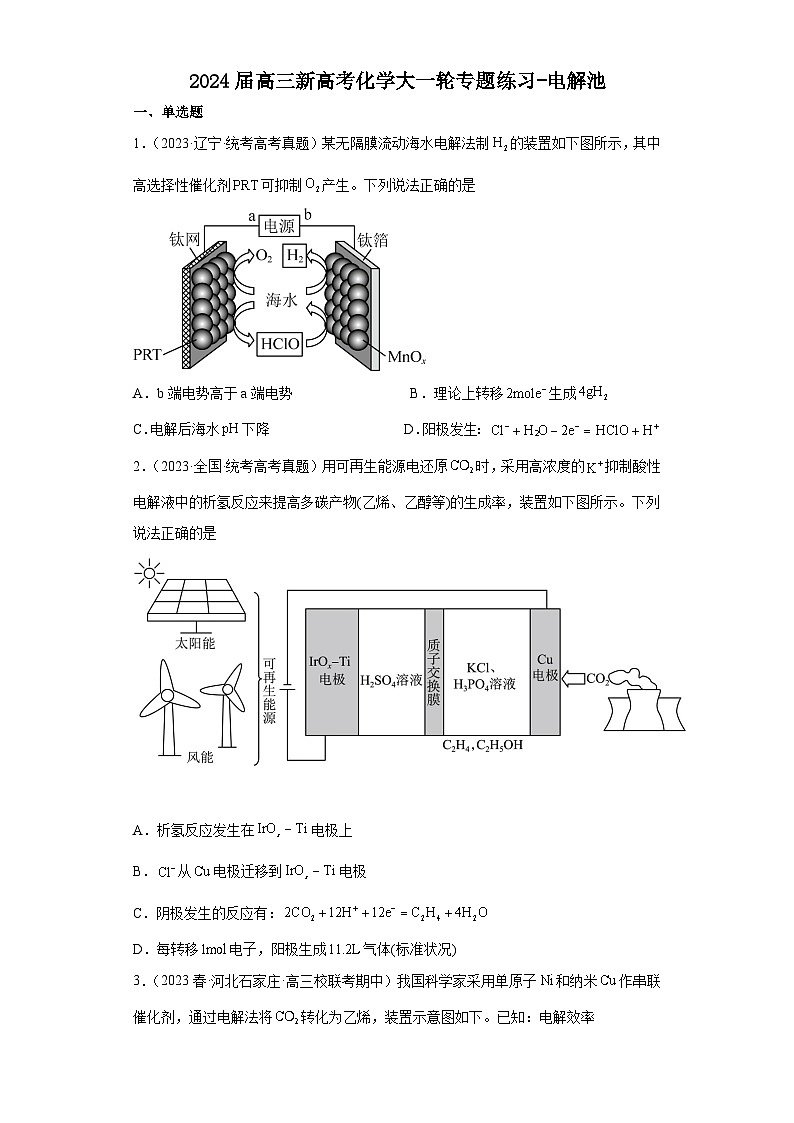
1.(2023·辽宁·统考高考真题)某无隔膜流动海水电解法制的装置如下图所示,其中高选择性催化剂可抑制产生。下列说法正确的是
A.b端电势高于a端电势 B.理论上转移生成
C.电解后海水下降 D.阳极发生:
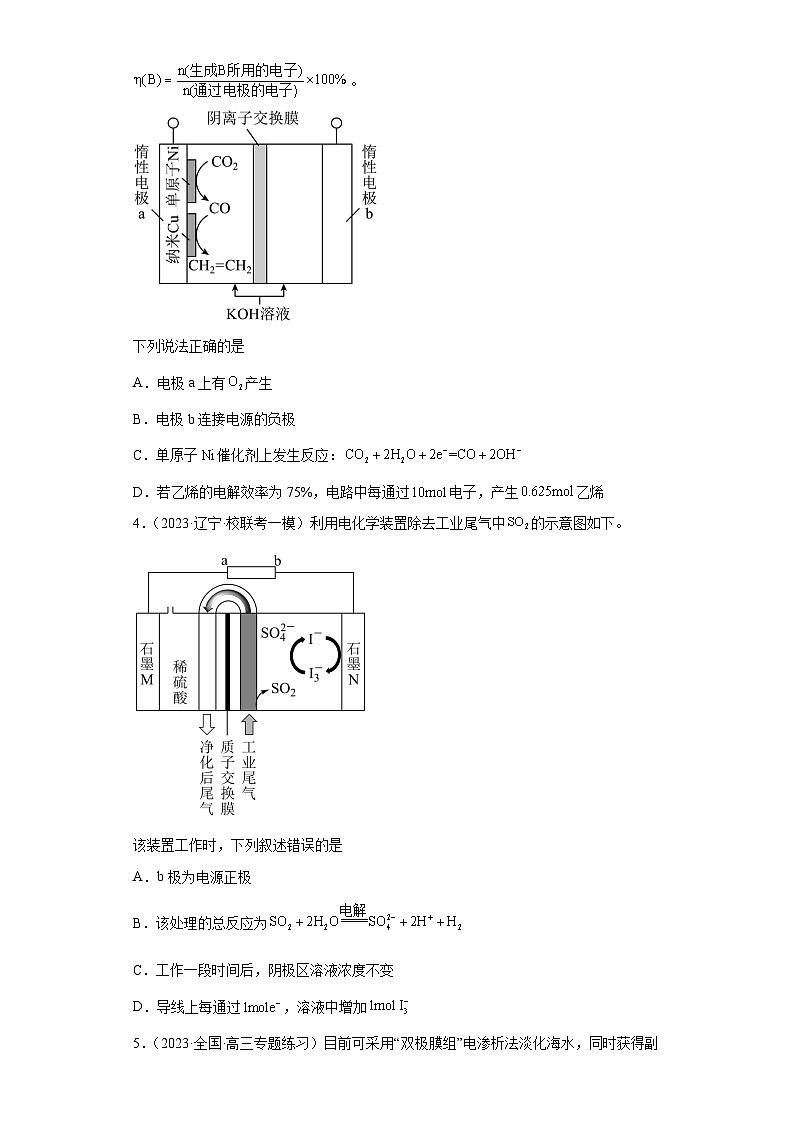
2.(2023·全国·统考高考真题)用可再生能源电还原时,采用高浓度的抑制酸性电解液中的析氢反应来提高多碳产物(乙烯、乙醇等)的生成率,装置如下图所示。下列说法正确的是
A.析氢反应发生在电极上
B.从电极迁移到电极
C.阴极发生的反应有:
D.每转移电子,阳极生成气体(标准状况)
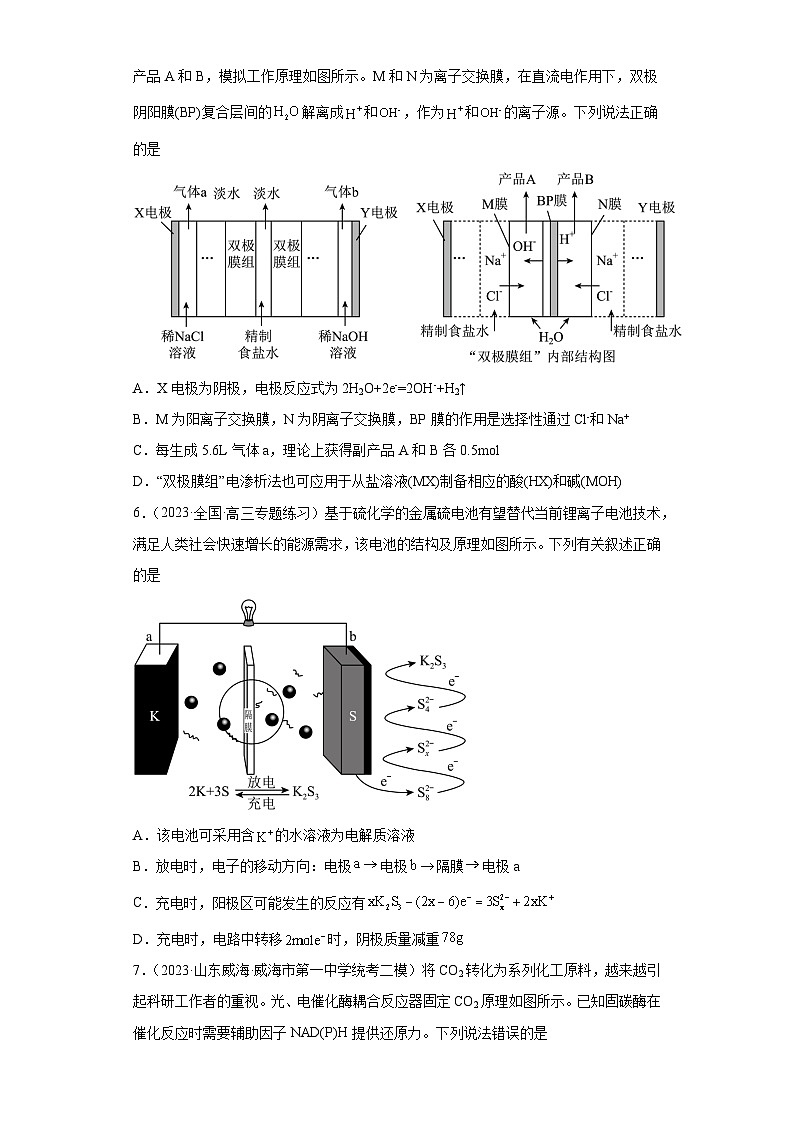
3.(2023春·河北石家庄·高三校联考期中)我国科学家采用单原子和纳米作串联催化剂,通过电解法将转化为乙烯,装置示意图如下。已知:电解效率。
下列说法正确的是
A.电极a上有产生
B.电极b连接电源的负极
C.单原子催化剂上发生反应:
D.若乙烯的电解效率为75%,电路中每通过电子,产生乙烯
4.(2023·辽宁·校联考一模)利用电化学装置除去工业尾气中的示意图如下。
该装置工作时,下列叙述错误的是
A.b极为电源正极
B.该处理的总反应为
C.工作一段时间后,阴极区溶液浓度不变
D.导线上每通过,溶液中增加
5.(2023·全国·高三专题练习)目前可采用“双极膜组”电渗析法淡化海水,同时获得副产品A和B,模拟工作原理如图所示。M和N为离子交换膜,在直流电作用下,双极阴阳膜(BP)复合层间的解离成和,作为和的离子源。下列说法正确的是
A.X电极为阴极,电极反应式为2H2O+2e-=2OH-+H2↑
B.M为阳离子交换膜,N为阴离子交换膜,BP膜的作用是选择性通过Cl-和Na+
C.每生成5.6L气体a,理论上获得副产品A和B各0.5mol
D.“双极膜组”电渗析法也可应用于从盐溶液(MX)制备相应的酸(HX)和碱(MOH)
6.(2023·全国·高三专题练习)基于硫化学的金属硫电池有望替代当前锂离子电池技术,满足人类社会快速增长的能源需求,该电池的结构及原理如图所示。下列有关叙述正确的是
A.该电池可采用含的水溶液为电解质溶液
B.放电时,电子的移动方向:电极电极隔膜电极a
C.充电时,阳极区可能发生的反应有
D.充电时,电路中转移时,阴极质量减重
7.(2023·山东威海·威海市第一中学统考二模)将CO2转化为系列化工原料,越来越引起科研工作者的重视。光、电催化酶耦合反应器固定CO2原理如图所示。已知固碳酶在催化反应时需要辅助因子NAD(P)H提供还原力。下列说法错误的是
A.装置工作时,由光能、电能转化为化学能
B.转化生成1mol 得到6mol
C.当有2mol 通过交换膜进入阴极室,一定生成1mol HCOOH
D.在电解液中添加并给反应器施加电压,有利于转换为NAD(P)H
8.(2023·安徽马鞍山·统考一模)微生物燃料电池(MFC)可以用于光电催化处理污染物(苯酚)的电源,工作原理如图所示。下列说法不正确的是
A.电极a为阳极
B.电极c上的反应式为: CH3OH-6e-+H2O=6H++CO2↑
C.右池中的H+向d电极方向迁移
D.处理污染物苯酚lmol,理论上外电路中迁移了20mol 电子
9.(2023春·河南安阳·高三安阳市第二中学校考阶段练习)化学电池已成为人类生产生活的重要能量来源之一,化学电池是根据原电池原理制成的。根据如图装置,下列说法正确的是
A.若X为Zn,Y为溶液,则溶液中的向X电极移动
B.若X为Fe,Y为稀硫酸,则铜电极上的电极反应式为
C.若X为A1,Y为浓硝酸,则铝电极上的电极反应式为
D.若X为Zn,Y为溶液,当电路中转移0.2mol电子时,电解质溶液增加0.1g
10.(2023春·四川成都·高三校联考期中)高电压水系锌-有机混合液流电池的装置如图所示。下列说法错误的是
A.放电时,Cl-通过阴膜向正极区迁移
B.放电时,负极区溶液的pH减小
C.充电时,Zn与外接直流电源负极相连
D.充电时,阳极电极反应式为FQH2-2e-=FQ+2H+
11.(2023春·浙江温州·高三校联考期中)如图所示,甲池的总反应式为:,下列关于该电池工作时的说法正确的是
A.甲池中负极反应为:
B.该装置工作时,Ag电极上有气体生成
C.甲池和乙池中的溶液的pH前者不变,后者减小
D.当甲池中消耗0.1mol时,乙池中理论上最多产生12.8g固体
12.(2023·河北衡水·校联考二模)双极膜可用于电渗析生产酸碱、争水、电池等。下列有关描述不合理的是
A.外加电场作用于双极膜,使水的电离度增大
B.电渗析装置实现了由溶液制取和
C.双极膜电池中极上发生的电极反应为
D.双极膜电池中的双极膜的左侧为阳膜,右侧为阴膜
13.(2023春·山东济宁·高三统考期中)原电池原理在污染处理方面有重要应用。微生物脱盐池的a极上加入了呼吸细菌,工作时可将工业废水中的有机污染物转化为CO2,其工作原理如图所示。下列说法正确的是
A.工作时,a极发生氧化反应
B.工作时,电流从a极流向b极
C.M为阳离子交换膜,N为阴离子交换膜,脱盐室最终可得到淡盐水
D.若b极上消耗标准状况下11.2L气体,通过N膜的离子的物质的量为2mol
二、多选题
14.(2023春·海南海口·高三海南中学校考期中)新型镁-锂双离子二次电池的工作原理如图。下列关于该电池的说法正确的是
A.放电时,Li+通过离子交换膜向右移动
B.放电时,Li1-yFePO4/LiFePO4一极电极反应式为Li1-yFePO4+yLi+-ye-=LiFePO4
C.充电时,与电源的正极相连
D.充电时,导线上每通过0.4mole-,左室中溶液的质量减少2g
三、非选择题
15.(2023秋·云南丽江·高三统考期末)回答下列问题:
(1)锌-空气电池是金属空气电池的一种,电解质溶液为KOH溶液,工作示意图如图1所示。
Zn电极作______极,写出通入空气一极的电极反应式:______。
(2)氯碱工业中电解饱和食盐水的原理示意图如图2所示:
①a口产生的气体是______,c口获得的产品是______,当d口产生标况下2.24L气体时,电路中转移电子的物质的量为______。
②写出电解饱和食盐水的离子方程式______。
(3)钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。鉴于腐蚀问题的严重性,国内外对防腐工作都很重视,采取各种措施来减轻腐蚀的危害,图3是金属防护的两个例子。
①为了降低某水库的铁闸门被腐蚀的速率,可以采用图3甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用______(填字母)。
A.铜 B.石墨 C.锌
②图3乙方案也可以降低铁闸门腐蚀的速率,其中铁闸门应该连接在直流电源的______(填“正”或“负”)极,该金属防护的方法叫做______。
16.(2023春·四川成都·高三四川省成都市新都一中校联考期中)电化学原理在工农业生产中有重要应用。已知N2H4是一种重要的清洁高能燃料,根据如图所示装置回答下列问题(C1~C6均为石墨电极,假设各装置在工作过程中溶液体积不变):
(1)甲装置C2电极为___________极(填“正”“负”“阳”或“阴”),C1电极上的电极反应式为___________。
(2)乙装置___________(填“是”或“不是”)电镀池,若乙装置中溶液体积为400 mL,开始时溶液pH为6,当电极上通过0.04 mol电子时,溶液pH约为___________。
(3)丙装置用于处理含高浓度硫酸钠的废水,同时获得硫酸、烧碱及氢气,膜X为___________交换膜(填“阳离子”“阴离子”或“质子”),当电极上通过0.04 mol电子时,中间硫酸钠废水的质量改变___________ g(假定水分子不能通过膜X和膜Y)。
(4)电解一段时间后,丁装置的电解质溶液中能观察到的现象是___________,丁装置中电解反应的总化学方程式为___________。
17.(2023秋·江苏泰州·高三校联考期末)将CO2还原为HCOOH是实现“碳中和”的有效途径。
(1)利用反应CO2(g)+H2(g)⇌HCOOH(g);ΔH =+14.9 kJ·mol-1不能实现CO2直接加氢合成HCOOH,原因是___________。
(2)CO2通过电解法转化为HCOO-的反应机理如图1。Pt电极上覆盖的Nafion膜是一种阳离子交换膜,对浓度不高的HCOO-有较好的阻拦作用,可让H2O自由通过。
① Sn电极上生成HCOO-的电极反应式为___________。
② 电路中通过的电量与HCOO-产率的关系如图2所示。相同条件下,Pt电极有Nafion膜HCOO-产率明显提高,但电量>1000C后又显著下降,可能原因是___________。
③ 若电解时将Nafion膜置于两个电极中间,保持电流恒定,20 h时向阳极区补充KHCO3,电压与时间关系如图3所示。0~20 h,电压增大的原因是___________。
(3)CO2电还原可能的反应机理如下图所示。Sn、In、Bi的活性位点对O的连接能力较强,Au、Cu的活性位点对C的连接能力较强,Cu对CO的吸附能力远大于Au,且Cu吸附CO后不易脱离。
若还原产物主要为CH4时,应选择___________(填“Sn”“Au”或“Cu”)作催化剂,简述分析过程:___________。
18.(2023秋·甘肃天水·高三天水市第一中学校考期末)乙醇是一种比较理想的可用于燃料电池的有机物。乙醇来源丰富,可以通过含糖有机物的发酵进行大规模的生产。如图是以乙醇燃料电池为电源,电解含的废气制备示意图(c、d均为石墨电极)。
(1)请判断该装置的电极名称:a__________、c__________。
(2)甲池中a极上的电极反应式为:__________,乙池中c极上的电极反应式:__________。
(3)甲池中向______极迁移,乙池中向______极迁移(用a、b、c、d表示)。
(4)假设电解前,乙池两侧溶液体积均为,左侧溶液中为。电解结束后,左侧溶液中变为,若忽略溶液体积变化,则处理的体积为______mL(标准状况);乙池右侧溶液与电解前相比__________(填“增大”、“减小”、“不变”)。
参考答案:
1.D
【分析】由图可知,左侧电极产生氧气,则左侧电极为阳极,电极a为正极,右侧电极为阴极,b电极为负极,该装置的总反应产生氧气和氢气,相当于电解水,以此解题。
【详解】A.由分析可知,a为正极,b电极为负极,则a端电势高于b端电势,A错误;
B.右侧电极上产生氢气的电极方程式为:2H++2e-=H2↑,则理论上转移生成,B错误;
C.由图可知,该装置的总反应为电解海水的装置,随着电解的进行,海水的浓度增大,但是其pH基本不变,C错误;
D.由图可知,阳极上的电极反应为:,D正确;
故选D。
2.C
【分析】由图可知,该装置为电解池,与直流电源正极相连的IrOx-Ti电极为电解池的阳极,水在阳极失去电子发生氧化反应生成氧气和氢离子,电极反应式为2H2O-4e—=O2↑+4H+,铜电极为阴极,酸性条件下二氧化碳在阴极得到电子发生还原反应生成乙烯、乙醇等,电极反应式为2CO2+12H++12e−=C2H4+4H2O、2CO2+12H++12e−=C2H5OH+3H2O,电解池工作时,氢离子通过质子交换膜由阳极室进入阴极室。
【详解】A.析氢反应为还原反应,应在阴极发生,即在铜电极上发生,故A错误;
B.离子交换膜为质子交换膜,只允许氢离子通过,Cl-不能通过,故B错误;
C.由分析可知,铜电极为阴极,酸性条件下二氧化碳在阴极得到电子发生还原反应生成乙烯、乙醇等,电极反应式有2CO2+12H++12e−=C2H4+4H2O,故C正确;
D.水在阳极失去电子发生氧化反应生成氧气和氢离子,电极反应式为2H2O-4e—=O2↑+4H+,每转移1mol电子,生成0.25molO2,在标况下体积为5.6L,故D错误;
答案选C。
3.D
【分析】电极a上二氧化碳得电子生成或得电子产生乙烯,a为阴极,b为阳极;
【详解】A.电极a上二氧化碳得电子生成或得电子产生乙烯,没有氧气产生,A项错误;
B.电极b为阳极,与电源正极相连,B项错误;
C.由图可知,单原子催化剂上发生反应:,C项错误;
D.若乙烯的电解效率为75%,电路中通过电子时,根据公式得n(生成乙烯所用的电子),由转化为乙烯的电极反应为,所以当n(生成乙烯所用的电子)时,产生的乙烯为,D项正确;
故选:D。
4.D
【详解】A.石墨N上I-发生氧化反应,为阳极,则b极为电源正极,A项正确;
B.该处理过程中I-起到催化作用,总反应为,B项正确;
C.阴极区发生,工作一段时间后,阴极区消耗的与从阳极区迁移过来的数量相同,阴极区溶液浓度不变,C项正确;
D.阳极上发生,导线上每通过,理论上溶液中生成,同时会和SO2反应被消耗,D项错误。
答案选D。
5.D
【分析】由BP双极膜中H+、OH-移动方向可知:X电极为电解池的阳极,电极反应式为:2+2e-=Cl2,Y电极为阴极,电极反应式为:2H++2e-=H2,电解总反应为:,精制食盐水中钠离子经过M离子交换膜移向产品A室,与BP双极膜中转移过来的氢氧根结合生成氢氧化钠,所以M膜为阳离子交换膜,盐室中氯离子经过N离子交换膜移向产品B室,与BP双极膜中转移过来的氢离子结合生成氯化氢,所以N为阴离子交换膜。
【详解】A.由图中氢氧根移动方向可知X电极为阳极,电极反应式为:2+2e-=Cl2,A错误;
B.由题意可知,精制食盐水中钠离子经过M离子交换膜移向产品A室,与BP双极膜中转移过来的氢氧根结合生成氢氧化钠,所以M膜为阳离子交换膜,盐室中氯离子经过N离子交换膜移向产品B室,与BP双极膜中转移过来的氢离子结合生成氯化氢,所以N为阴离子交换膜,BP双极膜的作用是选择性通过氢离子和氢氧根离子,B错误;
C.阳极反应式为:2+2e-=Cl2,电路中每生成标况下5.6L气体氯气,其物质的量为0.25mol,转移电子0.5mol,理论上获得副产品A(氢氧化钠溶液)和B(氯化氢溶液)各0.5mol,需标明标准状况,C错误;
D.“双极膜组”电渗析法从氯化钠溶液中获得酸(HCl)和碱(NaOH),由此可知:也可从M溶液制备相应的酸(HX)和碱(MOH),D正确;
故选D。
6.C
【详解】A.K性质活泼,会和水反应,不可采用含K+的水溶液作为电解质溶液,A项错误;
B.电子不经过电解质溶液,B项错误;
C.充电时,b极为阳极,可能发生,C项正确;
D.充电时,a极为阴极,发生K++e-=K,电路中转移时,阴极质量增加,D项错误。
答案选C。
7.C
【分析】由题干原理图示信息可知,阳极(即与电源正极相连的电极)上发生氧化反应,电极反应式为:2H2O-4e-=4H++O2↑,H+通过质子交换膜移向阴极室,阴极电极反应为:NAD(P)+H++e-=NAD(P)H,CO2+2NAD(P)H=2NAD(P)+HCOOH或者CO2+6NAD(P)H=CH3OH+H2O+6NAD(P),光能捕获与电子激发器中吸收太阳能,激发失去电子,从而也发生NAD(P)+H++e-=NAD(P)H,据此分析解题。
【详解】A.由分析可知,装置工作时,由光能、电能转化为HCOOH、CH3OH、NAD(P)、NAD(P)H中的化学能,A正确;
B.根据电子守恒可知,CO2转化生成1mol CH3OH得到6mol e-,B正确;
C.由分析可知,阴极室发生的反应有:NAD(P)+H++e-=NAD(P)H,CO2+2NAD(P)H=2NAD(P)+HCOOH或者CO2+6NAD(P)H=CH3OH+H2O+6NAD(P),且光能捕获与电子激发器中吸收太阳能,激发失去电子,从而也发生NAD(P)+H++e-=NAD(P)H,故当有2mol通过交换膜进入阴极室,不一定生成1mol HCOOH,C错误;
D.在电解液中添加可以增强电解质溶液的导电性,并给反应器施加电压,可加快反应速率,故有利于转换为NAD(P)H,D正确;
故答案为:C。
8.D
【分析】右池中为甲醇燃料电池,通入甲醇的一极为负极,即c为负极,d为正极。左池为电解池,与原电池正极相连的a为阳极,b为阴极。
【详解】A.由上分析,a为电解池的阳极,A项正确;
B.c极为负极甲醇发生氧化变为CO2,反应为 CH3OH-6e-+H2O=6H++CO2↑,B项正确;
C.根据分析,右池为原电池,离子的移动:阳离子移向正极,阴离子移向负极。H+移向d极,C项正确;
D.利用电子守恒有C6H6O~6CO2~28e-,即1mol苯酚转移28mol电子,D项错误;
故选D。
9.D
【详解】A.若X为Zn,金属性锌强于铜,锌是负极,Y为溶液,则溶液中的向正极即铜电极移动,A错误;
B.若X为Fe,Y为稀硫酸,金属性铁强于铜,铁是负极,铜是正极,则铜电极上的电极反应式为,B错误;
C.若X为Al,Y为浓硝酸,常温下铝遇浓硝酸钝化,故铝是正极,铜是负极,则铝电极上的电极反应式为NO+e-+2H+=NO2↑+H2O,C错误;
D.若X为Zn,Y为溶液,金属性锌强于铜,锌是负极,当电路中转移0.2mol电子时,溶解0.1mol锌,析出0.1mol铜,所以电解质溶液增加6.5g-6.4g=0.1g,D正确;
故选D。
10.A
【详解】A.原电池中阴离子向负极移动,故放电时,Cl-不会向正极区迁移,A错误;
B.放电时,负极区锌失去电子发生氧化反应,,溶液氢氧根离子浓度减小,pH减小,B正确;
C.充电时,Zn做阴极,与外接直流电源负极相连,C正确;
D.充电时,阳极的FQH2失去电子反应氧化反应,电极反应式为FQH2-2e-=FQ+2H+,D正确;
故选A。
11.D
【分析】甲池能自发的发生氧化还原反应而作原电池,通入肼的电极为负极,通入氧气的电极为正极,负极反应为N2H4-4e-+4OH-=N2+4H2O,正极反应为O2+4e-+2H2O=4OH-,乙池为电解池,阴极Ag反应为Cu2++2e-=Cu、阳极石墨反应为4OH-- 4e- = 2H2O +O2↑;
【详解】A.通入肼的电极为负极,负极反应为N2H4-4e-+4OH-=N2+4H2O,选项A错误;
B.乙池为电解池,阴极Ag反应为Cu2+ + 2e- = Cu,没有气体生成,选项B错误;
C.甲池中反应生成水,氢氧化钾的浓度减小,pH减小,乙池中电解生成硫酸,溶液的pH减小,选项C错误;
D.甲池N2H4-4e-+4OH-=N2+4H2O,消耗0.1mol N2H4时,转移0.4mol电子,乙池Cu2+ + 2e- = Cu,产生0.2mol铜,为12.8g固体,选项D正确;
答案选 D。
12.D
【详解】A.外加电场作用于双极膜时,水分别在电极两端产生氢离子及氢氧根离子,故而水的电离度增大,A正确;
B.双极膜的作用是选择性的让阴阳离子通过,如图,电渗析装置中氢离子及氢氧根离子分别向阴极及阳极移动,其他离子不能通过,故可抽取和MOH,B正确;
C.依题意,双极膜电池中极可由CO2转化为HCOOH:,C正确;
D.由C知,右侧电极发生还原反应,Y极是正极,根据阳离子流向正极可知双极膜中右侧为阳膜,D错误。
故答案为:D。
13.A
【分析】a极有机污染物转化为二氧化碳,失去电子为负极,b极为正极,因此工作时,a极发生氧化反应,电流从b极流向a极,据此分析解题。
【详解】A.a极有机污染物转化为二氧化碳,失去电子为负极,发生氧化反应,故A正确;
B.a极为负极,b极为正极,因此工作时,电流从b极流向a极,故B错误;
C.阴离子向a极迁移,阳离子向b极迁移,因此N为阳离子交换膜,M为阴离子交换膜,故C错误;;
D.若b极上消耗标准状况下11.2LO2,则外电路中通过2mole−,此时通过阳离子交换膜的电荷数为2mol,经过N膜的离子为Na+和Ca2+,其所带电荷数不同,故此离子数目无法确定,故D错误;
故答案选A。
14.AD
【分析】从图中可以看出,Mg电极上,Mg-2e-=Mg2+,则Mg为负极,Li1-yFePO4为正极。
【详解】A.放电时,阳离子向正极移动,则Li+通过离子交换膜向右移动,A正确;
B.放电时,Li1-yFePO4/LiFePO4一极为正极,Li1-yFePO4得电子与Li+反应生成LiFePO4,电极反应式为Li1-yFePO4+yLi++ye-=LiFePO4,B错误;
C.放电时,Mg极为负极,则充电时,Mg极为阴极,与电源的负极相连,C错误;
D.充电时,Mg极为阴极发生反应:Mg2++2e-=Mg,导线上每通过0.4mole-,左室溶液中放电的Mg2+为0.2mol,质量为4.8g,同时阳极有0.4molLi+移入左室溶液中,Li+质量为0.4mol×7g/mol=2.8g,则左室中溶液的质量减少4.8g-2.8g=2g,D正确;
故选AD。
15.(1) 负 O2+2H2O+4e-=4OH-
(2) Cl2 NaOH 0.2mol 2Cl-+2H2O2OH-+H2↑+Cl2↑
(3) C 负 外加电流法
【详解】(1)锌易失电子发生氧化反应,Zn电极作负极,氧气易得电子发生还原反应,通入空气一极是正极,正极氧气得电子生成氢氧根离子,电极反应式O2+2H2O+4e-=4OH-;
(2)①左侧电极为阳极,阳极氯离子失电子生成氯气,a口产生的气体是Cl2;右侧是阴极,阴极反应式为,所以c口获得的产品是NaOH,d口放出氢气, 当d口产生标况下2.24L气体时,电路中转移电子的物质的量为0.2mol。
②电解饱和食盐水生成氢气、氯气、氢氧化钠,反应的离子方程式为2Cl-+2H2O2OH-+H2↑+Cl2↑。
(3)①图3甲所示的方案为牺牲阳极法,其中焊接在铁闸门上的固体材料R的活泼性大于铁,故选C。
②图3乙方案为外加电流阴极保护法,其中铁闸门应该连接在直流电源的负极。
16.(1) 正 N2H4 - 4e− + 4OH− = N2↑ + 4H2O
(2) 不是 1
(3) 阴离子 2.84
(4) 有白色沉淀生成(若多答“沉淀变色及产生气泡”、“铁电极溶解”也可) Fe + 2H2OFe(OH)2 + H2↑
【详解】(1)由图可知,装置甲为燃料电池,通入N2H4的一极(Cl)为负极,负极的电极反应式为:N2H4 - 4e− + 4OH− = N2↑ + 4H2O,通入氧气的一极(C2)为正极,乙、丙、丁为电解槽。
(2)乙装置中阳极材料和电解质溶液中阳离子不同,故不是电镀池,C3电极为阳极,阳极上4OH− - 4e− = 2H2O + O2↑,当电路中通过0.04 mol e−时有0.04 mol OH−放电,同时产生0.04 mol H+,此时c(H+) == 0.1 mol·L−1,pH = 1。
(3)丙装置中C4电极为阳极,阳极上4OH− - 4e− = 2H2O + O2↑,同时产生H+,正电荷增多,故中间室的硫酸根离子通过阴离子交换膜进入阳极室形成硫酸,C5电极为阴极,在阴极上H+放电产生氢气,同时产生OH−,阴极室负电荷增多,中间室的Na+通过阳离子交换膜进入阴极室形成NaOH,当通过0.04 mol e−时,阳极室产生0.04 mol H+,有0.02 mol SO进入阳极室,阴极室产生0.04 mol OH−,也就有0.04mol Na+进入阴极室,故中间室减少的质量 = 0.02 × 96g/mol + 0.04 × 23g/mol = 2.84 g。
(4)丁装置中Fe电极为阳极,电极反应为Fe - 2e− = Fe2+,C6电极为阴极,电极反应为2H2O + 2e− = H2 + 2OH−,产生OH−,故Fe2+ + 2OH− = Fe(OH)2↓,故电解池中有白色沉淀生成(若多答“沉淀变色及产生气泡”、“铁电极溶解”也可),电解的化学方程式为Fe + 2H2OFe(OH)2 + H2↑。
17.(1)该反应的ΔH>0、ΔS<0,不能自发自行
(2) H++CO2+2e-=HCOO-/HCO+CO2+2e-=HCOO-+CO Nafion膜可以阻止HCOO-在阳极放电(1分,答“防止HCOO-在阳极被氧化”给分);电量>1 000 ℃后,c(HCOO-)增大,Nafion膜阻拦作用下降 阳极区pH减小,HCO浓度下降,K+部分迁移至阴极区,阳极区离子浓度下降,导电能力减弱
(3) Cu 回溯CH4生成机理,第1步是C与催化剂活性位点相连,排除Sn;Au对CO的吸附能力较小,易脱离;Cu对CO的吸附能力强,不易从催化剂表面脱离
【详解】(1)利用反应CO2(g)+H2(g)⇌HCOOH(g);ΔH =+14.9 kJ·mol-1不能实现CO2直接加氢合成HCOOH,原因是该反应的ΔH>0、ΔS<0,不能自发自行;
(2)① Sn电极上生成HCOO-的电极反应式为H++CO2+2e-=HCOO-或HCO+CO2+2e-=HCOO-+CO;
② 相同条件下,Pt电极有Nafion膜HCOO-产率明显提高,但电量>1000C后又显著下降,可能原因是Nafion膜可以阻止HCOO-在阳极放电;电量>1 000 ℃后,c(HCOO-)增大,Nafion膜阻拦作用下降;
③ 若电解时将Nafion膜置于两个电极中间,保持电流恒定,20 h时向阳极区补充KHCO3, 0~20 h,电压增大的原因是阳极区pH减小,HCO浓度下降,K+部分迁移至阴极区,阳极区离子浓度下降,导电能力减弱
(3)若还原产物主要为CH4时,应选择Cu作催化剂,因为Cu对CO的吸附能力远大于Au,且Cu吸附CO后不易脱离,第1步是C与催化剂活性位点相连,排除Sn;Au对CO的吸附能力较小,易脱离;Cu对CO的吸附能力强,不易从催化剂表面脱离。
18.(1) 负极 阳极
(2)
(3) b d
(4) 448 不变
【详解】(1)a极进入甲醇,甲醇失电子为负极,b极进入氧气,为正极,与正极相连的c极就是阳极。
(2)a极进入甲醇,甲醇失电子为负极,发生氧化反应,a极上的电极反应式:CH3CH2OH+3H2O-12e-=2CO2↑+12H+。乙池中c极与正极相连则为阳极,阳极NO失电子发生氧化反应,根据题意可知生成硝酸根,电极反应式:NO-3e-+2H2O=+4H+。
(3)甲池为原电池,向正极(b极)迁移,乙池为电解池,向阴极(d极)迁移。
(4)乙池两侧溶液体积均为100ml,左侧溶液中c(HNO3)为0.1 mol/L。电解结束后,左侧溶液中c(HNO3)变为0.3 mol/L,反应后增加了(0.3 mol/L-0.1 mol/L)×0.1L=0.02mol,根据N原子守恒可知,处理NO的物质的量为0.02mol,体积为0.02mol×22.4L/mol=0.448L=448mL。生成的氢离子会通过质子交换膜向右侧移动,所以乙池右侧溶液的pH与电解前相比不变。
2024届高三新高考化学大一轮专题练习—电解池: 这是一份2024届高三新高考化学大一轮专题练习—电解池,共24页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。
2024届高三新高考化学大一轮专题练习:电解池: 这是一份2024届高三新高考化学大一轮专题练习:电解池,共23页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。
2024届高三新高考化学大一轮专题练习---电解池: 这是一份2024届高三新高考化学大一轮专题练习---电解池,共23页。试卷主要包含了单选题,多选题,非选择题等内容,欢迎下载使用。












