


高考化学一轮复习检测:第1章 化学计量在实验中的应用1-2a Word版含解析
展开![]() 板块三 限时规范特训
板块三 限时规范特训
![]() 时间:45分钟
时间:45分钟 ![]() 满分:100分
满分:100分
一、选择题(每题6分,共72分)
1.配制一定物质的量浓度的溶液是一个重要的定量实验,下列有关说法正确的是( )
A.容量瓶用蒸馏水洗净后,可不经干燥直接用于配制溶液
B.配制一定物质的量浓度的稀盐酸时,用量筒量取9.82 mL浓盐酸
C.配制1 L 0.1 mol·L-1的NaCl溶液时,用托盘天平称量5.85 g NaCl固体
D.定容时,为防止液滴飞溅,胶头滴管紧贴容量瓶内壁
答案 A
解析 10 mL量筒的精确度为0.1 mL,B错误;托盘天平的精确度为0.1 g,C错误;胶头滴管应悬空垂直于容量瓶上方,D错误。
2.下列实验操作正确的是( )
A.含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol·L-1
B.100 g硫酸溶液的物质的量浓度为18.4 mol·L-1,用水稀释到物质的量浓度为9.2 mol·L-1,需要水100 g
C.配制一定物质的量浓度的氯化钾溶液:准确称取一定质量的氯化钾固体,放入到1000 mL的容量瓶中,加水1000 mL溶解,振荡摇匀
D.将10 g CuSO4溶解在90 g水中,配制质量分数为10%的CuSO4溶液
答案 D
解析 最后溶液的体积不为1 L,A错误;由c1×=c2×,且ρ1≠ρ2可知,m2≠2m1,B错误;最后溶液的体积不一定是1000 mL,且不能在容量瓶中溶解物质,C错误。
3.下列溶液中,溶质的物质的量浓度不是1 mol·L-1的是( )
A.10 g NaOH固体溶解在水中配成250 mL溶液
B.将80 g SO3溶于水并配成1 L的溶液
C.将0.5 mol·L-1的NaNO3溶液100 mL加热蒸发掉50 g水的溶液
D.标准状况下,将22.4 L氯化氢气体溶于水配成1 L溶液
答案 C
解析 A项,c(NaOH)==1 mol·L-1;B项,c(H2SO4)==1 mol·L-1;C项,蒸发掉50 g水后,溶液的体积并不是50 mL,NaNO3的浓度也不是1 mol·L-1;D项,c(HCl)==1 mol·L-1。
4.用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是( )
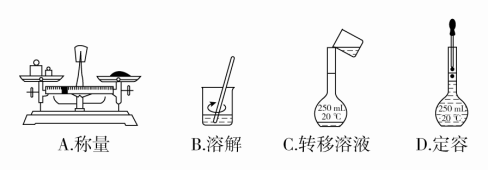
答案 B
解析 托盘天平的左盘应放物体,右盘应放砝码,A错误;将溶液转移到容量瓶中时,应用玻璃棒引流,C错误;定容时,胶头滴管不能伸入容量瓶内部,D错误;B正确。
5.实验室用碳酸钠晶体配制1.00 mol·L-1的Na2CO3溶液100 mL,造成所配溶液浓度偏低的原因是( )
A.暴露在空气中称量碳酸钠晶体(Na2CO3·10H2O)的时间太长
B.向容量瓶转移液体时,容量瓶事先用蒸馏水洗涤
C.定容时俯视刻度线
D.洗涤液移至容量瓶中时,洒出一部分
答案 D
解析 称量碳酸钠晶体(Na2CO3·10H2O)的时间太长,且暴露在空气中,会造成结晶水的挥发,则所称量的晶体中Na2CO3的含量升高,所配溶液的浓度偏高;容量瓶中原有少量蒸馏水,对溶液的浓度无影响;定容时俯视刻度线,会导致溶液体积偏小,浓度偏高;洗涤液移至容量瓶中时,洒出一部分会导致溶质的损失,浓度偏低。
6.实验室欲用碳酸钠固体配制500 mL 0.10 mol·L-1的Na2CO3溶液,下列叙述正确的是( )
A.实验用到的仪器有:托盘天平、烧杯、500 mL容量瓶、玻璃棒
B.将称量好的固体放入500 mL容量瓶中溶解
C.定容时若俯视刻度,则所得溶液浓度偏高
D.定容后翻转摇匀,发现液面下降,又加入蒸馏水到刻度线
答案 C
解析 A项缺少胶头滴管,错误;不能直接在容量瓶中溶解药品,B错误;俯视刻度会造成溶液体积偏小,浓度偏高,C正确;D项操作会使所配制溶液浓度偏低,错误。
7.由硫酸钾、硫酸铝和硫酸组成的混合溶液,其c(H+)=0.1 mol·L-1,c(Al3+)=0.4 mol·L-1,c(SO)=0.8 mol·L-1,则c(K+)为( )
A.0.15 mol·L-1 B.0.2 mol·L-1
C.0.3 mol·L-1 D.0.4 mol·L-1
答案 C
解析 根据溶液电荷守恒,溶液中存在3c(Al3+)+c(K+)+c(H+)=2c(SO)+c(OH-),而溶液中c(OH-)很小,可以忽略不计,则有3c(Al3+)+c(K+)+c(H+)=2c(SO),所以:c(K+)=2c(SO)-3c(Al3+)-c(H+)=2×0.8 mol·L-1-3×0.4 mol·L-1-0.1 mol·L-1=0.3 mol·L-1,C正确。
8.在环保、化工行业有一种溶液浓度的表示方法:质量—体积浓度,用单位体积溶液中所含的溶质质量数来表示,单位g·m-3或g·L-1。现有一种20 ℃时的饱和CuSO4溶液,密度为1.2 g·cm-3,质量—体积浓度为200 g·L-1,则对此溶液的说法不正确的是( )
A.该溶液的质量分数为16.7%
B.该溶液的物质的量浓度为1.25 mol·L-1
C.在20 ℃时,硫酸铜的溶解度为20 g
D.在20 ℃时把200 g CuSO4·5H2O溶解于1 L水中恰好得到饱和溶液
答案 D
解析 根据质量—体积浓度的定义以及质量分数、物质的量浓度的含义可以进行浓度的换算,A、B都正确;S∶100 g=200 g∶(1000 mL×1.2 g·cm-3-200 g),所以S=20 g,C正确;CuSO4·5H2O溶于水后得到CuSO4溶液,其溶质为CuSO4,其质量只有200 g×=128 g,该溶液的质量分数=×100%=10.7%,此值小于16.7%,所以不是饱和溶液,D错误。
9.如图是某同学用500 mL容量瓶配制0.10 mol·L-1 NaOH溶液的过程:
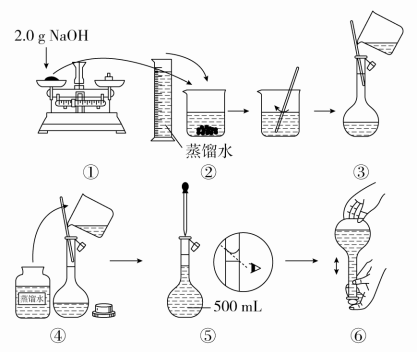
该同学的错误步骤有( )
A.1处 B.2处 C.3处 D.4处
答案 C
解析 配制500 mL 0.1 mol·L-1 NaOH溶液需用NaOH的质量为0.5 L×0.1 mol·L-1×40 g·mol-1=2.0 g。步骤①,NaOH固体易潮解,不能直接放在托盘中称量;步骤④,向容量瓶中转移液体时,玻璃棒下端要伸入到刻度线以下;步骤⑤,定容时,不能仰视刻度线,否则结果偏低。
10.[2017·山西晋城联考]传统“陈醋”生产过程中有一步称为“冬捞夏晒”,是指冬天捞出醋中的冰,夏日曝晒蒸发醋中的水分,以提高醋的品质。假设用含醋酸质量分数为3%的半成醋,生产500 g 0.945 mol·L-1的优级醋(密度为1.050 g·mL-1),生产过程中醋酸没有损失,捞出的冰和蒸发的水的总质量为( )
A.100 g B.200 g C.300 g D.400 g
答案 D
解析 设捞出的冰和蒸发的水的总质量为x g,据w===0.054,由配制前后溶质质量不变有(500+x)g×3%=500 g×0.054,解得x=400。
11.实验室里需要使用480 mL 0.10 mol·L-1的硫酸铜溶液,下列实验用品及实验操作正确的是( )
选项 | 容量瓶容积 | 溶质质量 | 实验操作 |
A | 480 mL | 硫酸铜:7.68 g | 加入500 mL水 |
B | 480 mL | 胆矾:12.0 g | 配成500 mL溶液 |
C | 500 mL | 硫酸铜:8.0 g | 加入500 mL水 |
D | 500 mL | 胆矾:12.5 g | 配成500 mL溶液 |
答案 D
解析 实验室里需要使用480 mL 0.10 mol·L-1的CuSO4溶液,由于没有规格为480 mL的容量瓶,所以要选择规格是500 mL的容量瓶;溶质若是硫酸铜,则需要8.0 g,若是胆矾则需要12.5 g,应配成500 mL溶液,而不是加入500 mL水。
12.将物质的量均为a mol的Na和Al一同投入m g足量水中,所得溶液的密度为ρ g·cm-3,则此溶液的物质的量浓度为( )
A. mol·L-1 B. mol·L-1
C. mol·L-1 D. mol·L-1
答案 A
解析 Na和Al一同投入m g足量水中时,发生反应的化学方程式为2Na+2H2O===2NaOH+H2↑、2Al+2NaOH+2H2O===2NaAlO2+3H2↑。由于Na、Al的物质的量均为a mol,结合化学方程式可知生成2a mol H2,所得溶液中只有NaAlO2一种溶质,其物质的量为a mol。所得溶液的质量为m(Na)+m(Al)+m(H2O)-m(H2)=(46a+m) g,所得溶液的体积为 L,所得溶液的物质的量浓度为 mol·L-1。故本题选A。
二、非选择题(共28分)
13.[2017·四川绵阳中学月考](14分)已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
84消毒液 【有效成分】 NaClO 【规 格】 1000 mL 【质量分数】 25% 【密 度】 1.19 g·cm-3 |
(1)该“84消毒液”的物质的量浓度约为________mol·L-1。
(2)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=________mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是________(填序号)。
A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
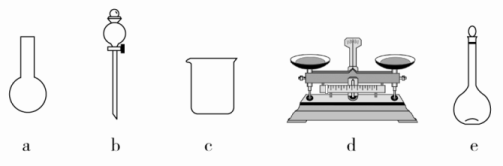
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0 g
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84 g·cm-3)的浓硫酸配制2000 mL 2.3 mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为________ mol·L-1。
②需用浓硫酸的体积为________ mL。
答案 (1)4.0 (2)0.04 (3)C (4)①4.6 ②250
解析 (1)由c=得,
c(NaClO)=≈4.0(mol·L-1)。
(2)稀释前后溶液中NaClO的物质的量不变,则有100 mL×10-3 L·mL-1×4.0 mol·L-1=100 mL×100×10-3 L·mL-1×c(NaClO),解得稀释后c(NaClO)=0.04 mol·L-1,c(Na+)=c(NaClO)=0.04 mol·L-1。
(3)选项A,需用托盘天平称量NaClO固体,需用烧杯来溶解NaClO,需用玻璃棒进行搅拌和引流,需用容量瓶和胶头滴管来定容,图示的a、b不需要,但还需玻璃棒和胶头滴管。选项B,配制过程中需要加入水,所以已经洗涤干净的容量瓶不必烘干后再使用。选项C,未洗涤烧杯和玻璃棒将导致配制的溶液中溶质的物质的量减小,结果偏低。选项D,应选取500 mL的容量瓶进行配制,然后取出480 mL即可,所以需要NaClO的质量:0.5 L×4.0 mol·L-1×74.5 g·mol-1=149.0 g。
(4)①根据H2SO4的组成可知,溶液中c(H+)=2c(H2SO4)=4.6 mol·L-1;②2000 mL 2.3 mol·L-1的稀硫酸中溶质的物质的量为2 L×2.3 mol·L-1=4.6 mol,设需要98%(密度为1.84 g·cm-3)的浓硫酸的体积为V mL,则有:=4.6 mol,解得V=250。
14.[2018·广东佛山调研](14分)奶粉中蛋白质含量的测定往往采用“凯氏定氮法”,其原理是食品与硫酸和催化剂一同加热,使蛋白质分解,分解的氨与硫酸结合生成硫酸铵。然后碱化蒸馏使氨游离,用硼酸吸收后再以硫酸或盐酸标准溶液滴定,根据酸的消耗量乘以换算系数,即为蛋白质含量。
操作步骤:
①样品处理:准确称取一定量的固体奶粉样品,移入干燥的烧杯中,经过一系列的处理,待冷却后移入一定体积的容量瓶中。
②NH3的蒸馏和吸收:把制得的溶液(取一定量)通过定氮装置,经过一系列的反应,使氨转化成硫酸铵,再经过碱化蒸馏后,使氨转变为游离态,游离氨经硼酸吸收。
③氨的滴定:用标准盐酸滴定所生成的硼酸铵,由消耗的盐酸标准液计算出总氮量,再折算为粗蛋白质含量。
试回答下列问题:
(1)在配制过程中,下列哪项操作可能使配制的溶液的浓度偏大________(填字母)。
A.烧杯中溶液转移到容量瓶中时,未洗涤烧杯
B.定容时,俯视刻度线
C.定容时,仰视刻度线
D.移液时,有少量液体溅出
(2)若称取样品的质量为1.5 g,共配制100 mL的溶液,取其中的20 mL,经过一系列处理后,使N转变为硼酸铵后用0.1 mol·L-1盐酸滴定,其用去盐酸的体积为23.0 mL,则该样品中N的含量为________(保留两位小数)。
已知滴定过程中涉及的反应方程式:
(NH4)2B4O7+2HCl+5H2O===2NH4Cl+4H3BO3
答案 (1)B (2)10.73%
解析 (1)由c=判断A、D操作会使n偏小,浓度偏小;B中俯视刻度线,使V偏小,浓度偏大;C中仰视刻度线,使V偏大,浓度偏小。
(2)n(N)=5n(HCl)=0.0115 mol,该样品中N的含量w=×100%≈10.73%。
高考化学一轮复习检测:第1章 化学计量在实验中的应用1-1a Word版含解析: 这是一份高考化学一轮复习检测:第1章 化学计量在实验中的应用1-1a Word版含解析,共10页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
2020高考化学一轮复习第一章化学计量在实验中的应用第2节检测(含解析): 这是一份2020高考化学一轮复习第一章化学计量在实验中的应用第2节检测(含解析),共7页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
2020高考化学一轮复习第一章化学计量在实验中的应用第1节检测(含解析): 这是一份2020高考化学一轮复习第一章化学计量在实验中的应用第1节检测(含解析),共8页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。












