


高考化学一轮复习检测:第4章 非金属及其化合物4-2a Word版含解析
展开 板块三 限时规范特训
板块三 限时规范特训
时间:45分钟 ![]() 满分:100分
满分:100分
一、选择题(每题7分,共70分)
1.下列说法不正确的是( )
A.久置的氯水最终会变成稀盐酸
B.硅酸钠的水溶液俗称“水玻璃”,是工业常用的黏合剂、阻燃剂、防腐剂
C.漂白粉在空气中容易变质,应密封保存
D.液氯可用钢瓶贮存,所以氯气与金属不反应
答案 D
解析 因为Cl2+H2OHCl+HClO、2HClO2HCl+O2↑,使久置的氯水最终变成盐酸,A正确;硅酸钠的水溶液俗称“水玻璃”,是工业常用的黏合剂、阻燃剂、防腐剂,B正确;漂白粉中的有效成分Ca(ClO)2能与空气中的二氧化碳和水反应生成碳酸钙和次氯酸,次氯酸见光易分解,所以漂白粉在空气中容易变质,应密封保存,C正确;干燥的氯气与铁不反应,所以液氯可用钢瓶贮存,但灼热的铁丝能与氯气反应,D错误。
2.[2017·洛阳模拟]下列物质能使紫色石蕊试液由紫色变红又褪色的是( )
①Cl2 ②盐酸 ③氯水 ④盐酸酸化的漂白粉 ⑤木炭 ⑥Na2O2
A.①③④ B.①②③⑥
C.②③④ D.①③④⑤⑥
答案 A
解析 ①Cl2与水反应生成盐酸和次氯酸,盐酸能使紫色石蕊试液由紫色变红,次氯酸的强氧化性能使溶液褪色;②盐酸能使紫色石蕊试液由紫色变红,不能褪色;③氯水中含盐酸和次氯酸,能使紫色石蕊试液由紫色变红,后褪色;④盐酸酸化的漂白粉中也含有盐酸和次氯酸,能使紫色石蕊试液由紫色变红,后褪色;⑤木炭不能使紫色石蕊试液变红;⑥Na2O2与水反应生成碱,使紫色石蕊试液变蓝。故选A。
3.用下列装置制备并检验Cl2的性质,下列有关说法正确的是( )
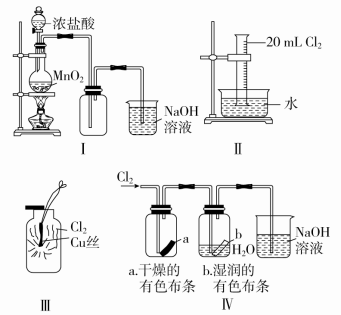
A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部反应
B.Ⅱ图中:充分光照后,量筒中剩余气体约为10 mL(条件相同)
C.Ⅲ图中:生成蓝色的烟,若在集气瓶中加入少量水,所得溶液呈绿色
D.Ⅳ图中:干燥的有色布条不褪色,湿润的有色布条能褪色,说明Cl2有漂白性
答案 B
解析 浓盐酸随反应的进行会变稀,稀盐酸和MnO2不反应,A错误;Cu丝与Cl2反应时生成棕黄色的烟,C错误;Cl2没有漂白性而HClO有漂白性,D错误。
4.某学生做如下实验:第一步,在淀粉KI 溶液中滴入少量NaClO溶液,并加入少量稀硫酸,溶液立即变蓝;第二步,在上述蓝色溶液中,滴加足量的Na2SO3溶液,蓝色逐渐消失。下列叙述中该同学对实验原理的解释和所得结论不正确的是( )
A.第一步反应的离子方程式为:ClO-+2I-+2H+===I2+Cl-+H2O
B.淀粉KI溶液变蓝是因为I-被氧化为I2,I2遇淀粉变蓝色
C.蓝色逐渐消失的原因是Na2SO3溶液具有漂白性
D.微粒的氧化性由强到弱的顺序是ClO->I2>SO
答案 C
解析 由题意知,在淀粉KI溶液中滴入少量NaClO溶液,并加入少量稀硫酸后,发生反应:ClO-+2I-+2H+===I2+Cl-+H2O,从而使淀粉溶液变蓝,再滴加足量的Na2SO3溶液,发生反应SO+I2+H2O===SO+2H++2I-,蓝色逐渐消失,由此可以得出微粒的氧化性由强到弱的顺序是ClO->I2>SO。
5.一氯化碘(ICl)、三氯化碘(ICl3)是卤素互化物,它们的性质与卤素单质相似,如:2ICl+2Zn===ZnI2+ZnCl2。以下判断正确的是( )
A.ICl3与水反应的产物为HI和HClO
B.ICl3与KI反应时,氯元素被还原
C.ICl与冷NaOH溶液反应的离子方程式为ICl+2OH-===IO-+Cl-+H2O
D.ICl与水的反应属于氧化还原反应
答案 C
解析 ICl3中I元素为+3价,Cl元素为-1价,当ICl3与水反应时,I3+与水电离出的OH-结合形成HIO2,Cl-与水电离出的H+结合形成HCl,A错误;ICl3与KI反应时,ICl3中的+3价碘元素被还原,B错误;ICl中I元素为+1价,Cl元素为-1价,则ICl与NaOH溶液反应的离子方程式为ICl+2OH-===IO-+Cl-+H2O,C正确;ICl与水反应的化学方程式为ICl+H2O===HIO+HCl,反应中没有化合价的变化,不属于氧化还原反应,D错误。
6.为预防甲型“H1N1”流感,同学们每天用“84”消毒液(NaClO溶液)消毒,下列说法不正确的是( )
A.NaClO溶液的消毒原理是使蛋白质变性
B.1 mol Cl2与足量NaOH溶液反应转移2 mol电子
C.NaClO溶液的漂白原理与Na2O2相同,与SO2不同
D.“84”消毒液与“洁厕灵”(盐酸)混合使用可能会产生有毒的氯气
答案 B
解析 NaClO具有强氧化性,能使蛋白质变性,A正确;在反应Cl2+2NaOH===NaCl+NaClO+H2O中Cl2既是氧化剂,又是还原剂,1 mol Cl2参加反应转移1 mol电子,B错误;NaClO、Na2O2具有强氧化性而能漂白有色物质,SO2与有色物质化合而使其漂白,C正确;NaClO具有强氧化性,“洁厕灵”中的盐酸具有还原性,会发生反应NaClO+2HCl===NaCl+Cl2↑+H2O,D正确。
7.[2017·安徽江淮十校质检]已知酸性:H2CO3>HClO>HCO,下列有关叙述中正确的是( )
①向NaClO溶液中通入少量二氧化碳的离子方程式为2ClO-+CO2+H2O===2HClO+CO
②向KI和KBr混合溶液中加入足量FeCl3溶液,用CCl4萃取后取上层中的液体少许并加入AgNO3溶液,有淡黄色沉淀生成
③向FeI2溶液中滴加少量氯水,反应的离子方程式为2Fe2++Cl2===2Fe3++2Cl-
④卫生间的洁厕灵不能跟“84”消毒液混用,其离子方程式为ClO-+Cl-+2H+===Cl2↑+H2O
A.②④ B.①③ C.②③ D.①④
答案 A
解析 向NaClO溶液中通入少量二氧化碳的离子方程式为ClO-+CO2+H2O===HClO+HCO,故①错误;Fe3+只能把I-氧化为碘单质,上层的液体含有溴离子,加入AgNO3溶液有淡黄色溴化银沉淀生成,故②正确;向FeI2溶液中滴加少量氯水,氯气先氧化碘离子,反应的离子方程式为Cl2+2I-===2Cl-+I2,故③错误;卫生间的洁厕灵不能跟“84”消毒液混用,其反应的离子方程式为ClO-+Cl-+2H+===Cl2↑+H2O,故④正确。
8.下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。
已知:2KMnO4+16HCl===2KCl+5Cl2↑+2MnCl2+8H2O
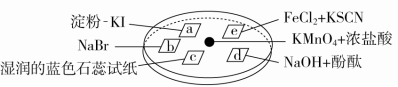
对实验现象的“解释或结论”正确的是( )
答案 D
解析 a处变蓝、b处变红棕色,说明Cl2分别与KI、NaBr作用生成I2、Br2,可证明氧化性:Cl2>I2,Cl2>Br2,无法证明I2与Br2之间氧化性的强弱,A错误;c处先变红,证明Cl2与水生成酸性物质,后褪色,证明Cl2与水生成具有漂白性的物质,B错误;d处立即褪色,也可能是因为Cl2与水生成酸性物质中和了NaOH,C错误;e处变红说明Cl2将Fe2+氧化为Fe3+,证明还原性:Fe2+>Cl-,D正确。
9.碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间有如图所示关系,根据图示转化关系推测下列说法不正确的是( )
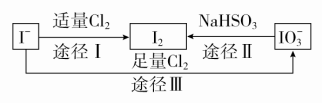
A.可用淀粉KI试纸和食醋检验加碘盐中是否含有碘
B.足量Cl2能使湿润的淀粉KI试纸最终变白的原因可能是5Cl2+I2+6H2O===2HIO3+10HCl
C.由图可知氧化性的强弱顺序为Cl2>I2>IO
D.途径Ⅱ中若生成1 mol I2,反应中转移的电子数为10NA
答案 C
解析 加碘盐中含有IO,在酸性条件下可被I-还原生成I2,淀粉KI试纸会变蓝,A正确;根据图示转化关系可知原因可能是5Cl2+I2+6H2O===2HIO3+10HCl,B正确;根据途径Ⅰ可知氧化性:Cl2>I2,根据途径Ⅱ可知氧化性:IO>I2,根据途径Ⅲ可知氧化性:Cl2>IO,C错误;根据关系式:2IO~I2~10e-可知,若生成1 mol I2,反应中转移的电子数为10NA,D正确。
10.某溶液中含有NH、SO、SiO、Br-、CO、Na+,向该溶液中通入过量的Cl2,下列判断正确的是( )
①反应前后,溶液中离子浓度基本保持不变的有NH、Na+ ②有胶状物质生成 ③有气体产生
④溶液颜色发生变化 ⑤共发生了2个氧化还原反应
A.①②③④ B.②③④
C.①③⑤ D.①②③④⑤
答案 A
解析 本题所涉及的氧化还原反应有3个:Cl2+H2OHCl+HClO,Cl2+2Br-===Br2+2Cl-,Cl2+SO+H2O===SO+2Cl-+2H+;还涉及:SiO+2H+===H2SiO3↓,CO+2H+===H2O+CO2↑;反应过程中有胶状物质硅酸生成;因为有溴生成,溶液显橙色;有二氧化碳气体生成;NH、Na+不发生反应。
二、非选择题(共30分)
11.(15分)元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子结构示意图为________。
(2)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液NaClO3溶液KClO3晶体
①完成Ⅰ中反应的总化学方程式:NaCl+H2O===NaClO3+________。
②Ⅱ中转化的基本反应类型是________,该反应过程能析出KClO3晶体而无其他晶体析出的原因是____________________________________________________________
_________________________________________________________。
(3)一定条件下,在水溶液中1 mol Cl-、ClO(x=1,2,3,4)的能量(kJ)相对大小如下图所示。
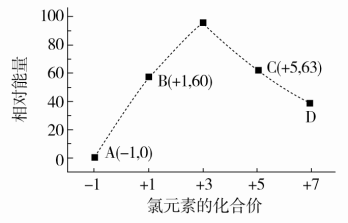
D是________(填离子符号)。
答案 (1)![]() (2)①1 3 1 3H2↑
(2)①1 3 1 3H2↑
②复分解反应 室温下,氯酸钾在水中的溶解度明显小于其他晶体
(3)ClO
解析 (1)与Cl同族的短周期元素为F,其原子结构示意图为![]() 。
。
(2)①根据氧化还原反应规律,化合价有升有降,可推断另一产物为H2。②Ⅱ中反应为复分解反应:NaClO3+KCl===NaCl+KClO3↓,原因为在室温下,KClO3在水中的溶解度明显小于其他晶体。
(3)由图可知D中Cl元素化合价为+7价,D为ClO。
12.(15分)某实验小组用浓盐酸和MnO2制取Cl2并探究其化学性质,设计装置如下图所示:
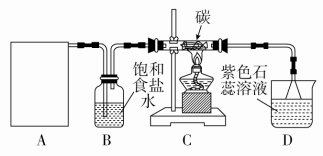
(1)制备Cl2的化学反应离子方程式是__________________,A是氯气发生装置(省略未画),A装置除了酒精灯、圆底烧瓶外还用到的玻璃仪器有______________________________________________。
(2)从C装置出来的气体中含有CO2和HCl,则在C装置中发生的化学反应方程式为____________________。
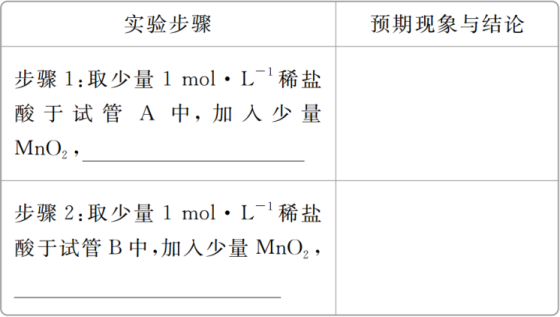
(3)同学们在实验中发现,若用稀盐酸代替浓盐酸与MnO2混合加热没有氯气生成,于是开始探究该条件下不能生成氯气的原因。
①提出合理假设。
假设1:H+的浓度不够大;
假设2:____________________________________________;
假设3:____________________________________________。
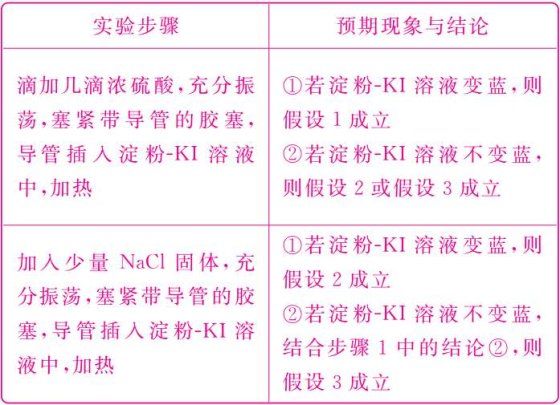
②设计实验方案,进行实验。在下表中写出实验步骤以及预期现象和结论。
限选实验试剂:蒸馏水、浓H2SO4、NaCl固体、MnO2固体、1 mol·L-1稀盐酸、1 mol·L-1 AgNO3溶液、淀粉KI溶液。
答案 (1)MnO2+4H++2Cl-Mn2++Cl2↑+2H2O 分液漏斗
(2)2Cl2+2H2O+CCO2+4HCl
(3)①假设2:Cl-的浓度不够大 假设3:Cl-和H+的浓度均不够大 ②如下表:
解析 (1)本题考查了氯气的制取原理:MnO2+4H++2Cl-Mn2++Cl2↑+2H2O。制取氯气是固液加热的方式,一般用分液漏斗装液体,烧瓶作为反应容器。
(2)氯气在制取过程中只除去了HCl,并没有干燥,在加热条件下Cl2和水蒸气与C反应,产物为CO2和HCl。
(3)探究氯气的制取原理:明确了盐酸的浓度,就可以从Cl-的浓度、H+的浓度对反应的影响进行假设、实验、验证。
高考化学一轮复习检测:第11章 化学实验11-3a Word版含解析: 这是一份高考化学一轮复习检测:第11章 化学实验11-3a Word版含解析,共9页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
高考化学一轮复习检测:第11章 化学实验11-1a Word版含解析: 这是一份高考化学一轮复习检测:第11章 化学实验11-1a Word版含解析,共9页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
高考化学一轮复习检测:第4章 非金属及其化合物4-4a Word版含解析: 这是一份高考化学一轮复习检测:第4章 非金属及其化合物4-4a Word版含解析,共12页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。













