2022年高中化学必修2章末系统总结3 Word版含解析
展开章末系统总结3
一、重点知识梳理

二、实验专项探究
1.乙醇催化氧化的实验探究。`
实验 | 人教版教材实验设计 | 苏教版教材实验设计 |
实验原理 | 2CH3CH2OH+O22CH3CHO+2H2O | |
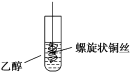
实验装置 |
|
|
实验步骤 | 向一支试管中加入3~5 mL乙醇,取一根10~15 cm长的铜丝,下端绕成螺旋状,在酒精灯上烧至红热,插入乙醇中,反复几次,观察反应的现象,小心闻试管中液体的气味 | 向试管中加入3~4 mL无水乙醇,浸入50 ℃左右的热水中,将铜丝烧热,迅速插入乙醇中,反复多次,观察并感受铜丝颜色和乙醇气味的变化 |
现象及结论 | 实验现象:①烧至红热的铜丝表面变黑,趁热将铜丝插入乙醇中,铜丝立即又变成红色;②能闻到一股不同于乙醇的强烈的刺激性气味 实验结论:①铜在反应中起催化剂的作用;②乙醇被氧化成乙醛 | |
创新发掘 | 1.铜丝绕成螺旋状的理由是什么? 分析:增大反应物的接触面积,提高化学反应速率。同时又有利于保存热量 2.实验中如何确定是否有新物质生成? 分析:通过闻试管中液体的气味,产生一种不同于乙醇的刺激性气味来判断有新物质生成 3.实验中乙醇的用量是3~5 mL,为什么不宜过多? 分析:因为生成的乙醛能溶于乙醇中,而不易闻到乙醛的气味 | 1.实验过程中铜丝的颜色先后发生了什么变化? 分析:铜丝颜色的变化:红色―→黑色―→红色 2.实验中为什么要将乙醇浸泡在50 ℃左右的热水浴中? 分析:乙醇的催化氧化要在一定温度下进行,将乙醇预热到50 ℃便于反应的进行 3.乙醇在实验中是被氧化还是被还原? 分析:乙醇在反应中发生了氧化反应,被氧化 |
续上表
实验 | 人教版教材实验设计 | 苏教版教材实验设计 |
个性评点 | 1.苏教版教材对乙醇催化氧化实验中把实验操作以实物图的形式分三步进行,直观明了,易于学生掌握,而人教版教材只描述了实验操作过程 2.苏教版教材实验中的乙醇事先放在50 ℃左右的水浴中加热,更利于反应的进行,与人教版实验操作次数相同时,能生成更多的乙醛,更易闻到乙醛的气味 3.苏教版教材在实验后提了两个针对性很强的思考性问题,体现了实验的探究性,并适时地引入了有机反应中被氧化、被还原的问题,拓展了学生的视野 | |
思维引领 | 1.乙醇催化氧化的反应历程可表示如下: ①2Cu+O22CuO ②CuO+CH3CH2OHCH3CHO+Cu+H2O 将①+②×2可得:2CH3CH2OH+O22CH3CHO+2H2O 从而可理解铜丝的作用是做催化剂 2.有机反应中氧化反应和还原反应:(1)氧化反应:加氧或去氢的反应,如:乙醇的催化氧化 (2)还原反应:加氢或去氧的反应,如:乙烯与H2的加成反应 | |
2.制备乙酸乙酯的实验探究。
实验 | 人教版教材实验设计 | 苏教版教材实验设计 |
实验原理 | CH3COOH+CH3CH2OHCH3COOC2H5+H2O | |
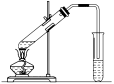
实验装置 |
生成乙酸乙酯的反应 |
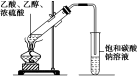
乙醇和乙酸反应装置图 |
实验步骤 | 在一支试管中加入3 mL乙醇,然后边振荡试管边慢慢加入2 mL浓硫酸和2 mL乙酸;按图示连接好装置,用酒精灯缓慢加热,将产生的气体经导管通到饱和碳酸钠溶液的液面上,观察现象 | |
现象及结论 | 实验现象:①饱和Na2CO3溶液的液面上有透明的油状液体产生 ②Na2CO3溶液液面上的油状液体能闻到香味 实验结论:乙酸和乙醇在浓硫酸的催化作用下能发生酯化反应,生成乙酸乙酯和水 | |
创新发掘 | 1.酯化反应的实验中,浓硫酸的作用是什么? 分析:浓硫酸起催化剂和吸水剂的作用 2.试管中饱和Na2CO3溶液的作用是什么? 分析:①与挥发出来的乙酸反应,使之转化为乙酸钠而溶于水 ②溶解挥发出来的乙醇 ③降低乙酸乙酯在水中的溶解度,便于分层得到乙酸乙酯 3.竖立试管中的导气管能否伸入到液面以下?其原因是什么? 分析:不能;为了防止倒吸 | 1.长玻璃导管的作用是什么? 分析:导气兼冷凝回流 2.配制一定比例的乙醇、乙酸和浓硫酸混合液的方法是什么? 分析:先在试管中加入一定量的乙醇,然后边振荡试管边慢慢加入浓硫酸,最后再加入乙酸 3.实验中为什么要用酒精灯小心均匀地给试管加热? 分析:小火加热的目的是利于产物的生成和蒸发,减少反应物的挥发 |
个性评点 | 1.苏教版实验要求学生对比乙酸乙酯、乙酸、乙醇的分子结构,推测乙酸和乙醇反应生成乙酸乙酯的结合方式、并用不同颜色进行了标记,引导学生探究酯化反应的实质。而人教版教材没有这一方面的要求 2.人教版教材习题中增加了除去乙酸乙酯中残留乙酸的方法,复习巩固了混合物分离除杂的要求和方法,拓展了学生的视野,而苏教版教材没有体现这一做法 | |
续上表
实验 | 人教版教材实验设计 | 苏教版教材实验设计 |
思维引领 | 1.用示踪原子法可以探究酯化反应的实质(乙醇中的氧原子用18O标记),反应过程如下:
即酯化反应的实质是酸脱羟基,醇脱羟基氢 2.为防止实验过程中倒吸现象的发生,可在导气管的末端连接干燥管装置(见图)。由于干燥管的容积较大,可有效地防止倒吸
| |
![]() 即时训练
即时训练
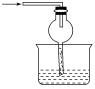
1.有关催化剂的催化机理等问题可从“乙醇催化氧化实验”得到一些认识,其实验装置如图所示。
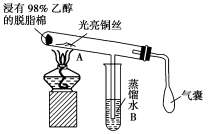
实验操作:预先使棉花团浸透乙醇并照图安装好;在铜丝的中间部分加热,片刻后开始有节奏(间歇性)地鼓入空气,即可观察到明显的实验现象。请回答以下问题:
(1)被加热的铜丝处发生反应的化学方程式为_______________
_____________________________________________________。
(2)A管中可观察到__________________________________现象,从中可认识到在该实验过程中催化剂起催化作用时参加了化学反应,还可认识到催化剂起催化作用时需要一定的___________________。
(3)实验一段时间后,如果撤掉酒精灯,反应________(填“能”或“不能”)继续进行。原受热的铜丝处的现象是______________________,其原因是___________________。
解析:(1)铜丝加热时被氧气氧化生成氧化铜,氧化铜将乙醇氧化生成乙醛和水。(2)铜丝被氧气氧化变为黑色的氧化铜,黑色的氧化铜被乙醇还原重新变为红色,然后铜丝再与氧气反应继续进行下去。催化剂在起催化作用时往往需要一定的温度。(3)因醇的催化氧化是一个放热反应,故撤掉酒精灯后,反应放出的热使该反应继续进行,受热的铜丝处仍然出现上述现象。
答案:(1)2CH3CH2OH+O22CH3CHO+2H2O (2)受热部分的铜丝随间歇性地鼓入空气而交替出现变黑、变亮的现象 温度 (3)能 交替出现变黑、变亮的现象 该反应是放热反应
2.某课外活动小组的同学为了提高制取乙醛时的乙醇转化率,利用如下图所示的装置进行乙醇的催化氧化实验制取乙醛,图中铁架台等装置已略去,粗黑线表示乳胶管。请填写下列空白:
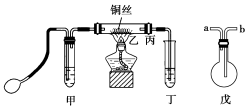
(1)甲装置常常浸在70~80 ℃的水浴中,目的是?____________
______________________________________________________。
(2)实验时,先加热玻璃管乙中的铜丝,约1分钟后鼓入空气,此时铜丝立即呈红热状态。若把酒精灯撤走,控制一定的鼓气速率,铜丝能长时间保持红热直到实验结束。
①铜丝能长时间保持红热的原因是_______________________;
②控制鼓气速率的方法是_______________________________。
(3)若试管丁中用水吸收产物,则要在乙、丙之间接上戊装置,其连接方式是(填戊装置中导管的代号):乙接________、________接丙,戊装置的作用是________________________________________。
若产物不用水吸收而是直接冷却,应将试管丁浸在________中。
解析:从该实验的装置图分析是利用试管甲和气囊得到乙醇蒸气和氧气,然后与玻璃管乙中的铜丝反应制得乙醛,利用试管丁收集生成的乙醛。(1)为了加快乙醇汽化的速率,需对试管甲进行加热。(2)铜丝能够长时间保持红热状态,说明该反应是放热反应;气流速率可通过观察甲试管中的气泡数量确定,所以可通过控制甲试管中单位时间内的气泡数达到控制鼓气速率的目的。(3)由于乙醛易溶于水,为防止倒吸,可在乙、丙中间添加安全瓶;若不用水吸收,为了增强冷却效果,可将试管丁浸在冰水中。
答案:(1)加快乙醇汽化的速率 (2)①乙醇的催化氧化是放热反应 ②控制甲装置中单位时间内的气泡数 (3)a b 防止倒吸 冰水
3.制取乙酸乙酯的装置正确的是( )
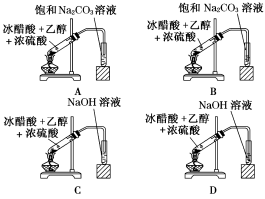
解析:玻璃导管不能插入到液面以下,以防止倒吸,不能用NaOH溶液,应用饱和Na2CO3溶液,作除杂试剂。
答案:A
4.如图所示,在试管甲中先加入2 mL 95%的乙醇,在摇动情况下缓缓加入5 mL浓硫酸,并充分摇匀。冷却后再加入2 g无水醋酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入7 mL饱和碳酸钠溶液。按如图所示连接好装置。用酒精灯对试管甲加热,当观察到试管乙中有明显现象时停止实验。
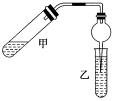
(1)写出甲试管中发生的主要反应的化学方程式:____________
_____________________________________________________。
(2)加入浓硫酸的目的是________________________________。
(3)试管乙中观察到的现象是____________________________。
(4)在实验中,球形干燥管除了起冷凝作用外,另一个重要作用是________,其工作原理是___________________________________
______________________________________________________。
(5)饱和碳酸钠溶液的作用是_____________________________
_____________________________________________________。
解析:乙醇和醋酸发生酯化反应时,浓硫酸的作用是做催化剂和吸水剂,利用浓硫酸的吸水性,使酯化反应向生成酯的方向进行,本实验用的醋酸是用浓硫酸和无水醋酸钠反应制取的。因生成的乙酸乙酯不溶于水,故在乙试管中可观察到液体分层,蒸出的乙酸与Na2CO3溶液反应产生气泡。球形干燥管可防止倒吸。
答案:(1)2CH3COONa+H2SO42CH3COOH+Na2SO4 CH3COOH+C2H5OHCH3COOC2H5+H2O
(2)做催化剂和吸水剂 (3)液体分层,上层为无色透明的油状液体,两层间有无色气泡产生 (4)防止倒吸 当液体上升到干燥管中时,由于球形干燥管容积大,导致试管中液面明显下降,使干燥管末端脱离液面,干燥管中的液体又流回试管中,从而防止了倒吸 (5)吸收反应蒸出的乙酸,溶解乙醇,降低乙酸乙酯在水中的溶解度,便于液体分层
2022年高中化学必修2章末系统总结4 Word版含解析: 这是一份高中化学人教版 (2019)必修 第二册全册综合随堂练习题,共3页。试卷主要包含了重点知识梳理等内容,欢迎下载使用。
2022年高中化学必修2章末系统总结2 Word版含解析: 这是一份高中化学人教版 (2019)必修 第二册全册综合课后练习题,共9页。试卷主要包含了重点知识梳理,实验专项探究等内容,欢迎下载使用。
2022年高中化学必修2章末系统总结1 Word版含解析: 这是一份人教版 (2019)必修 第二册全册综合课后作业题,共5页。试卷主要包含了重点知识梳理等内容,欢迎下载使用。