






高中化学必修2 第2课时 化学反应的限度 化学反应条件的控制
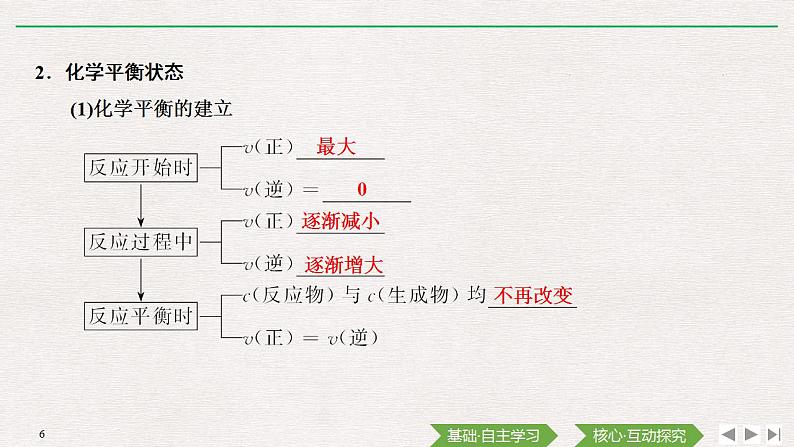
展开第2课时 化学反应的限度 化学反应条件的控制[知识梳理]知识点一 化学反应的限度德国化学家哈伯(F.Haber,1868~1934)从1902年开始研究由氮气和氢气直接合成氨。于1908年申请专利,即“循环法”,在此基础上,他继续研究,于1909年改进了合成,氨的产率达到8%。这是工业普遍采用的直接合成法。反应过程中为解决氢气和氮气合成转化率的问题,将氨产品从合成反应后的气体中分离出来,未反应气和新鲜氢氮气混合重新参与合成反应。以上是工业合成氨的发现史和原理,如何提高氨的产率,学习完下列知识点你就知道:1.可逆反应正反应方向逆反应方向同时全部100%2.化学平衡状态(1)化学平衡的建立最大0逐渐减小逐渐增大不再改变(2)化学平衡状态(简称__________)在一定条件下,可逆反应进行到一定程度时,正反应速率和逆反应速率____________,反应物和生成物的浓度____________的状态。化学平衡相等不再改变知识点二 化学反应条件的控制1.化学平衡移动的含义对一个化学平衡状态改变条件时,原来的化学平衡将被________,并在新的条件下建立________________,即发生化学平衡移动。2.影响化学平衡移动的因素影响因素有________、____________、________等。破坏新的化学平衡温度反应物浓度压强3.应用在化工生产中,为了提高反应进行的程度而调控反应条件时,需要考虑控制反应条件的成本和实际可能性,例如,合成氨的生产在温度较低时,氨的产率________;压强越大,氨的产率________。但温度低,反应速率小,需要很长时间才能达到化学平衡,生产成本高,工业上通常选择在400~500 ℃下进行。而压强越大,对动力和生产设备的要求也越高,合成氨厂随着生产规模和设备条件的不同,采用的压强通常为10~30 MPa。较高越高微判断(1)任何可逆反应都有一定的限度( )(2)化学反应达到限度时,正、逆反应速率相等( )(3)化学反应的限度与时间的长短无关( )(4)化学反应的限度是不可改变的( )√√√×微训练1.下列说法中不正确的是( )A.当一个可逆反应达到平衡状态时,就是这个反应在该条件下所能达到的限度B.当一个可逆反应达到平衡状态时,这个反应的正反应速率和逆反应速率相等C.可以通过控制反应条件,使2 mol SO2与1 mol O2反应生成2 mol SO3D.化学反应的限度可以通过改变条件来改变答案 CA.单位时间内生成n mol A2的同时生成n mol ABB.容器内的总压强不随时间的变化而变化C.单位时间内生成2n mol AB的同时生成n mol B2D.单位时间内生成n mol A2的同时生成n mol B2解析 在一定条件下,判断一个反应是否达到平衡,主要看正、逆反应速率是否相等,体系中各组分的浓度(或含量)是否保持不变。A项中,生成A2是逆反应,生成AB是正反应。显然v(正)<v(逆),没有达到平衡;B项中,压强不随时间的变化而变化,不能说明反应混合物中A2、B2和AB的浓度是否保持一定,也不能说明v(正)是否等于v(逆)。该反应前后气体总的物质的量保持不变,在其他条件一定时,反应从开始至达到平衡,压强一直保持不变,故压强不变不能说明反应是否达到平衡状态;C项表明v(正)=v(逆),反应已达到平衡状态;D项中,只说明了逆反应速率,没有说明正反应速率,且不管平衡是否建立,只要反应在进行,生成A2和B2的物质的量之比始终为1∶1。答案 C3.(1)炭在火炉中燃烧得很旺时,在往炉膛底内的热炭上喷洒少量水的瞬间,炉子内的火会更旺这是因为_________________________________________ ________________________________________________________________。(2)如果欲使炉内炭更充分燃烧,下列措施可行的是( )A.向炉内吹空气 B.把块状炭碾碎C.使用H2O作催化剂 D.提高炉膛内的温度答案 (1)炭与水反应生成CO和H2,燃烧更快,火焰更旺 (2)AB微思考1.判断可逆反应已达到平衡状态的依据有哪些?提示 直接判据:a.正、逆反应速率相等;b.各物质浓度不变。间接判据:百分含量、物质的量、压强、平均相对分子质量、密度、颜色不随时间改变。2.如何理解正、逆反应速率相等 ?提示 同一物质的生成速率和消耗速率相等。学习任务1 化学平衡的建立和特征资料:化学平衡状态在一定条件下,当一个可逆反应的正反应速率与逆反应速率相等时,反应物的浓度与生成物的浓度不再改变,达到一种表面静止的状态,即“化学平衡状态”。其中,正反应速率与逆反应速率相等是化学平衡状态的性质,而反应物的浓度与生成物的浓度不再改变是化学平衡状态的表现。正反应速率与逆反应速率是针对同一可逆反应而言,正与反只是相对而言,不是绝对概念。请根据化学平衡状态的百度百科,完成下列问题:1.化学平衡状态建立后,反应停止,反应速率为0,这句话对吗?提示 不对。从下图可知,化学平衡建立后,v(正)=v(逆)≠0,说明反应并没有停止。2.在反应达到化学平衡状态时,各组分的浓度及质量分数、体积分数均保持________(填“相等”“不变”),________相等,________符合化学计量数之比。(填“一定”“不一定”)提示 不变 不一定 不一定1.化学平衡建立的速率图像2.化学平衡状态的特征概括为:逆、等、动、定、变,即:A.M、N、Q三种物质的浓度一定相等B.M、N全部变成了QC.反应物和生成物的浓度都保持不变D.反应已经停止解析 平衡时反应物、生成物的浓度之比应从两个方面考虑:一是反应物的起始浓度,二是化学方程式中的化学计量数。如2 mol M与1 mol N反应,无论怎样反应,M与N的浓度永远不相等,所以“M、N、Q三种物质的浓度一定相等”这种说法是错误的,A错误;此反应是可逆反应,B错误;反应物和生成物的浓度都保持不变,可以说明反应达到平衡状态,但未停止,C正确,D错误。答案 C变式训练 对化学反应速率与化学反应限度的叙述,不正确的是( )解析 A项反应达到最大限度时v正=v逆≠0,A项错误;同一化学反应,条件改变,化学平衡可能被破坏,反应限度可能就会被改变,B项正确;任何可逆反应都有一定的限度,当反应达到限度时,即反应达到化学平衡,此时v(正)=v(逆),对同一可逆反应,达到化学平衡时,当外界条件不变时,反应的限度不变,与时间长短无关。答案 AA.当化学反应达到最大限度时反应速率为0B.同一化学反应,若反应条件不同,限度可能不同C.化学反应达到限度时,正、逆反应速率相等D.化学反应的限度与时间的长短无关学习任务2 (核心素养)化学平衡状态的判断一、知识要点光谱二、核心素养在分析和解答时要注意审题,看清楚题目中给出的反应条件是恒温恒容还是恒温恒压,化学方程式中气体的前后化学计量数是否相等,是否有非气态物质参与。①单位时间内生成n mol O2的同时生成2n mol NO2②单位时间内生成n mol O2的同时生成2n mol NO③用NO2、NO、O2表示的反应速率的比为2∶2∶1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态A.①④⑥⑦ B.②③⑤⑦ C.①③④⑤ D.全部[解题模板]三、对点训练A.体系的压强不再发生变化B.v (CO)=v (H2O)C.生成n mol CO的同时生成n mol H2D.1 mol H—H键断裂的同时断裂2 mol H—O键答案 BC解析 A项,由于该反应前后气体体积改变,当体系的压强不再发生变化时,说明反应已达到化学平衡状态。B项,CO的正反应速率等于其逆反应速率,说明反应已达到化学平衡状态。C项,生成CO、H2均表示反应向正反应方向进行,没有表示出正、逆反应速率的关系,不能说明反应已达到化学平衡状态。D项,H—H键断裂和H—O键断裂是两个相反的反应方向,1 mol H—H键断裂的同时断裂2 mol H—O键,即消耗1 mol H2的同时消耗了1 mol H2O,可知H2的消耗量等于其生成量,说明反应已达到化学平衡状态。解析 当v正=v逆时,为平衡状态,A项叙述均表示正反应速率,且反应过程中二者恒相等,故不能判断可逆反应达到平衡状态;B项叙述前者表示正反应速率,后者表示逆反应速率,当二者相等时,可逆反应达到平衡状态;该反应为气体体积增大的反应,在反应过程中体系压强增大,当压强不再改变时,则达到平衡状态。答案 AA.NH3的消耗速率等于NO的生成速率B.NH3的消耗速率等于NO的消耗速率C.NH3的浓度和NO的浓度都不发生改变D.密闭容器内的压强不发生改变(1)若反应在一容积可变的密闭容器中进行,在其他条件不变的情况下,下列条件的改变对其反应速率无影响的是________(填字母,下同)。A.保持体积不变,增加CO的物质的量B.将容器的体积缩小一半C.保持压强不变,充入N2使容器体积增大D.保持体积不变,充入N2使体系压强增大(2)若反应在一容积恒定的密闭容器内进行,能判断该反应一定达到化学平衡状态的是________。①容器内气体的平均相对分子质量不随时间而变化②v正(H2O)=v逆(H2) ③容器内气体的密度不随时间而变化 ④容器内气体总质量不随时间而变化 ⑤消耗n mol H2的同时消耗n mol COA.①②③ B.①②③④C.② D.①④⑤答案 (1)D (2)B解析 (1)A项,增加CO的物质的量,由于体积不变,会使c(CO)增大,则速率加快;B项,容器体积缩小一半,各气体的浓度都增大,则速率加快;C项,N2不参与反应,充入N2使容器的体积增大,从而使参与反应的各组分的浓度变小,速率变慢;D项,充入N2,体系压强虽增大,但由于体积不变,则参与反应的各组分的浓度不变,对速率无影响。(2)由于C是固体,只要反应未达到平衡状态,气体的质量、密度、相对分子质量就是不断变化的,它们不变时说明反应已达平衡状态,故①③④正确;用不同物质的反应速率表示化学平衡状态时必须一正一逆且速率数值之比等于化学计量数之比,故②正确;任何时刻,消耗n mol H2的同时都消耗n mol CO,⑤错误。答案 (1)0.1 mol·L-1·min-1 0.05 mol·L-1·min-1 0.5 mol·L-1 (2)均为恒量(1)v(HI)=________________;v(H2)=_____________________________;氢气的起始浓度=________。(2)若上述反应达到平衡时,则平衡浓度c(HI)、c(I2)、c(H2)的关系是______(填“相等”、“2∶1∶1”或“均为恒量”)。5.某温度下,A、B、C三种气体在恒容密闭容器中进行反应,反应从0~2 min进行过程中,在不同反应时间各物质的量的变化情况如图所示。(1)该反应的反应物是____________,生成物是________。(2)化学方程式为___________________________________________。(3)能否计算反应开始至2 min时,用C表示的反应速率?________,若不能,则其原因是________________________________________________________________________________________________________________。(4)关于该反应的说法正确的是________(填字母,下同)。a.到达2 min时,反应停止b.在2 min之前A的消耗速率大于A的生成速率c.在2 min时达到平衡状态是因为此时反应物总物质的量与生成物总物质的量相等d.2 min时正反应速率与逆反应速率相等(5)下列可判断反应已达到平衡状态的是________。a.A、B、C的反应速率相等b.A、B的反应速率之比为2∶1c.混合气体的压强不变d.生成1 mol C的同时消耗1 mol A和0.5 mol B
高中化学人教版 (2019)必修 第二册第二节 化学反应的速率与限度课文配套ppt课件: 这是一份高中化学人教版 (2019)必修 第二册第二节 化学反应的速率与限度课文配套ppt课件,共52页。PPT课件主要包含了新课情景呈现,课前素能奠基,应叫可逆反应,2可逆反应特点,不再改变,最大程,实际可能性,课堂素能探究,知识点,2一等一不变等内容,欢迎下载使用。
高中人教版 (2019)第二节 化学反应的速率与限度教学ppt课件: 这是一份高中人教版 (2019)第二节 化学反应的速率与限度教学ppt课件,共42页。PPT课件主要包含了课前·新知导学,正反应速率,逆反应速率,不再改变,~500℃,接触面积,更充分,更多的热量,不完全,防止热等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第二册第二节 化学反应的速率与限度图文课件ppt: 这是一份高中化学人教版 (2019)必修 第二册第二节 化学反应的速率与限度图文课件ppt,文件包含人教版高中化学必修第二册第6章第2节基础课时10化学反应的限度化学反应条件的控制课件ppt、人教版高中化学必修第二册第6章第2节基础课时10化学反应的限度化学反应条件的控制学案doc等2份课件配套教学资源,其中PPT共49页, 欢迎下载使用。













