

青海高考化学三年(2021-2023)模拟题汇编-15探究性实验
展开青海高考化学三年(2021-2023)模拟题汇编-15探究性实验
一、单选题
1.(2023·青海玉树·统考三模)下列实验方案合理的是
A.除去Na2CO3溶液中混有少量NaHCO3杂质时,可加入足量NaOH溶液
B.用图所示的实验装置制备乙酸乙酯
C.向溶液中加入盐酸酸化的氯化钡溶液可鉴定溶液中是否含有
D.配制50 g质量分数为5%CuSO4溶液:将47.5 mL水加入到盛有2.5 g CuSO4·5H2O的烧杯中,搅拌溶解
2.(2023·青海西宁·统考二模)下列实验设计所得结论均正确的是
A.将氯水密闭放置一段时间,氯水的颜色变浅,说明氯气能与水反应
B.将制备乙酸乙酯后剩余的反应液加入碳酸钠溶液,有气泡产生,说明乙酸有剩余
C.将酸性高锰酸钾溶液分别加入到苯和甲苯溶液中并振荡,证明甲苯中的甲基可活化苯环
D.向蔗糖溶液中滴加稀硫酸,水浴加热,加入新制的悬浊液,无砖红色沉淀,说明蔗糖未发生水解
3.(2022·青海西宁·统考二模)用如图所示装置进行实验,能达到相应实验目的的是(尾气处理装置略)
选项
①中试剂
②中试剂
③中试剂
实验目的
装置
A
浓HNO3
铜片
水
验证NO2能与水反应生成NO
B
乙醇
Na
水
判定乙醇中活泼氢数目
C
苯与液溴的混合液
铁粉
AgNO3溶液
证明苯与液溴能发生取代反应
D
浓H2SO4
浓盐酸
CH3COONa溶液
比较盐酸与醋酸的酸性强弱
A.A B.B C.C D.D
4.(2021·青海西宁·统考一模)制造芯片用到高纯硅,用SiHCl3(沸点:31.85℃,SiHCl3遇水会剧烈反应,除生成H2SiO3、HCl外,还生成一种气体a)与过量H2在1100~1200℃反应制备高纯硅的装置如图所示(夹持装置和尾气处理装置略去),下列说法错误的是
A.实验时,先打开装有稀硫酸仪器的活塞,收集尾气验纯,再预热装置Ⅳ石英管
B.装置Ⅱ、Ⅲ中依次盛装的是浓H2SO4、温度高于32℃的温水
C.Ⅰ装置可用于二氧化锰固体与浓盐酸反应制备氯气
D.a气体为H2
二、工业流程题
5.(2023·青海玉树·统考三模)三氧化二锑(Sb2O3)作为阻燃剂可广泛用于尼龙、工程塑料(ABS)、合成树脂、纸张等。从砷锑烟尘(主要成分为Sb2O3、As2O3和少量SiO2、Ag)中提纯三氧化二锑的工艺流程如图:
已知:Sb2O3和As2O3均能溶于浓盐酸。
(1)“酸浸”时能提高酸浸速率的措施有 (写出一种),浸出渣的成分为 (填化学式)。
(2)“还原”时, AsCl3与Na3PO2反应生成As、Na3PO3和HCl的化学方程式为 ,根据Sb与As元素同主族推测,Na3PO2不宜过量的原因是 。
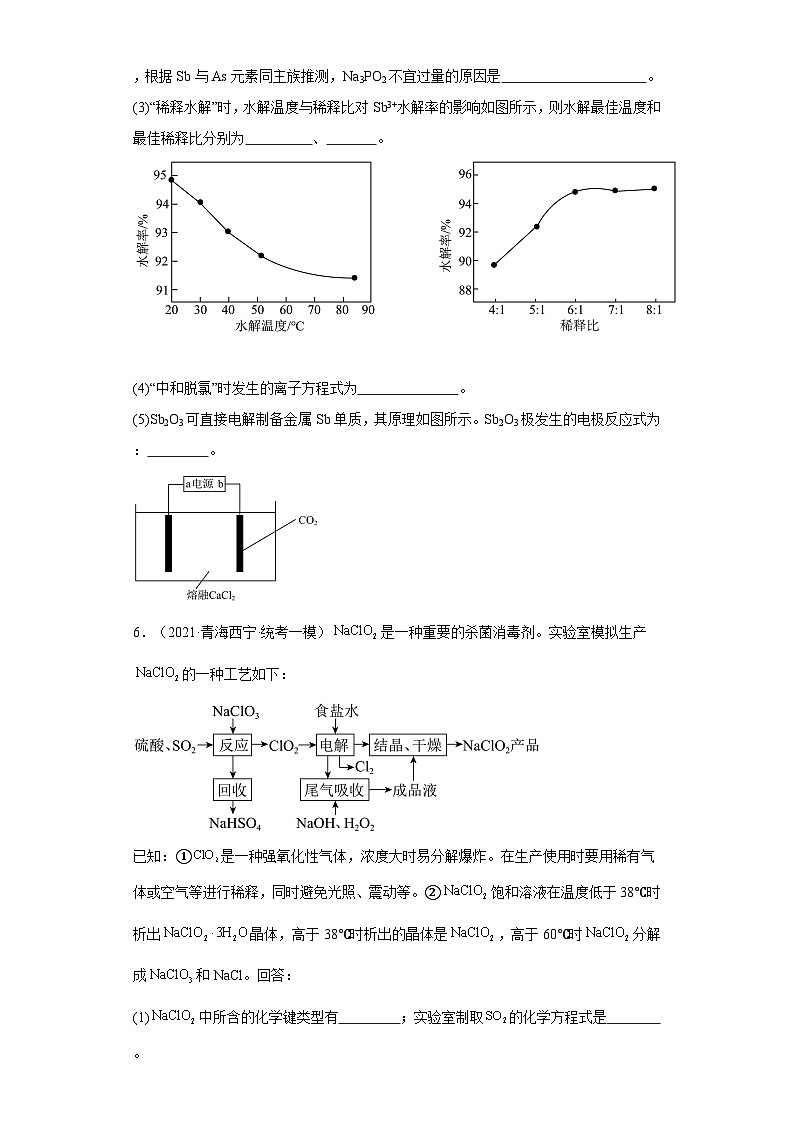
(3)“稀释水解”时,水解温度与稀释比对Sb3+水解率的影响如图所示,则水解最佳温度和最佳稀释比分别为 、 。
(4)“中和脱氯”时发生的离子方程式为 。
(5)Sb2O3可直接电解制备金属Sb单质,其原理如图所示。Sb2O3极发生的电极反应式为: 。
6.(2021·青海西宁·统考一模)是一种重要的杀菌消毒剂。实验室模拟生产的一种工艺如下:
已知:①是一种强氧化性气体,浓度大时易分解爆炸。在生产使用时要用稀有气体或空气等进行稀释,同时避免光照、震动等。②饱和溶液在温度低于38℃时析出晶体,高于38℃时析出的晶体是,高于60℃时分解成和NaCl。回答:
(1)中所含的化学键类型有 ;实验室制取的化学方程式是 。
(2)上述流程中“反应”的离子方程式为 ;尾气吸收时的作用是 。(填“氧化剂”或“还原剂”)。
(3)最近科学家又在“反应”步骤的基础上研究出用代替制备的新方法,其原理为:。该新方法最突出的优点是 。
(4)测定产品的纯度。取上述所得产品7.5g溶于水配成1L溶液,取出20.00mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应后(被还原为,杂质不参加反应),加入2~3滴淀粉溶液,用标准液滴定,达到滴定终点时,溶液呈 (填“蓝色”或“无色”),用去标准液24.00mL,计算产品的纯度 。(提示:)
7.(2021·青海海东·统考一模)某科学研究小组设计以辉钼矿(MoS2、CuFeS2、Cu2S及SiO2等)为原料制备少量钼酸铵的工艺流程如图:
已知:①“焙砂”中有MoO3、CuSO4、CuMoO4、Fe2O3、Fe2(SO4)3、SiO2。
②"氨浸"时,铜元素转化为[Cu(NH3)4](OH)2(深蓝色),钼元素转化为(NH4)2MoO4。
③[Cu(NH3)4](OH)2[Cu(NH3)4]2++2OH-。
回答下列问题:
(1)"焙烧"在马弗炉中进行。
①为了使辉钼矿充分培烧,需要采取的措施是 (写出一种)。
②马弗炉中逸出的气体可用 溶液吸收。
③MoS2转化成MoO3的化学方程式为 。
(2)"氨浸"时发生多个反应,其中CuMoO4被浸取的化学方程式为 。
(3)"滤渣Ⅰ"的成分有SiO2、 (填化学式)。
(4)"沉铜"是在80℃时进行的,铜沉淀完全的依据是 ,发生反应的离子方程式为 。
三、实验题
8.(2023·青海玉树·统考三模)氯化钡(BaCl2)是一种白色晶体,易溶于水,微溶于盐酸和硝酸,难溶于乙醇和乙醚,易吸湿,常用作分析试剂、脱水剂等。以BaS溶液为原料制备BaCl2·2H2O,并用重量法测定产品中BaCl2·2H2O的含量。某兴趣小组的实验方案如下:可选用试剂:NaCl固体、BaS溶液、浓H2SO4、 稀H2SO4、CuSO4溶液、蒸馏水。
步骤1: BaCl2·2H2O的制备
按如图所示装置(部分夹持仪器已省略)进行实验,得到BaCl2溶液,经一系列操作获得BaCl2·2H2O产品。
步骤2:产品中BaCl2·2H2O含量的测定
①称取产品0.5000 g,用100 mL水溶解,酸化,加热至近沸;
②在不断搅拌下,向①所得溶液中逐滴加入热的0.1000 mol· L-1 H2SO4溶液;
③沉淀完全后,在60 °C水浴中加热40 min,经过滤、洗涤、烘干等步骤,称量白色固体,其质量为0.4660g。
回答下列问题:
(1)在过滤操作中,下列仪器不需要用到的是 (填名称)。
(2)装置II中仪器b的作用是 ;III中的试剂应选用 。
(3)装置I是制取 (填化学式)气体的装置,在试剂a过量并微热时,发生的主要反应的化学方程式为 。
(4)沉淀过程中需加入过量的H2SO4溶液,原因是 。
(5)在沉淀过程中,某同学在加入一定量热的H2SO4溶液后,认为沉淀已经完全,判断沉淀已完全的方法是 。
(6)产品中BaCl2·2H2O的质量分数为 (保留三位有效数字)。
9.(2023·青海海东·统考三模)BaCl2·2H2O是中学重要的试剂。某小组以重晶石为原料制备氯化钡晶体。
实验(一)制备BaS并验证其气体产物(装置如图1)。
资料显示:重晶石与CO的主要反应如下。
主反应:
副反应:
(1)通入CO之前,先通入一段时间N2,这样操作的目的是 。
(2)从a、b、c、d中选择合适的一组试剂:(填标号) 。
B
C
D
E
a
品红溶液
NaOH溶液
澄清石灰水
溴水
b
溴水
品红溶液
澄清石灰水
酸性高锰酸钾溶液
c
酸性高锰酸钾溶液
溴水
NaOH溶液
品红溶液
d
品红溶液
溴水
品红溶液
澄清石灰水
(3)尾气用排水法收集,同时体现了资源利用和 。
实验(二)制备BaCl2·2H2O(装置如图2)。
(4)写出BaS和盐酸反应的化学方程式: ,观察到烧杯中产生黑色沉淀,黑色沉淀的化学式为 。
(5)实验完毕后,从BaCl2溶液中分离产品的操作是蒸发浓缩、 、过滤、洗涤、低温干燥。洗涤过程中,常温下,不断测定洗涤液的pH,当pH接近 时,表明已洗涤干净。
(6)实验室用11.65gBaSO4最终制得9.76gBaCl2·2H2O,则该过程中Ba的损耗率为 。
10.(2023·青海西宁·统考一模)硫脲[]是一种白色且具有光泽的晶体,熔点:176~178℃,温度过高时分解,易潮解,易溶于水,微溶于乙醚,常用于制造药物、染料、树脂、压塑粉等。实验室可通过硫氢化钙[]和氰氨化钙()制备硫脲,按要求回答问题。
(1)制备硫氢化钙悬浊液,装置如图甲所示。
①装置A的作用为 。
②为加快反应速率,可适当增加硫酸浓度,但硫酸浓度不能过大,原因是 。
③装置B中发生反应的离子方程式为 。
(2)备硫脲。将制得的硫氢化钙悬浊液转移到加热容器中,再加入氰氨化钙,在(80±5)℃下反应3h,制备硫脲粗品,制备装置如图乙所示。
①温度控制在(80±5)℃的加热方式为 。
②制备硫脲的化学方程式为 (只有两种生成物)。
③已知氰氨化钙遇水生成一种无色、具有强烈刺激性气味的气体,请设计简单实验证明处理的尾气的主要成分: 。
(3)分离提纯硫脲。将反应所得的悬浊液减压过滤,再将滤液蒸发浓缩、趁热过滤、冷却结晶,离心脱水干燥得到硫脲晶体。
①采用离心脱水干燥而不用加热干燥的原因是 。
②制备时所用原料为13.2gFeS,最终制得硫脲1.74g,硫脲的产率为 (保留3位有效数字)。
11.(2022·青海西宁·统考二模)三氯化铬(CrCl3)是常用的媒染剂和催化剂,易潮解,实验室利用重铬酸钠制备CrCl3·6H2O及其
相关产物的实验如下。回答相关问题:
[实验1]制备CrCl3·6H2O的实验流程如下。
(1)甲醛( HCHO)的作用为 ;“混合”时发生反应的化学方程式为 。
(2)“一系列操作”的具体步骤包括 、过滤。
[实验2]高温下氨气与无水CrCl3反应制备CrN。(夹持和加热仪器省略)
(3)仪器B的名称是 。
(4)B中的试剂名称是 ,其作用为 。
(5)处理尾气时,用E装置的优点是 。
(6)整套装置的不足之处为 ,改进的措施是 。
12.(2022·青海西宁·统考二模)正戊醚可用作油脂、生物碱的萃取剂,Grignard反应的溶剂。以正戊醇为原料制备正戊醚的反应原理、有关数据和实验装置(夹持仪器已省略)如下:
2CH3CH2CH2CH2CH2OHCH3CH2CH2CH2CH2OCH2CH2CH2CH2CH3+H2O
名称
相对分子质量
密度/(g·cm-3)
沸点/℃
水中溶解性
正戊醇
88
0.82
137.5
微溶
正戊醚
158
0.78
186.7
难溶
实验步骤:①向三颈烧瓶中加入43mL(约0.4mo1)正戊醇及6mL浓硫酸,摇动使混合均匀,再加入几粒沸石。
②按示意图连接装置,向分水器中预先加少量水(略低于直管口)。维持反应约1小时。
③待反应液冷却后依次用60mL水、30mL水、20mLNaOH溶液和20mL水洗涤。
④分离出的产物加入约3g无水氯化钙颗粒,静置一段时间过滤除去氯化钙。
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正戊醚15.8g。
回答下列问题:
(1)根据上述实验药品的用量,三颈烧瓶最适宜规格为_______。
A.100mL B.150mL C.250mL D.500mL
(2)将实验步骤②补全:按示意图连接装置,向分水器中预先加少量水(略低于直管口)。 ,维持反应约1小时。
(3)装置中分水器的作用是 ,判断反应已经完成的标志是 。
(4)洗涤粗正戊醚在 (填“仪器名称”)中进行;最后一次水洗的目的是 。
(5)本次实验的产率为(某种生成物的实际产量与理论产量的百分比) 。
13.(2022·青海海东·统考一模)碱式氯化铜[Cu(OH)xCly]为绿色或墨绿色的结晶性粉末,难溶于水,溶于稀酸和氨水,在空气中十分稳定。
Ⅰ.模拟制备碱式氯化铜。向CuCl2溶液中通入NH3,同时滴加稀盐酸,调节pH至5.0~5.5,控制反应温度于70~80℃,实验装置如图所示(部分夹持装置已省略)。
(1)仪器a的名称是 。
(2)实验室利用装置B制备NH3,圆底烧瓶中盛放的固体药品可能是 (填名称);仪器b的作用是 。
(3)反应过程中,在装置A中除观察到溶液蓝绿色褪去外,还可能观察到的现象是 。
(4)若滴入稀盐酸过量会导致碱式氯化铜的产量 (填“偏高”、“偏低”或“无影响”)。
(5)反应结束后,将装置A中反应容器内的混合物过滤,从滤液中还可以获得的副产品是 (填化学式),经提纯得产品无水碱式氯化铜。
Ⅱ.无水碱式氯化铜组成的测定。称取产品6.435g,加稀硝酸溶解,并加水定容至250mL,得到待测液。
(6)铜的测定:取100mL待测液,加入足量的氢氧化钠,经过滤,洗涤,低温烘干,称量得到的蓝色固体质量为2.352g。则称取的样品中n(Cu2+)为 mol。
(7)采用沉淀滴定法测定氯:准确量取25.00mL待测液于锥形瓶中,加入20mL0.2mol·L-1AgNO3溶液,充分反应后,加入少量聚乙烯醇溶液,用NH4SCN标准溶液滴定过量的AgNO3。滴加少量的Fe(NO3)3溶液作为指示剂。重复实验操作三次,消耗的0.1mol·L-1NH4SCN溶液的体积平均为10.00mL。
①达到滴定终点的现象为 。
②则称取的样品中n(Cl-)为 mol。
(8)根据上述实验结果可推知x:y= 。
14.(2021·青海西宁·校联考二模)无水三氯化铁常用于净水剂、印染的媒染剂,印刷制版时的腐蚀剂,在化学工业中还可制造其他铁盐,及处理肥皂提取粗甘油等。它具有易水解、易升华的性质。铁粉与氯气反应制备无水FeCl3的实验装置如图所示:
回答下列问题:
(1)装置A的作用是 ,通入氯气后,装置A中观察到有酸雾产生,原因是 。
(2)装置C中P2O5的作用是 ,请写出装置D中发生反应的化学方程式: 。
(3)在E、G处收集产物是利用了FeCl3 的性质;实验过程中若F处出现堵塞,则在B处可观察到的现象是 。
(4)装置H的作用是 ;装置I中发生反应的离子方程式是 。
(5)某同学用11.2g干燥铁粉制得无水FeCl3样品29.9g,该次实验的产率是 。
(6)实验室中还常用SOCl2与FeCl3·6H2O晶体共热制备无水FeCl3,其化学反应方程式为 。
15.(2021·青海西宁·统考三模)亚氯酸钠(NaClO2)是一种高效漂白剂,其有效氯含量相当于漂白粉的7倍。可用ClO2与过氧化氢为原料制取亚氯酸钠,相关实验装置如图所示。请回答:
已知:
①2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O;
②2ClO2+2NaOH=NaClO2+NaClO3+H2O;
③已知NaClO2饱和溶液在温度低于38℃时析出NaClO2·3H2O晶体,高于38℃时析出NaClO2晶体,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)仪器B的作用是 。
(2)写出装置C中制备NaClO2固体的化学方程式: 。冰水浴冷却的目的是 (写两种)。
(3)在装置A中发生反应生成NaClO2,反应过程中放出大量的热。
①研究表明,实验时装置C中H2O2与NaOH的物料比需要控制在0.8左右,原因可能是 。
②在吸收液中H2O2和NaOH的物料比、浓度和体积不变的条件下,控制反应在0~3℃进行,实验中可采取的措施是 。
(4)尾气吸收时,一般用 溶液吸收过量的ClO2。
(5)为了测定NaClO2粗品的纯度,取上述粗产品a g溶于水配成1 L溶液,取出10 mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应后(NaClO2被还原为Cl-,杂质不参加反应),加入2~3滴淀粉溶液,用0.20 mol·L-1 Na2S2O3标准液滴定,达到滴定终点时用去标准液V mL,试计算NaClO2粗品的纯度 (提示:2Na2S2O3+I2=Na2S4O6+2NaI)
(6)下列关于该实验及样品组成分析的说法,正确的是 (填字母)。
A.装置C中制得的NaClO2固体中可用略低于38℃的热水洗涤2~3遍
B.装置C中制得的NaClO2固体后的操作包括过滤、洗涤和干燥
C.如果撤去装置C中的冰水浴,可能导致产品中混有的杂质是NaClO3和NaCl
D.装置A中空气流速过快或过慢,均会增大NaClO2的产率
参考答案:
1.B
【详解】A.加入足量NaOH溶液会引入氢氧化钠新杂质,实验方案不合理,故A不符合题意;
B.乙酸和乙醇在浓硫酸催化作用下生成乙酸乙酯,生成乙酸乙酯使用b试管冷凝回收,饱和碳酸钠溶液可以吸收挥发的乙酸、乙醇且利于乙酸乙酯的分层,实验方案合理,故B符合题意;
C.若溶液中含有银离子也会出现不溶于酸的白色沉淀,不能检验硫酸根离子,实验方案不合理,故C不符合题意;
D.配制50 g质量分数为5%CuSO4溶液需要CuSO4·5H2O,应该将3.9g CuSO4·5H2O溶于水配成50g溶液,实验方案不合理,故D不符合题意;
故选B。
2.A
【详解】A.氯气和水生成的次氯酸容易分解为盐酸、氧气,氯水放置一段时间,氯水的颜色变浅,说明氯气能与水反应,故A正确;
B.酯化反应中使用浓硫酸作催化剂,硫酸和碳酸钠反应生成二氧化碳气体,不能证明乙酸剩余,故B错误;
C.将酸性高锰酸钾溶液分别加入到苯和甲苯溶液中并振荡,苯不能是酸性高锰酸钾溶液褪色、甲苯能使酸性高锰酸钾溶液褪色,证明甲苯中的苯环活化了甲基,故C错误;
D.检验葡萄糖的反应需要在碱性条件下进行,故应该先加入氢氧化钠除去过量稀硫酸后在进行实验,故D错误;
故选A。
3.A
【详解】A.浓HNO3与铜反应会生成NO2,若NO2与水反应会生成NO,NO为无色气体,逸出后在水的表面气体开始为无色,但逐渐会与空气中氧气反应生成红棕色气体NO2,可实现验证,故A正确;
B.乙醇与钠单质反应生成氢气,氢气密度比空气和水小,且不溶于水,可根据收集的氢气确定乙醇中的活泼氢数目,但未给出试剂的用量,且该装置无法收集氢气,故B错误;
C.液溴具有良好挥发性,铁与Br2反应为放热反应,能够加速液溴挥发,溴单质与水反应能生成HBr,HBr与AgNO3溶液反应生成淡黄色沉淀AgBr,无法验证该HBr是苯与液溴反应产生,故C错误;
D.浓硫酸和浓盐酸混合是快速制HCl,但HCl与CH3COONa反应无现象,因此无法判断,故D错误;
综上所述,能达到目的的是A项,故答案为A。
4.C
【详解】A.实验时,先打开装有稀硫酸仪器的活塞,稀硫酸和锌反应生成氢气,利用氢气将装置中的空气赶出,收集尾气验纯后,再预热装置Ⅳ石英管,故A正确;
B.由于SiHCl3遇水会剧烈反应,装置Ⅱ中应装有浓硫酸吸收氢气中的水蒸气,SiHCl3的沸点为31.85℃,所以Ⅲ中盛装的是温度高于32℃的温水,使SiHCl3成为蒸气和氢气进入Ⅳ中反应,故B正确;
C.二氧化锰固体与浓盐酸反应制备氯气需要加热,故Ⅰ装置不能用于实验室二氧化锰固体与浓盐酸反应制备氯气,故C错误;
D.SiHCl3和水反应,生成H2SiO3、HCl和气体a,根据质量守恒,可知气体为H2,故D正确;
故选C。
5.(1) 适当提高温度、适当提高盐酸浓度、搅拌等 SiO2、Ag
(2) 防止将SbCl3还原而导致Sb损失
(3) 20℃ 6:1
(4)
(5)
【分析】砷锑烟尘加入盐酸酸溶,SiO2、Ag不反应成为浸出渣,砷锑氧化物转化为盐溶液,滤液加入Na3PO2,AsCl3与Na3PO2反应As被还原为As,同时生成Na3PO3,过滤滤液水解得到SbOCl,加入氨水得到Sb2O3;
【详解】(1)“酸浸”时能提高酸浸速率的措施有适当提高温度、适当提高盐酸浓度、搅拌等,浸出渣的成分为SiO2、Ag;
(2)“还原”时,AsCl3与Na3PO2反应生成As、Na3PO3和HCl,反应中As化合价由+3变为0,P化合价由+1变为+3,根据电子守恒和质量守恒配平得化学方程式:;根据Sb与As元素同主族,化学性质相似,Na3PO2不宜过量的原因是防止将SbCl3还原而导致Sb损失;
(3)由图可知,水解最佳温度和最佳稀释比分别为20℃、6:1,此时水解率较高;
(4)“中和脱氯”时,SbOCl和加入氨水反应得到Sb2O3,根据质量守恒可知,还会生成氯化铵和水,发生的离子方程式为;
(5)Sb2O3可直接电解制备金属Sb单质,Sb2O3得到电子发生还原反应生成Sb,发生的电极反应式为:。
6. 离子键、共价键 还原剂 反应生成对起稀释作用,防止浓度过大时分解爆炸 无色 90.5%
【分析】实验流程中反应:,流程中电解反应为,ClO2尾气吸收用氢氧化钠和过氧化氢反应,也得到NaClO2溶液,获得NaClO2操作的步骤时①加热蒸发,②趁热过滤,③洗涤,④干燥,得到成品。
【详解】(1) 中阴离子和阳离子之间为离子键,氯原子和氧原子之间为共价键,故含有离子键和共价键;实验室制取的化学方程式是;
(2) 上述流程中“反应”的离子方程式为;尾气吸收时过氧化氢在反应中化合价升高,做还原剂;
(3)用硫酸酸化的草酸溶液还原氯酸钠,其优点是提高了生产及储存、运输的安全性,源信使反应过程产生的二氧化碳气体对起到了稀释作用;
(4) 用标准液滴定,达到滴定终点时,溶液呈无色;与足量酸化的KI溶液,反应为,令样品中的物质的量为x,则,解得x=1.25×10-3mol,10mL样品中m()=0.00125mol×90.5g/mol,原样品中的质量分数为:。
7. 将辉钼矿粉碎或延长焙烧时间 NaOH Fe2O3 、 深蓝色溶液变为无色
【分析】辉钼矿(MoS2、CuFeS2、Cu2S及SiO2等)在空气中焙烧得到“焙砂”, “焙砂”中有MoO3、CuSO4、CuMoO4、Fe2O3、Fe2(SO4)3、SiO2,加入氨水,铜元素转化为[Cu(NH3)4](OH)2(深蓝色),钼元素转化为(NH4)2MoO4,Fe2O3、SiO2不溶解,成为滤渣,Fe2(SO4)3转化为氢氧化铁沉淀析出,向滤液中加入硫化铵,形成硫化铜沉淀析出,过滤后,把滤液蒸发浓缩,冷却结晶得到钼酸铵。
【详解】(1)①为使辉钼矿充分焙烧,可将辉钼矿粉碎,增大与空气的接触面积,或者延长焙烧的时间,故答案为:将辉钼矿粉碎或延长焙烧时间;
②比较辉钼矿的成分及焙砂的成分可知,辉钼矿中含硫化合物与氧气反应生成二氧化硫及硫酸根离子,所以马弗炉中逸出的气体是二氧化硫,应用氢氧化钠溶液吸收,故答案为:NaOH;
③MoS2与空气中的氧气反应生成MoO3和二氧化硫气体,化学方程式为故答案为:;
(2)根据已知信息,氨浸时,铜元素转化为氢氧化四氨合铜,钼元素转化为钼酸铵,所以其化学方程式为,故答案为:;
(3)流程图最终得钼酸铵,所以Fe元素应在氨浸中除去,氧化铁不与氨水反应,铁离子与氨水反应生成氢氧化铁沉淀, ,则滤渣1的成分除二氧化硅外还有Fe2O3 、 ,故答案为:Fe2O3 、 ;
(4)由于CuS更难溶,所以沉铜时,Cu元素以黑色CuS沉淀除去,沉淀完全时深蓝色溶液变为无色,则铜沉淀完全的依据是深蓝色溶液变为无色;由已知信息可知,氢氧化四氨合铜是强电解质,[Cu(NH3)4]2+与 反应生成氨气和CuS沉淀,该反应是在80℃时进行的,所以铵根离子与氢氧根离子反应也生成氨气,则反应的离子方程式为,故答案为:。
8.(1)锥形瓶
(2) 防止倒吸 CuSO4溶液
(3) HCl NaCl+H2SO4(浓)NaHSO4+HCl↑
(4)使钡离子沉淀完全
(5)静置,往上层清液中继续滴加硫酸溶液,若无白色沉淀出现,则已沉淀完全;
(6)97.6%
【分析】装置I中浓硫酸和氯化钠共热制备HCl,装置II中氯化氢与BaS溶液反应制备BaCl2·2H2O,装置III中硫酸铜溶液用于吸收生成的H2S,防止污染空气。
【详解】(1)过滤需要漏斗、烧杯和玻璃棒,不需要锥形瓶;
(2)HCl极易溶于水,装置b可以防止倒吸;装置Ⅱ中氯化氢与BaS溶液反应生成H2S,H2S有毒,对环境有污染,装置Ⅲ中盛放CuSO4溶液,用于吸收H2S;
(3)用BaS溶液和HCl反应可以制取氯化钡,所以装置I的作用是利用浓硫酸和NaCl固体共热制取HCl;化学方程式为NaCl+H2SO4(浓)NaHSO4+HCl↑;
(4)本实验中需要通过测定硫酸钡沉淀的量来计算BaCl2·2H2O的含量,所以需要保证钡离子完全沉淀,所以需要加入过量的硫酸溶液;
(5)判断沉淀已完全的方法是:静置,往上层清液中继续滴加硫酸溶液,若无白色沉淀出现,则已沉淀完全;
(6)最终所得硫酸钡的物质的量为=0.002mol,根据Ba原子守恒可知BaCl2·2H2O的物质的量也为0.002mol,含量为×100%=97.6%。
9.(1)排尽装置内的空气,避免O2干扰实验
(2)d
(3)环境保护
(4) CuS
(5) 冷却结晶 7
(6)20%
【分析】验证SO2、CO2,试管B中装有品红溶液,SO2具有漂白性能使溶液褪色,试管C中装有溴水,能与二氧化硫反应生成HBr和硫酸,试管D中再用品红溶液检验除尽,最后试管E中用澄清石灰水检验CO2;
【详解】(1)装置内含有氧气,能与CO反应,通入CO之前,先通入一段时间N2,这样操作的目的是:排尽装置内的空气,避免O2干扰实验;
(2)根据主、副反应可知可能含CO2、SO2,先验证SO2、除去SO2,再检验CO2,即试管B中装有品红溶液,观察溶液褪色,试管C中装有溴水,能与二氧化硫反应生成HBr和硫酸,由于NaOH也能与CO2反应而除去故不能选,试管D中再用品红溶液检验除尽,最后试管E中用澄清石灰水检验CO2,故选d;
(3)SO2是有毒气体,排放到空气中会形成酸雨,CO2会造成温室效应,尾气用排水法收集,同时体现了资源利用和环境保护;
(4)BaS和盐酸反应生成氯化钡和硫化氢气体,反应的化学方程式:;H2S气体进入烧杯中与硫酸铜反应产生黑色沉淀为CuS;
(5)从BaCl2溶液中分离产品BaCl2·2H2O,操作是蒸发浓缩、冷却结晶、过滤、洗涤、低温干燥;BaCl2·2H2O晶体残留酸液,加水洗涤,不断测定洗涤液的pH,常温下,当pH接近7时,为中性,表明已洗涤干净;
(6)11.65gBaSO4的物质的量为,原料中Ba的物质的量为0.05mol,9.76gBaCl2·2H2O的物质的量为,产品中Ba的物质的量为0.04mol,该过程中Ba的损耗率为。
10.(1) 为目标反应提供H2S 硫酸浓度过大时,浓硫酸具有强氧化性,将或H2S氧化,不利于生成H2S
(2) 水浴加热 将气体通入滴有酚酞的蒸馏水中,溶液由无色变为红色,证明尾气的主要成分是氨气
(3) 硫脲直接加热干燥易分解 61.1%
【分析】先将H2S通入澄清石灰水中制备硫氢化钙悬浊液,再将制得的硫氢化钙悬浊液和氰氨化钙反应制备硫脲,将反应所得的悬浊液减压过滤,再将滤液蒸发浓缩、趁热过滤、冷却结晶,离心脱水干燥得到硫脲晶体,并计算产率。
【详解】(1)①制备硫氢化钙悬浊液,需要将H2S通入澄清石灰水中,所以是为目标反应提供H2S;
②浓硫酸具有强氧化性,会将或H2S氧化,不利于生成H2S,所以硫酸的浓度不宜过大;
③装置B是H2S通入澄清石灰水中制备硫氢化钙悬浊液,反应的化学方程式为。
(2)①温度控制在(80±5)℃,不超过100℃,采用的加热方式是水浴加热;
②用硫氢化钙悬浊液和氰氨化钙制备硫脲,产物只有两种,故化学方程式为;
③由氰氨化钙(CaCN2)的组成元素可推知无色有刺激性气味的气体为NH3,氰氨化钙与水反应的化学方程式为,检验氨气的方法有将气体通入滴有酚酞的蒸馏水中,溶液由无色变为红色。
(3)①由题干信息知,温度过高时硫脲易分解,若用加热干燥,硫脲易分解,所以采用离心脱水干燥;
②由制备过程中的关系式可知13.2 g FeS理论上可以制备的质量为,硫脲的产率为。
11.(1) 作还原剂 2Na2Cr2O7+3HCHO+2H2SO4+H2O=3CO2↑+4Cr(OH)3↓+2Na2SO4
(2)蒸发浓缩、冷却结晶
(3)球形干燥管
(4) 碱石灰 干燥氨气
(5)防倒吸
(6) CD之间的导管太细,容易堵塞 换成粗导管
【分析】[实验2]装置A用浓氨水和生石灰反应得到氨气,经装置B的碱石灰干燥氨气,氨气与无水CrCl3反应制备CrN和HCl,装置D装有碱石灰防止水蒸气进入C中,装置E用于吸收尾气;
【详解】(1)“混合”时Na2Cr2O7→Cr(OH)3中Cr元素化合价降低,Na2Cr2O7做氧化剂,则加入甲醛( HCHO)做还原剂,被氧化为CO2,发生反应的化学方程式为2Na2Cr2O7+3HCHO+2H2SO4+H2O=3CO2↑+4Cr(OH)3↓+2Na2SO4;
(2)从CrCl3溶液中得到CrCl3·6H2O晶体,“一系列操作”的具体步骤包括蒸发浓缩、冷却结晶、过滤;
(3)仪器B的名称是球形干燥管;
(4)B中的试剂名称是碱石灰,其作用为干燥氨气;
(5)处理尾气时,气体短进长处且有导管维持压强稳定,可吸收HCl和多余的NH3,其极易溶于水会形成倒吸,用E装置的优点是防倒吸;
(6)整套装置的不足之处为CD之间的导管太细,容易堵塞,改进的措施是换成粗导管。
12.(1)A
(2)通入冷却水,加热三颈烧瓶至110℃
(3) 分离出反应生成的水,使正戊醇回流至烧瓶中继续反应 水层高度不变
(4) 分液漏斗 洗去有机层中残留的NaOH和反应生成的Na2SO4
(5)50%
【详解】(1)43mL(约0.4mo1)正戊醇及6mL浓硫酸,混合液的总体积为43mL+6mL=49mL,溶液体积不超过三颈烧瓶体积的,所以三颈烧瓶的最佳容积为100mL,答案选A。
(2)依据题意可知,步骤②为:按示意图连接装置,向分水器中预先加少量水(略低于直管口),然后将冷凝水从球形冷凝管的下口通入,再给三颈烧瓶加热至温度为110℃,维持反应约1小时。
(3)反应产物中有水,而正戊醇沸点较低,在水中微溶,反应生成的醚、水及挥发的未反应的醇进入分水器,分水器能在分离出水的同时,还可以使正戊醇回流至烧瓶中继续反应,提高原料利用率;若反应完全,则不再有正戊醇挥发冷凝进入分水器中,分水器液面不再升高,此时说明反应已经完成。
(4)正戊醚难溶于水,洗涤时应在分液漏斗中洗涤、分液,氢氧化钠与硫酸反应生成了亚硫酸,最后一次水洗的目的是:洗去有机层中残留的NaOH和反应生成的Na2SO4。
(5)依据方程式2CH3CH2CH2CH2CH2OHCH3CH2CH2CH2CH2OCH2CH2CH2CH2CH3+H2O可知,当有0.4mo1正戊醇参与反应,理论上生成0.2mol正戊醚,质量为0.2mol158g/mol=31.6g,则产率为=50%。
13.(1)三颈烧瓶
(2) 碱石灰 导气、防止倒吸
(3)溶液中有大量墨绿色固体产生、干燥管中有液体上升后下降的现象
(4)偏低
(5)NH4Cl
(6)0.06
(7) 加入最后一滴标准液,溶液变为(浅)红色 0.03
(8)3:1
【解析】(1)
仪器a的名称为三颈烧瓶;
(2)
由于氨水中存在平衡:NH3+H2ONH3·H2O,碱石灰遇水发生反应使溶液中c(OH-)浓度增大,促进平衡逆向移动,且碱石灰遇水放热促进氨气的挥发,故可利用碱石灰与浓氨水制取氨气,故此处填:碱石灰;仪器b为球形干燥管,可防止NH3在三颈烧瓶中溶解后产生倒吸,故此处填:导气、防止倒吸;
(3)
在三颈烧瓶内,氯化铜、氨气和盐酸反应制取碱式氯化铜,碱式氯化铜为绿色或墨绿色结晶性粉末,难溶于水,故实验现象①为溶液中有大量墨绿色固体产生;干燥管中充满了氨气,反应后气体的压强迅速减小,故实验现象②为干燥管中有液体上升后下降的现象;
(4)
由于碱式氯化铜溶于稀酸和氨水,故稀盐酸过量会导致碱式氯化铜的溶解,进而导致其产量偏低,故此处填:偏低;
(5)
该反应为氯化铜、氨气和盐酸反应,部分氨气会和盐酸反应生成氯化铵,作为副产物,故此处填:NH4Cl;
(6)
产品溶于稀硝酸后,溶液中主要含有Cu2+、Cl-、,加入NaOH溶于后生成Cu(OH)2沉淀,由题意知n[Cu(OH)2]=,则样品中n(Cu2+)= n[Cu(OH)2]×=0.06 mol;
(7)
①当达到滴定终点后,稍过量的NH4SCN遇Fe3+变红,故滴定终点现象为:加入最后一滴标准液,溶液变为(浅)红色;
②由题意知,测定氯采用的是返滴定法,AgNO3与NH4SCN 1:1反应生成AgSCN沉淀,则过量的AgNO3物质的量n(AgNO3,余)=n(NH4SCN)=0.1 mol/L×10.00 mL×10-3 L/mL=1×10-3 mol,则与Cl-反应的AgNO3物质的量n(AgNO3)= n(AgNO3,总)- n(AgNO3,余)= 0.2 mol/L×20.00 mL×10-3 L/mL-1×10-3 mol=3×10-3 mol,则样品中n(Cl-)= n(AgNO3)×=0.03 mol;
(8)
根据电荷守恒2n(Cu2+)= n(Cl-)+ n(OH-),得2×0.06 mol=0.03 mol+ n(OH-),解得n(OH-)=0.09 mol,则x:y= n(OH-):n(Cl-)=0.09:0.03=3:1。
14. 干燥Cl2 潮湿的氯气通过浓硫酸时,水与浓硫酸相遇放出大量的热使三氧化硫逸出,三氧化硫遇到瓶内空气中的水蒸气形成酸雾 除去酸雾 易升华 B处有气泡产生 防止装置I中水蒸气进入装置G中使氯化铁发生水解 Cl2+2OH-=Cl-+ClO-+H2O 92%
【分析】该实验的目的是制备FeCl3;由于FeCl3易水解,故要先将潮湿Cl2通过装置A,以获得干燥的Cl2,其中潮湿的氯气通过浓硫酸时,水与浓硫酸相遇放出大量的热使三氧化硫逸出,三氧化硫遇到瓶内空气中的水蒸气形成酸雾,故需要装置C来除去酸雾;装置D为Fe和Cl2反应生成FeCl3的装置;装置E、G为FeCl3的收集装置;装置B、I为Cl2的吸收装置;由于FeCl3易升华,在E、G中可得到固体FeCl3,则有部分FeCl3固体会在F中积累,可能会引起堵塞,这时Cl2会进入到B中被吸收以防止污染环境;为防止装置I中的水蒸气进入G中,需装置H来吸收装置I中的水蒸气,以防止G中FeCl3水解。
【详解】(1)装置A的作用是干燥Cl2,以获得干燥的Cl2;通入Cl2后,装置A中观察到有酸雾产生,其原因是潮湿的氯气通过浓硫酸时,水与浓硫酸相遇放出大量的热使三氧化硫逸出,三氧化硫遇到瓶内空气中的水蒸气形成酸雾;
(2)装置C中P2O5的作用是除去酸雾;D中Fe和干燥的Cl2发生反应,化学方程式为;
(3)在E、G处收集产物是利用了FeCl3易升华的性质;若F处出现堵塞,在B处可观察到有气泡产生;
(4)FeCl3易潮解,装置H可以防止装置I中水蒸气进入装置G中使氯化铁发生水解;装置I用来吸收Cl2,相应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O;
(5)n(Fe)===0.2mol,则理论上,反应产生0.2mol FeCl3,即32.5g,则该次实验的产率为=92%;
(6)该反应的化学方程式为。
15. 防止倒吸 2ClO2+H2O2+2NaOH=2ClO2+O2↑+2H2O 减少H2O2的分解、提高ClO2的溶解度 H2O2受热易分解,配料时应略过量;同时防止ClO2与NaOH反应生成杂质 使用冰水浴,且缓慢通入ClO2 NaOH BC
【分析】按图组装好仪器后,检查装置的气密性;装置A中发生2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O;装置B的作用是防止倒吸;装置C中冰水浴冷却的主要目的降低反应速率,减少H2O2的分解减少ClO2的分解;装置C中加入NaOH溶液的目的除了作反应物外,还因为NaClO2遇酸放出ClO2,需用NaOH溶液吸收ClO2;空气流速过慢时,ClO2不能及时被移走,浓度过高导致分解爆炸,空气流速过快时,ClO2不能被充分吸收,NaClO2的产率下降。根据关系式NaClO2~2I2~4S2O计算产品的纯度。
【详解】(1)仪器B的作用是防止倒吸。故答案为:防止倒吸;
(2)装置C中制备NaClO2固体的化学方程式:2ClO2+H2O2+2NaOH=2ClO2+O2↑+2H2O。冰水浴冷却的目的是减少H2O2的分解、提高ClO2的溶解度 (写两种)。故答案为:2ClO2+H2O2+2NaOH=2ClO2+O2↑+2H2O;减少H2O2的分解、提高ClO2的溶解度;
(3)①实验时装置C中H2O2与NaOH的物料比需要控制在0.8左右,原因可能是H2O2受热易分解,配料时应略过量;同时防止ClO2与NaOH反应生成杂质。故答案为:H2O2受热易分解,配料时应略过量;同时防止ClO2与NaOH反应生成杂质;
②在吸收液中H2O2和NaOH的物料比、浓度和体积不变的条件下,控制反应在0~3℃进行,实验中可采取的措施是使用冰水浴,且缓慢通入ClO2。故答案为:使用冰水浴,且缓慢通入ClO2;
(4)尾气吸收时,根据2ClO2+2NaOH=NaClO2+NaClO3+H2O,一般用NaOH溶液吸收过量的ClO2。故答案为:NaOH;
(5)NaClO2与足量酸化的KI溶液,反应为:ClO2-+4I-+4H+→2H2O+2I2+Cl-,则:由关系式NaClO2~2I2~4S2O,n(NaClO2)= n(S2O)=×0.2mol/L×10-3VL=5×10-5Vmol,10mL样品中m(NaClO2)=5×10-5Vmol×90.5g/mol=4.525×10-3Vg,原样品中NaClO2的质量分数为: =;故答案为:;
(6)A.NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl,装置C中制得的NaClO2固体中可用用38℃~60℃的温水洗涤2~3遍,故A错误;
B.装置C中制得的NaClO2固体后的操作包括趁热过滤, 用38℃~60℃的温水洗涤,低于60℃干燥,得到成品,故B正确;
C.高于60℃时NaClO2分解成NaClO3和NaCl,如果撤去装置C中的冰水浴,可能导致产品中混有的杂质是NaClO3和NaCl,故C正确;
D.装置A中空气流速过慢时,ClO2不能及时被移走,浓度过高导致分解爆炸,空气流速过快时,ClO2不能被充分吸收,NaClO2的产率下降,故D错误;
故答案为:BC。
新疆高考化学三年(2021-2023)模拟题汇编-26探究性实验: 这是一份新疆高考化学三年(2021-2023)模拟题汇编-26探究性实验,共27页。试卷主要包含了单选题,实验题,工业流程题等内容,欢迎下载使用。
新疆高考化学三年(2021-2023)模拟题汇编-26探究性实验: 这是一份新疆高考化学三年(2021-2023)模拟题汇编-26探究性实验,共27页。试卷主要包含了单选题,实验题,工业流程题等内容,欢迎下载使用。
山西高考化学三年(2021-2023)模拟题汇编-26探究性实验: 这是一份山西高考化学三年(2021-2023)模拟题汇编-26探究性实验,共33页。试卷主要包含了实验题,工业流程题,填空题等内容,欢迎下载使用。












