

【暑假提升】人教版2019化学高一(升高二)暑假预习-(选修1)第03讲 盖斯定律 讲学案
展开第03讲 盖斯定律
知识导航 小杨老师 15521324728 侵权必究
课前导入
热化学方程式可以表明反应所放出或吸收的热量,而一个反应所放出或吸收的热量,需要通过实验测量得到。如测量1mol C完全燃烧生成1mol CO2所放出的热量,就可以写出相关的热化学方程式。
但如果一个反应不容易直接发生,或者伴有副反应发生时,又该如何测量呢?杨sir化学,侵权必究
模块一 盖斯定律
知识预习 小杨老师 15521324728 侵权必究
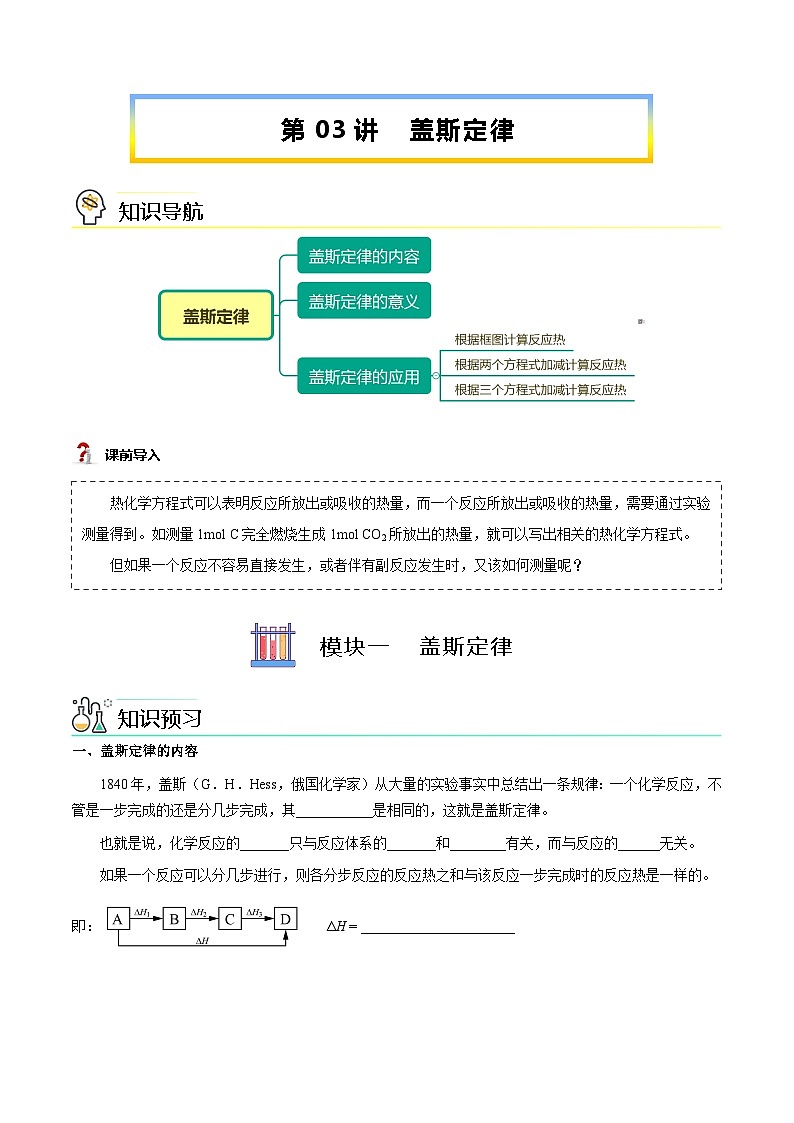
一、盖斯定律的内容
1840年,盖斯(G.H.Hess,俄国化学家)从大量的实验事实中总结出一条规律:一个化学反应,不管是一步完成的还是分几步完成,其___________是相同的,这就是盖斯定律。杨sir化学,侵权必究
也就是说,化学反应的_______只与反应体系的_______和________有关,而与反应的______无关。
如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是一样的。
即: ΔH = ______________________杨sir化学,侵权必究
【答案】反应热;反应热;始态;终态;途径 ΔH1 + ΔH2 + ΔH3
二、盖斯定律在生产和科学研究中的意义
科学史话:热化学研究的先驱——盖斯
1802年,盖斯出生于瑞士的日内瓦,三岁时全家迁居俄国。1825年,盖斯获得医学博士学位,1838年当选为俄国科学院院士。杨sir化学,侵权必究
最早研究反应热的是法国化学家拉瓦锡和法国数学家、天文学家拉普拉斯(P.-S.Laplace,1749―1827) , 他们利用冰量热计(即以被熔化了的冰的质量来计算热量)测定了碳单质的燃烧热,测得的数值与现代精确测定值十分接近。1836年,盖斯受炼铁中热现象的启发,利用自己设计的量热计测定了大量的反应热,并依据氨水、氢氧化钠、氢氧化钾、石灰分别与硫酸反应的反应热总结出了盖斯定律。
盖斯定律的提出,为反应热的研究提供了极大的方便,使一些不易测准或无法测定的化学反应的反应热可以通过推算间接求得。盖斯定律的提出要早于能量守恒定律的确认,因此,盖斯定律是化学热力学发展的基础,至今仍有广泛的应用。杨sir化学,侵权必究
三、盖斯定律的应用
根据盖斯定律,我们可以利用已知反应的反应热来计算未知反应的反应热。如:
对于前面提到的反应:C(s) + 12 O2(g) === CO(g) 虽然该反应的反应热无法直接测定,但下列两个反应的反应热却可以直接测定:
C(s) + O2(g) === CO2(g) ΔH1 =﹣393.5 kJ/mol
CO(g) + 12 O2(g) === CO2(g) ΔH2 =﹣283.0 kJ/mol
上述三个反应具有如下关系:
根据盖斯定律,ΔH3 =_________________________________________________
【答案】 ΔH1 - ΔH2 =﹣393.5 kJ/mol -(-283.0 kJ/mol)= -110.5 kJ/mol
对点训练 小杨老师 15521324728 侵权必究
命题点一:盖斯定律的理解
【例1】下列叙述不正确的是( )
A.化学反应的反应焓变不仅与反应体系的始态和终态有关,也与反应的途径有关
B.盖斯定律遵守能量守恒定律
C.利用盖斯定律可间接计算难以通过实验测定的反应的反应焓变杨sir化学,侵权必究
D.利用盖斯定律可以计算有副反应发生的反应的反应焓变
【答案】A
【详解】
A.化学反应的反应焓变只与反应体系的始态和终态有关,而与反应的途径无关,故A错误;
B.反应物和生成物的总能量一定,变化过程中的能量变化遵循能量守恒,而盖斯定律是能量守恒定律的具体体现,故B正确;
C.盖斯定律实际上是“内能和焓是状态函数”这一结论的进一步体现,利用这一定律可以从已经精确测定的反应的反应焓变来计算难于测定或不能测定的反应的反应焓变,故C正确;
D.利用盖斯定律可以从已经精确测定的反应的反应焓变来计算有副反应发生的反应的反应焓变,故D正确;
故选A。
【变1-1】下列说法不正确的是( )
A.应用盖斯定律,可计算某些难以测定的反应焓变
B.一个化学反应的焓变与反应途径无关
C.在特定条件下反应热可以等于焓变
D.一个反应一步完成或分几步完成,两者相比,经过的步骤越多,放出的热量越多
【答案】D
【详解】
A.有些化学反应的焓变难以测定,应用盖斯定律,通过易测定反应的焓变,可计算某些难以测定的反应焓变,A说法正确;
B.一个化学反应的焓变与反应的始态和终态有关,与反应途径无关,B说法正确;
C.在特定条件下反应热可以等于焓变,如燃烧热,C说法正确;
D.一个反应一步完成或分几步完成,两者相比,根据盖斯定律,经过不同的步骤,反应的焓变是相同的,D说法错误;
答案为D。
【变1-2】下列关于盖斯定律的说法不正确的是( )
A.不管反应是一步完成还是分几步完成,其反应热相同
B.反应热只与反应体系的始态和终态有关,而与反应的途径无关
C.有些反应的反应热不能直接测得,可通过盖斯定律间接计算得到
D.根据盖斯定律,热化学方程式中△H直接相加即可得总反应热
【答案】D
【详解】
A.盖斯定律指若是一个反应可以分步进行,则各步反应的吸收或放出的热量总和与这个反应一次发生时吸收或放出的热量相同,A正确;
B.反应物的总能量与产物的总能量决定反应热效应,所以反应热只与反应体系的始态和终态有关,而与反应的途径无关,B正确;
C.有些反应很慢,有的反应有副反应,其反应热通过实验测定有困难,可以用盖斯定律间接计算出来,C正确;
D.方程式按一定系数比加和时其反应热也按该系数比加和,D错误.
答案选D。
【例2】下列与化学反应能量变化相关的叙述正确的是( )杨sir化学,侵权必究
A.为“-”时,表示该反应为吸热反应
B.反应热的大小与生成物所具有的能量与反应物所具有的能量无关
C.化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关
D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的不同
【答案】C
【详解】
A. △H <0时为放热反应, 则当△H 为负值时, 表示该反应为放热反应, 故A错误;
B. 反应热△H=生成物的总能量-反应物的总能量,则反应热的大小与反应物所具有的能量和生成物具有的能量有关,故B错误;
C.反应热的大小取决于反应体系的始态和终态,与过程无关,遵循能量守恒定律,所以C选项是正确的;
D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的相同,因为反应的和反应条件没关系,故D错误;
【变2】下列关于反应热的说法正确的是 ( )
A.化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
B.已知C(s)+O2(g)=CO(g)的反应热为110.5kJ/mol,说明碳的燃烧热为110.5kJ
C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关
D.当∆H为“-”时,表示该反应为吸热反应杨sir化学,侵权必究
【答案】A
【详解】
A、盖斯定律认为:化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关,A正确;
B、燃烧热:1mol可燃物完全燃烧生成稳定氧化物放出的热量,碳完全燃烧生成二氧化碳,B错误;
C、反应热的大小即反应物所具有的能量和生成物所具有的能量的差异,C错误;
D、∆H<0,为放热反应,D错误;
故选A。
命题点二:盖斯定律的应用(框图加减)
【例3】盖斯定律指出:化学反应的反应热只与反应的始态和终态有关,而与具体反应途径无关。物质A在一定条件下可发生一系列转化,由图判断下列错误的是
A.ΔH1+ΔH2+ΔH3+ΔH4=1
B.A→D,ΔH=-ΔH4
C.ΔH1+ΔH2 =-ΔH3-ΔH4
D.B→D ,ΔH=ΔH2+ΔH3杨sir化学,侵权必究
【答案】A
【详解】
A. 根据盖斯定律及图示知,物质A经过一系列转化最终又得到物质A,所以初始状态相同,反应热为0,则ΔH1+ΔH2+ΔH3+ΔH4=0,故A错误;
B. A→D与D→A互为逆反应,则根据盖斯定律得,ΔH=-ΔH4,故B正确;
C. ΔH1+ΔH2 表示A→C的反应热,C→A的反应热为ΔH3+ΔH4,则ΔH1+ΔH2 =-ΔH3-ΔH4,故C正确;
D.如图所示B →D ,ΔH=ΔH2+ΔH3,故D正确;
故选A。
【变3-1】假设反应体系的始态为甲,中间态为乙,终态为丙,它们之间的变化如图所示,则下列说法不正确的是( )杨sir化学,侵权必究
A.|ΔH1|>|ΔH2| B.|ΔH1|<|ΔH3|
C.ΔH1+ΔH2+ΔH3=0 D.甲→丙的ΔH=ΔH1+ΔH2
【答案】A
【详解】
A、在过程中ΔH1与ΔH2的大小无法判断,A错误;
B、因|ΔH3|=|ΔH1|+|ΔH2|,B正确;
C、因为甲→丙和丙→甲是两个相反的过程,所以ΔH1+ΔH2+ΔH3=0,C正确;
D、题述过程中甲为始态,乙为中间态,丙为终态,由盖斯定律可知:甲丙,ΔH=ΔH1+ΔH2<0,D正确;
答案选A。
【变3-2】已知化学反应的热效应只与反应体系的初始状态和最终状态有关,如图甲所示,有。根据上述原理。对图乙中的反应热关系判断不正确的是( )
A.
B.
C.
D.
【答案】D
【详解】
A.根据盖斯定律可知,反应热只与反应体系的始态和终态有关,的反应热与的反应热互为相反数,选项A正确;
B.的反应热等于、、的反应热之知,选项B正确;
C.完成整个循环,又回到初始状态,反应热之和为0,选项C正确;
D.的反应热为,选项D不正确。
答案选D。
命题点三:盖斯定律的应用(两个方程式加减)
【例4】在298K、100kPa时,有下列反应:
O2(g)+2H2(g)=2H2O(g)∆H1;Cl2(g)+H2(g)=2HCl(g)∆H2;2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)∆H3,则∆H3与∆H1和∆H2间的关系正确的是
A.∆H3=∆H1+∆H2 B.∆H3=∆H1+2∆H2
C.∆H3=2∆H2-∆H1 D.∆H3=∆H1-∆H2
【答案】C
【详解】
①O2(g)+2H2(g)═2H2O(g)△H1;②Cl2(g)+H2(g)═2HCl(g)△H2;③2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)△H3;则反应③=﹣①+2×②,由盖斯定律可知,△H3=﹣△H1+2△H2,故选:C。
【变4-1】已知:①2C(s)+O2(g)=2CO(g) △H=-221.0 kJ·mol-1 ②2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
则制备水煤气的反应C(s)+H2O(g)=CO(g)+H2(g)的△H为( )
A.+262.6 kJ·mol-1 B.-131.3 kJ·mol-1
C.-352.3 kJ·mol-1 D.+131.3 kJ·mol-1
【答案】D
【详解】
①2C(s)+O2(g)=2CO(g) ΔH1=-221.0kJ∙mol-1;②2H2(g)+O2(g)=2H2O(g) ΔH2=-483.6kJ∙mol-1;根据盖斯定律:(①-②):C(s)+H2O(g)=CO(g)+H2(g) ΔH=131.3kJ∙mol-1;
故答案选D。
【变4-2】已知:①N2(g)+2O2(g)=N2O4(g) ΔH=+8.7 kJ·mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
下列能表示N2H4(g)和N2O4(g)反应的热化学方程式的是( )杨sir化学,侵权必究
A.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-1076.7 kJ·mol-1
B.N2H4(g)+N2O4(g)=N2(g)+2H2O(g) ΔH=-542.7kJ·mol-1
C.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-542.7 kJ·mol-1
D.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(l) ΔH=-1076.7 kJ·mol-1
【答案】A
【详解】
已知:①N2(g)+2O2(g)=N2O4(g) ΔH=+8.7 kJ·mol−1
②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534 kJ·mol−1
根据盖斯定律,将②×2-①得2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-1076.7 kJ·mol−1。
答案选A。
命题点四:盖斯定律的应用(三个方程式加减)
【例5】已知:①
②
③
则反应的等于( )
A. B.
C. D.
【答案】B
【详解】
①
②
③
由盖斯定律②-①+③得到反应的,B正确。答案选B。
【变5】已知下列热化学方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8kJ/mol
Fe2O3(s)+CO(g)=Fe3O4(s)+CO2(g) ΔH=-15.73kJ/mol杨sir化学,侵权必究
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.4kJ/mol
则14gCO气体还原足量FeO固体得到Fe单质和CO2气体时对应的ΔH约为( )
A.-218kJ/mol B.-109kJ/mol C.+109kJ/mol D.+218kJ/mol
【答案】B
【详解】
已知:①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8kJ/mol
②Fe2O3(s)+CO(g)=Fe3O4(s)+CO2(g) ΔH=-15.73kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.4kJ/mol
根据盖斯定律可知(①×3-②×3-③×2)×即得到FeO(s)+CO(g)=Fe(s)+CO2(g) ΔH=-218 kJ·mol-1,因此14 g CO气体还原足量FeO固体得到Fe固体和CO2气体时对应的ΔH约为-109 kJ·mol-1;
答案选B。
【例6】(1)近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。
直接氧化法可按下列催化过程进行:
则的_________。
(2)环戊二烯()是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。
已知:(g)=(g)+H2(g) ∆H1=100.3kJ·mol-1①
②
对于反应:(g)+I2(g)=(g)+2HI(g)③,∆H3=_________kJ·mol-1
(3)氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点,甲烷水蒸气催化重整是制高纯氢的方法之一。
①反应器中初始反应的生成物为和,其物质的量之比为,甲烷和水蒸气反应的方程式是____________________________________________。
②已知反应器中还存在如下反应:
i.
ii.
iii.......
iii为积炭反应,利用和计算时,还需要利用____________________________反应的。
【答案】-116 +89.3 或
【详解】
(1)已知:
①
②
③
根据盖斯定律,(①+②+③)×2得。
(2)已知:
①(g)=(g)+H2(g) ∆H1=100.3kJ·mol-1
②
根据盖斯定律,由反应①+反应②得反应③,则。
(3)①根据与反应生成、的物质的量之比为,结合原子守恒可得反应的化学方程式为。
②已知:
i.
ii.
iii.......
根据盖斯定律,由或可知,求时,还需要热化学方程式为或。
提分作业 小杨老师 15521324728 侵权必究
【练1】下列说法正确的是( )
A.所有的放热反应都能在常温常压下自发进行
B.Ba(OH)2·8H2O与NH4Cl反应属放热反应
C.天然气燃烧时,其化学能全部转化为热能杨sir化学,侵权必究
D.反应热只与反应体系的始态和终态有关,而与反应的途径无关
【答案】D
【详解】
A、判断一个反应能否自发进行,是根据△G判断,而不是看条件,如放热熵减小的反应,高温下不能自发进行,A错误;
B、Ba(OH)2·8H2O与NH4Cl反应属吸热反应,B错误;
C、天然气燃烧时化学能并不全部转化为热能,还有光能等,C错误;
D、反应热只与反应体系的始态和终态有关,而与反应的途径无关,D正确;
答案选D。
【练2】下列说法正确的是( )
A.化学反应的反应热与反应过程有密切的关系
B.化学反应的反应热取决于反应体系的始态和终态
C.盖斯定律只是一条简单的自然规律,其实际作用不大
D.有的化学反应过程没有能量变化
【答案】B
【详解】
A、根据盖斯定律,反应热的大小只与反应的始态、终态有关,和反应的途径、过程无关,A错误;
B、根据盖斯定律,反应热的大小只与反应的始态、终态有关,B正确;
C、盖斯定律虽然一条简单的自然规律,但实际作用很大,如运用盖斯定律计算不易测定的反应热,C错误;
D、任何化学反应过程都有能量变化,D错误。
答案选B。
【练3】已知:如图所指关系,下列关系式正确的是( )
A.ΔH3=ΔH1+ ΔH2 B.ΔH1=ΔH2+ΔH3 C.ΔH3=ΔH1=ΔH2 D.ΔH2=ΔH1+ ΔH3
【答案】A
【详解】
如图关系中物质起始状态为2 mol N2(g)、6 mol H2(g)、5 mol O2(g),最终生成物为4 mol NO(g)、6 mol H2O(1),根据盖斯定律: ΔH3=ΔH1+ΔH2。
答案选A。
【练4】已知:
2Fe(s)+O2(g) =2FeO(s) △H=-544kJ·mol-1
4Al(s)+3O2(g) =2Al2O3(s) △H=-3350kJ·mol-1
则2Al(s) +3FeO(s) =Al2O3(s) + 3Fe(s)的△H是( )
A.- 859 kJ·mol-1 B.+859 kJ·mol-1
C.-1403 kJ·mol-1 D.-2491 kJ·mol-1
【答案】A
【详解】
根据反应①2Fe(s)+O2(g) =2FeO(s)和反应②4Al(s)+3O2(g) =2Al2O3(s)可知,②×-①×得到2Al(s) +3FeO(s) =Al2O3(s)+ 3Fe(s),所以反应热是(-3350kJ·mol-1)×+544kJ·mol-1×=-859 kJ·mol-1,
答案选A。
【练5】以下反应可表示获得乙醇并用作汽车燃料的过程,下列有关说法正确的是( )
①6CO2(g)+6H2O(l)=C6H12O6(s)+6O2(g) ΔH1
②C6H12O6(s)=2C2H5OH(l)+2CO2(g) ΔH2
③C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH3
A.2ΔH3=ΔH1-ΔH2
B.ΔH3、ΔH1、ΔH2均为ΔH<0
C.在不同油耗汽车中发生反应③,ΔH3会不同杨sir化学,侵权必究
D.植物的光合作用通过反应①将热能转化为化学能
【答案】A
【详解】
A.①6CO2(g)+6H2O(l)=C6H12O6(s)+6O2(g) ΔH1,②C6H12O6(s)=2C2H5OH(l)+2CO2(g) ΔH2,根据盖斯定律:①-②可得,2C2H5OH(l)+6O2(g)=4CO2(g)+6H2O(l) ΔH=ΔH1-ΔH2③C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH3=ΔH=ΔH1-ΔH2,可以得到:2ΔH3=ΔH1-ΔH2,故A正确;
B.①是光合作用的原理和③乙醇的燃烧是放热反应,ΔH3、ΔH1<0,ΔH2属于无氧呼吸,是需要吸收能量,故ΔH2>0,故B错误;
C.在不同油耗汽车中发生反应③,ΔH3是相同的,故C错误;
D.植物的光合作用通过反应①将太阳能转化为化学能,故D错误;
答案选A。
【练6】把煤作为燃料可通过下列两种途径:
途径I:C(s)+O2(g)=CO2(g) △H1<0①
途径II:先制成水煤气:C(s)+H2O(g)=CO(g)+H2(g) △H2>0②
再燃烧水煤气:2CO(g)+O2(g)=2CO2(g) △H3<0③
2H2(g)+O2(g)=2H2O(g) △H4<0④
请回答下列问题:
(1)途径I放出的热量_____________( 填“大于”“等于”或“小于”) 途径II放出的热量。
(2)△H1、△H2、△H3、△H4的数学关系式是_______________。
(3)12g 炭粉在氧气中不完全燃烧生成一氧化碳,放出110.35kJ热量。其热化学方程式为_______________。
【答案】等于 △H1=△H2+(△H3+△H4) C(s) +O2(g) = CO(g) △H=-110.35kJ/mol
【详解】
(1)由盖斯定律可知:若是一个反应可以分步进行,则各步反应的吸收或放出的热量总和与这个反应一次发生时吸收或放出的热量相同,故答案为等于;
(2)根据盖斯定律,反应1=反应2+反应3×+反应4×,所以△H1=△H2+(△H3+△H4),故答案为△H1=△H2+(△H3+△H4);
(3)12g 炭粉在氧气中不完全燃烧生成一氧化碳,放出110.35kJ热量,即1mol炭粉在氧气中不完全燃烧生成一氧化碳,放出110.35kJ热量,热化学方程式为:C(s)+O2(g)=CO(g)△H=-110.35 kJ•mol-1,故答案为C(s)+O2(g)=CO(g)△H=-110.35kJ•mol-1。
【练7】(1)在化工生产过程中,少量CO的存在会引起催化剂中毒。为了防止催化剂中毒,常用将CO氧化,被还原为S。
已知:
①
②
③
则氧化CO的热化学方程式为___________。
(2)用将HCl转化为的过程如图所示。
其中,过程①的热化学方程式为,过程②生成1mol的反应焓变为,则由生成的热化学方程式为__________。(反应焓变用和表示)。
(3)已知:
①;
②。
写出由和生成的热化学方程式:__________。
(4)工业上可通过天然气跟水蒸气反应制取,有关反应的能量变化如图所示,则该反应的_________(用含a、b、c的式子表示)。
【答案】
【详解】
(1)由盖斯定律可知,2×②-2×①–③得,故答案为: ;
(2)过程②的热化学方程式为,由盖斯定律可知,由生成的热化学方程式为,故答案为:;
(3)由①–②得,故答案为: ;
(4)由图可知:
Ⅰ.;
Ⅱ.;
Ⅲ.
根据盖斯定律可知,Ⅲ-3×Ⅱ-Ⅰ得
,故答案为:。
【暑假提升】人教版2019化学高一(升高二)暑假预习-(选修1)第17讲 暑假小测(3): 这是一份【暑假提升】人教版2019化学高一(升高二)暑假预习-(选修1)第17讲 暑假小测(3),文件包含暑假提升人教版2019化学高一升高二暑假预习-选修1第17讲暑假小测3教师版docx、暑假提升人教版2019化学高一升高二暑假预习-选修1第17讲暑假小测3学生版docx等2份学案配套教学资源,其中学案共16页, 欢迎下载使用。
【暑假提升】人教版2019化学高一(升高二)暑假预习-(选修1)第15讲 水的电离 讲学案: 这是一份【暑假提升】人教版2019化学高一(升高二)暑假预习-(选修1)第15讲 水的电离 讲学案,文件包含暑假提升人教版2019化学高一升高二暑假预习-选修1第15讲水的电离教师版docx、暑假提升人教版2019化学高一升高二暑假预习-选修1第15讲水的电离学生版docx等2份学案配套教学资源,其中学案共19页, 欢迎下载使用。
【暑假提升】人教版2019化学高一(升高二)暑假预习-(选修1)第12讲 暑假小测(2): 这是一份【暑假提升】人教版2019化学高一(升高二)暑假预习-(选修1)第12讲 暑假小测(2),文件包含暑假提升人教版2019化学高一升高二暑假预习-选修1第12讲暑假小测2教师版docx、暑假提升人教版2019化学高一升高二暑假预习-选修1第12讲暑假小测2学生版docx等2份学案配套教学资源,其中学案共30页, 欢迎下载使用。