
2024届高三新高考化学大一轮专题练习——化学反应热的计算
展开2024届高三新高考化学大一轮专题练习-化学反应热的计算
一、单选题
1.(2023秋·浙江台州·高三统考期末)在25℃和101kPa的条件下,和完全反应生成的能量变化如图所示,下列说法不正确的是
A.H-H的键能为436kJ/mol
B.形成中的化学键释放出431kJ的能量
C.该反应的热化学方程式:
D.共价键断裂和形成时的能量变化是该化学反应能量变化的主要原因
2.(2023·广东深圳·统考二模)恒温、恒压下,向密闭容器中充入少量正丁烷,可同时发生以下反应:
反应1:(g) (g) + H2(g)
反应2:(g) (g) +H2(g)
反应3:(g) (g)
已知:,其中R、C均为常数。反应1和反应2的随变化关系曲线如图所示,下列说法正确的是
A.,
B.稳定性:
C.a为反应3中随的变化曲线
D.再向平衡体系中充入少量Ar,反应3的平衡常数增大
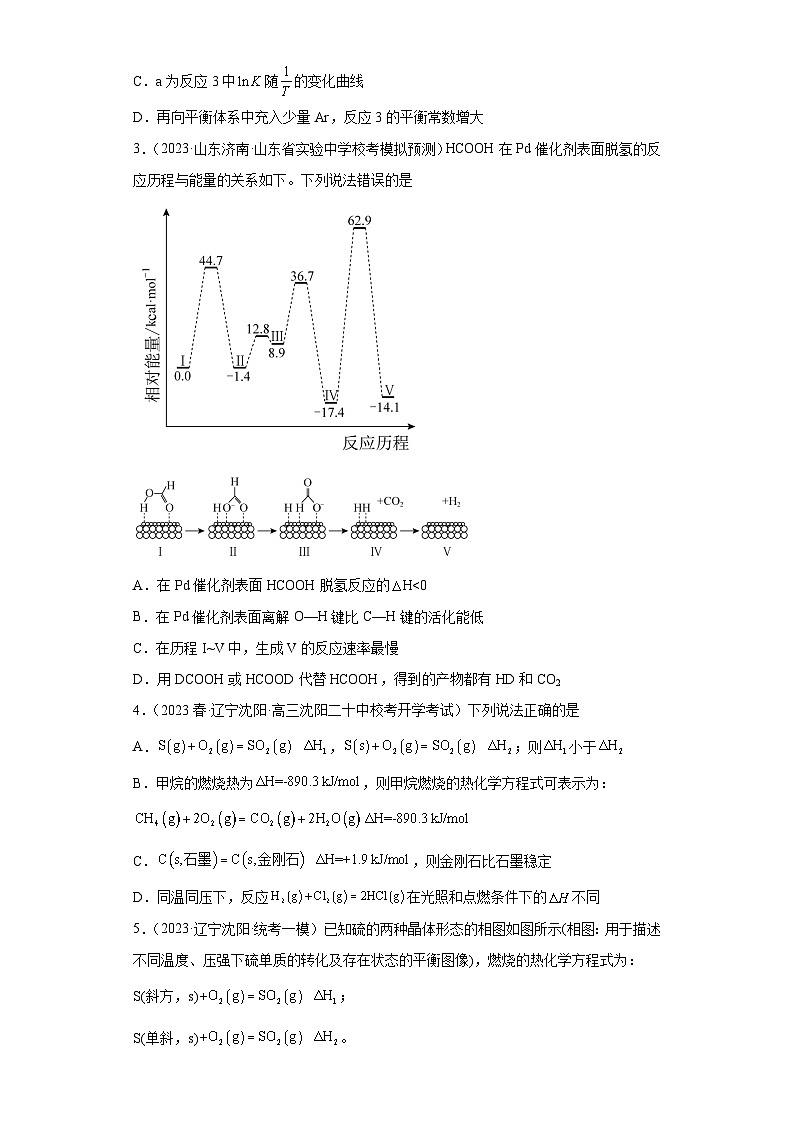
3.(2023·山东济南·山东省实验中学校考模拟预测)HCOOH在Pd催化剂表面脱氢的反应历程与能量的关系如下。下列说法错误的是
A.在Pd催化剂表面HCOOH脱氢反应的H<0
B.在Pd催化剂表面离解O—H键比C—H键的活化能低
C.在历程I~V中,生成V的反应速率最慢
D.用DCOOH或HCOOD代替HCOOH,得到的产物都有HD和CO2
4.(2023春·辽宁沈阳·高三沈阳二十中校考开学考试)下列说法正确的是
A. , ;则小于
B.甲烷的燃烧热为,则甲烷燃烧的热化学方程式可表示为:
C. ,则金刚石比石墨稳定
D.同温同压下,反应在光照和点燃条件下的不同
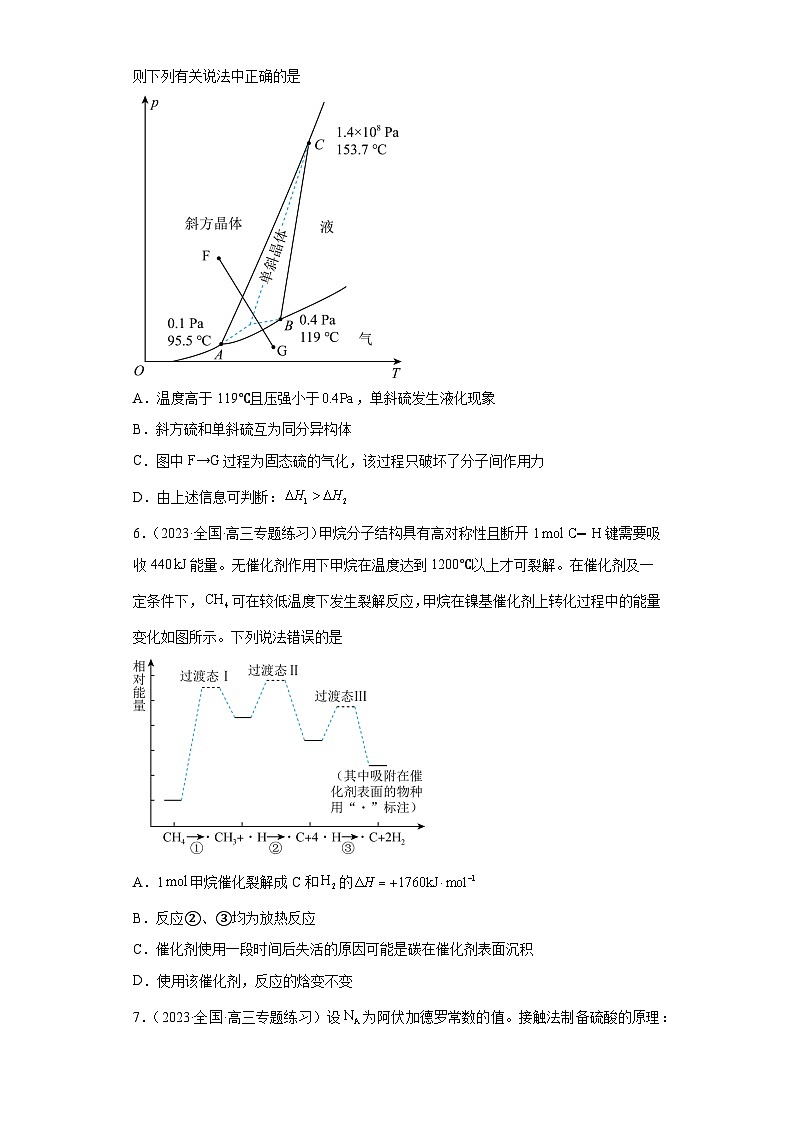
5.(2023·辽宁沈阳·统考一模)已知硫的两种晶体形态的相图如图所示(相图:用于描述不同温度、压强下硫单质的转化及存在状态的平衡图像),燃烧的热化学方程式为:
S(斜方,s) ;
S(单斜,s) 。
则下列有关说法中正确的是
A.温度高于119℃且压强小于,单斜硫发生液化现象
B.斜方硫和单斜硫互为同分异构体
C.图中F→G过程为固态硫的气化,该过程只破坏了分子间作用力
D.由上述信息可判断:
6.(2023·全国·高三专题练习)甲烷分子结构具有高对称性且断开1键需要吸收440能量。无催化剂作用下甲烷在温度达到1200℃以上才可裂解。在催化剂及一定条件下,可在较低温度下发生裂解反应,甲烷在镍基催化剂上转化过程中的能量变化如图所示。下列说法错误的是
A.1甲烷催化裂解成C和的
B.反应②、③均为放热反应
C.催化剂使用一段时间后失活的原因可能是碳在催化剂表面沉积
D.使用该催化剂,反应的焓变不变
7.(2023·全国·高三专题练习)设为阿伏加德罗常数的值。接触法制备硫酸的原理:(1);(2);(3)。下列说法正确的是
A.的硫酸溶液中含的数目为
B.反应(2)中和反应放出热量时生成分子的数目为
C.,则
D.反应(1)中生成转移的电子数为
8.(2023春·江西·高三校联考期中)下列图示与对应的叙述不相符的是
A.(a)图表示反应物断键吸收的能量大于生成物成键放出的能量
B.(b)图是金刚石与石墨分别被氧化生成的能量关系曲线,说明石墨转化为金刚石的反应的
C.由(c)图可知,
D.(d)图是某反应:A→C(由两步反应A→B→C完成,B为中间产物)的能量曲线(E表示能量),整个反应中
9.(2022秋·内蒙古包头·高三统考期末)下列说法正确的是
A.的燃烧热,则
B.含的稀溶液与稀盐酸完全中和,放出的热量,则稀醋酸和稀溶液反应的热化学方程式为:
C.已知,则
D.500℃、下,将和置于密闭的容器中充分反应生成,放热,其热化学方程式为:
10.(2023秋·湖南邵阳·高三统考期末)、、三种物质燃烧的热化学方程式如下:
①
②
③
下列说法正确的是
A.
B.
C.与合成反应的原子利用率为100%
D.
11.(2023秋·湖南长沙·高三长沙市实验中学校考期末)分析下表中的3个热化学方程式,下列说法错误的是
2022年北京冬奥会“飞扬”火炬的燃料 | ① | |
2008年北京奥运会“祥云”火炬的燃料 | ② ③ |
A.
B.等质量的氢气与丙烷相比较,充分燃烧时,氢气放热更多
C.
D.丙烷的燃烧热为
12.(2023·全国·高三专题练习)已知碳、一氧化碳、晶体硅的燃烧热分别是,则工业冶炼晶体硅的反应为。则下列判断正确的是
A. B.
C. D.
13.(2023秋·广东·高三校联考期末)甲烷、乙烯和丙烯都是重要的化工原料,都能燃烧,丙烯的燃烧热比乙烯的燃烧热小。下列相关说法正确的是
A.和的焓变很接近
B.已知 ,乙烯的燃烧热为
C.丙烯燃烧放出的热量一定比乙烯燃烧放出的热量多
D.若 , ,则
14.(2023秋·河北保定·高三统考期末)太阳能作为一种清洁能源,对环境友好、能量巨大、可再生。以太阳能为热源,用铁氧化合物循环分解水制的过程如下:(已知:)
过程Ⅰ:……
过程Ⅱ:
下列有关说法错误的是
A.过程Ⅱ中如果是气态水,则过程Ⅱ的
B.过程Ⅰ反应的热化学方程式为
C.过程Ⅰ、Ⅱ中能量转化的形式依次是太阳能→热能→化学能、化学能→热能
D.铁氧化合物循环制具有成本低,产物易分离等优点
二、非选择题
15.(2023·全国·高三专题练习)三甲胺[N(CH3)3]是重要的化工原料。最近我国科学家实现了使用铜催化剂将N,N-二甲基甲酰胺[(CH3)2NCHO,简称DMF]转化为三甲胺的合成路线。回答下列问题:
(1)结合实验与计算机模拟结果,研究单一DMF分子在铜催化剂表面的反应历程,如图所示:
该历程中最大能垒(活化能)=______eV,该步骤的化学方程式为______。
(2)该反应变化的ΔH______0(填“<”、“>”或“=”),制备三甲胺的热化学方程式为______。
16.(2021春·湖北恩施·高三巴东一中校考阶段练习)根据要求回答问题:
(1)如图是1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,活化能E1的变化是_____(填“增大”“减小”或“不变”,下同),ΔH的变化是_____。图中最稳定的是_____(填“反应物”“过渡态”或“生成物”)。
(2)50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应反应热(设溶液的密度均为1g•cm-3,反应后溶液的比热容c=4.18J•g-1•℃-1)。回答下列问题:
| 实验次数 | 反应物的温度/℃ | 反应前体系的温度 | 反应后体系的温度 | 温度差 | |
盐酸 | NaOH溶液 | t1/℃ | t2/℃ | (t2-t1)/℃ | ||
1 | 25.0 | 25.2 | 25.1 | 28.5 | 3.4 | |
2 | 24.9 | 25.1 | 25.0 | 28.3 | 3.3 | |
3 | 25.6 | 25.4 | 25.5 | 29.0 | 3.5 | |
从实验装置上看,图中仪器A的名称是_____,隔热层的作用是_____。根据表中数据,结合题干信息,请写出生成1molH2O的热化学方程式_____(保留3位有效数字)。
(3)生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的1.2~2.0万倍,在大气中的寿命可长达740年之久,表中是几种化学键的键能:
化学键 | N≡N | F-F | N-F |
键能/kJ•mol-1 | 941.7 | 154.8 | 283.0 |
写出N2(g)与F2(g)反应合成NF3(g)的热化学方程式_____。
(4)在微生物作用的条件下,NH经过两步反应被氧化成NO。这两步反应的能量变化如图:
第二步反应是_____(填“放热”或“吸热”)反应。1molNH(aq)全部氧化成NO(aq)的热化学方程式是_____。
17.(2021秋·海南省直辖县级单位·高三校考阶段练习)把煤作为燃料可通过下列两种途径:
途径Ⅰ C(s)+O2(g)=CO2(g);ΔH1<0 ①
途径Ⅱ 先制成水煤气:C(s)+H2O(g)=CO(g)+H2(g);ΔH2>0 ②
再燃料水煤气:2CO(g)+O2(g)=2CO2(g);ΔH3<0 ③
请回答下列问题:
途径Ⅰ放出的热量___________(填“大于”“等于”或“小于”)途径Ⅱ放出的热量。
18.(2023春·山东烟台·高三统考阶段练习)能源是国民经济发展的重要基础,如何合理利用现有能源以及开发新能源一直是研究的重点课题。
(1)在、时,完全燃烧生成液态水时放出的热量是。在直接以甲烷为燃料电池时,电解质溶液为酸性,负极的反应式为___________。理想状态下,该燃料电池消耗甲烷所能产生的最大电能为,则该燃料电池的理论效率(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)为___________。
(2)已知部分键能(E)数据如下:
化学键 | ||||
946 | 389 | 243 | 431 |
反应___________。
(3)将煤转化为水煤气的方法是通过化学高温方法将煤转化为洁净燃料的方法之一,煤转化为水煤气的主要反应为。有关物质的燃烧热数据如下表所示:
物质 | C | ||
已知:转化为放出的热量。
①写出C完全燃烧的热化学方程式___________。
②写出煤转化为水煤气的主要反应的热化学方程式:___________。
参考答案:
1.C
【详解】A.由题干图示信息可知,断裂1molH-H需吸收436kJ的能量,则H-H的键能为436kJ/mol,A正确;
B.由题干图示信息可知,形成中的化学键释放出431kJ的能量,B正确;
C.该反应的热化学方程式: =-183kJ/mol,C错误;
D.化学反应的微观本质为旧化学键的断裂和新化学键的形成,共价键断裂和形成时的能量变化是该化学反应能量变化的主要原因,D正确;
故答案为:C。
2.B
【详解】A.由题干图示信息可知,反应1和反应2的lnK随增大而减小,故,,A错误;
B.由题干图示信息可知,相同时反应2的lnK更大,则有,反应3为反应2-反应1得到,则小于0,即顺-2-丁烯具有的总能量高于反-2-丁烯,能量越高越不稳定,故稳定性:,B正确;
C.由B项分析可知,则lnK随的增大而增大,故a不为反应3中随的变化曲线,C错误;
D.平衡常数仅仅是温度的函数,温度不变平衡常数不变,故再向平衡体系中充入少量Ar,反应3的平衡常数不变,D错误;
故答案为:B。
3.B
【详解】A.由反应历程图可知,反应Ⅰ的相对能量高于反应Ⅴ,则HCOOH脱氢反应为放热反应,△H<0,故A正确;
B.由反应机理图可知,在Pd催化剂表面离解O−H键的过程为反应Ⅰ到Ⅱ,离解C−H键的过程为Ⅲ→Ⅳ,根据反应历程图,反应Ⅰ到Ⅱ活化能为44.7kJ,Ⅲ→Ⅳ的活化能为(36.7−8.9)kJ=27.8kJ,故在Pd催化剂表面离解O−H键比C−H键的活化能高,故B错误;
C.在历程Ⅰ~Ⅴ中,Ⅳ→Ⅴ的活化能最高,则生成Ⅴ的反应速率最慢,故C正确;
D.根据HCOOH在Pd催化剂表面脱氢的反应机理图可得化学反应为,即HCOOH中的两个H原子被解离出来形成H2,则用DCOOH或HCOOD代替HCOOH,得到的产物都有HD和CO2,故D正确;
故答案选B。
【点睛】本题考查化学反应中能量变化,题目以图像的形式进行呈现,涉及过程复杂,关键是对能量变化、反应机理的理解。
4.A
【详解】A.硫的燃烧时放热反应,和均小于0,固态硫转化为气态硫需要吸热,故小于,A正确;
B.甲烷的燃烧热表示的是1mol甲烷气体完全燃烧生成二氧化碳和液态水所放出的热量为890kJ,甲烷燃烧的热化学方程式可表示为:,B错误;
C.物质具有的总能量越低越稳定,石墨具有的总能量低,故石墨比金刚石稳定,C错误;
D.同温同压下,反应在光照和点燃条件下的相同,D错误;
故选A。
5.D
【详解】A.由图可知,温度高于119℃时,单斜硫是固态,需要增大压强单斜硫才能发生液化现象,故A错误;
B.单斜硫和正交硫是由S元素形成的不同单质,故正交硫和单斜硫互为同素异形体,故B错误;
C.图中F→G过程为固态硫的气化,由斜方晶体先变为单斜硫再变为气体,过程中发生了化学变化,除了破坏了分子间作用力外,还破坏了共价键,故C错误;
D.①S(斜方,s) ,②S(单斜,s) ,①-②可得,S(斜方,s)=S(单斜,s),由图可知,在相同条件下,斜方硫转变为单斜硫需要升温,即,则,故D正确;
故选D。
6.A
【详解】A.断开1键需要吸收440能量,1甲烷分子中有4键,完全断开需要吸收1760能量,即1甲烷中的化学键完全断开需要吸收1760能量,而不是1甲烷催化裂解成C和H,需要吸收1760能量,故A错误;
B.反应②、③中,反应物的总能量均高于生成物的总能量,所以均为放热反应,故B正确;
C.从题图中可以看出,甲烷在镍基催化剂上转化是在催化剂表面上发生的,催化剂使用一段时间后失活的原因可能是碳在催化剂表面沉积,堵塞了催化剂表面的活性中心,故C正确;
D.催化剂不影响反应物和生成物的总能量,使用该催化剂,反应的焓变不变,故D正确;
故选A。
7.B
【详解】A. 的硫酸溶液中含的物质的量为0.1mol、数目为,A错误;
B. 反应(2)中每消耗2mol、1mol,生成2mol时放出热量,则和反应放出热量时生成分子的数目为,B正确;
C.硫酸溶于水时放热,则三氧化硫与水反应生成稀硫酸比生成纯硫酸时放出热量更多,则和相比, b>a,C错误;
D. 没有指明是标准状况,所以22.4L二氧化硫的物质的量难以计算,反应(1)中生成转移的电子数难以计算,D错误;
案选B。
8.D
【详解】A.(a)图中,正反应的活化能大于逆反应的活化能,表示反应物断键吸收的能量大于生成物成键放出的能量,A正确;
B.(b)图石墨的能量低于金刚石,石墨转化为金刚石需要吸收能量,反应的,B正确;
C.反应热等于反应物的总键能减去生成物的总键能,由(c)图可知,,C正确;
D.(d)图是某反应:A→C(由两步反应A→B→C完成,B为中间产物)的能量曲线(E表示能量),根据盖斯定律,整个反应中,D错误;
故选D。
9.C
【详解】A.氢气的燃烧热是1mol氢气完全燃烧生成液态水放出的能量,的燃烧热,则,故A错误;
B.含物质的量为0.5mol的稀溶液与稀盐酸完全中和,放出的热量;醋酸是弱酸,电离吸热,含1molCH3COOH的稀醋酸和稀溶液反应放出的热量小于57.4kJ,则该反应热化学方程式的ΔH>−57.4kJ⋅mol−1,故B错误;
C.碳完全燃烧生成二氧化碳放出的能量大于碳不完全燃烧生成一氧化碳放出的能量, ,则,故C正确;
D.氮气和氢气反应可逆,500℃、下,将和置于密闭的容器中充分反应生成的物质的量小于1mol,放热,则,故D错误;
选C。
10.B
【详解】A.①CO的燃烧反应是放热反应,放热反应的反应热△H<0,故,A错误;
B.根据盖斯定律,将①×2+②×4-③,整理可得:,B正确;
C.与合成的反应:,除了生成乙醇还生成水,原子利用率不是100%,C错误;
D.将②扩大2倍,将反应物与生成物颠倒顺序,能量数值相等,符号相反,可得2H2O(g)=2H2(g)+O2(g) △H=-2b kJ/mol,物质在气态含有的能量比液体时高,反应放出热量越少,则反应热就越大,所以2H2O(l)=2H2(g)+O2(g) △H>-2b kJ/mol,D错误;
故合理选项是B。
11.D
【详解】A.根据盖斯定律,①×-③可得3CO(g)+7H2(g)=C3H8(g)+3H2O(g) ΔH=(-484) ×-(-2380)=-504kJ/mol,故A正确;
B.由2H2(g)+O2(g)=2H2O(g) ΔH=-484kJ/mol可知4g氢气反应放出484kJ热量,由C3H8(g)+5O2(g)=3CO2(g)+4H2O(g) ΔH=-2039kJ/mol可知44g丙烷反应放出2039kJ热量,则4g丙烷反应放出185.4kJ热量,因此等质量的氢气与丙烷相比较,充分燃烧时,氢气放热更多,故B正确;
C.根据盖斯定律,①×5-②可得3CO2(g)+10H2(g)=C3H8(g)+6H2O(g) ΔH=5×(-484kJ/mol)-(- 2039kJ/mol)=-381kJ/mol,故C正确;
D.丙烷的燃烧热是指1mol丙烷完全燃烧生成二氧化碳与液态水放出热量,C3H8(g)+5O2(g)=3CO2(g)+4H2O(g) ΔH=-2039kJ/mol为生成气态水,则丙烷的燃烧热不是2039kJ/mol,故D错误;
故选D。
12.B
【详解】A.完全燃烧放出的热量大于完全燃烧放出的热量,燃烧放热,焓变为负值,,故A错误;
B.根据题给信息,可分别得到热化学方程式:①;
②;
③;
将①×2-②×2-③得,故B正确;
C.碳的燃烧热是1molC完全燃烧生成二氧化碳放出的能量,故C错误;
D.热化学方程式书写需标注物质的聚集状态,故D错误;
选B。
13.A
【详解】A.从化学键的角度分析,两个反应断键和成键方式相似,所以焓变很接近,选项A正确;
B.表示乙烯的燃烧热应生成液态水,选项B错误;
C.未指明乙烯和丙烯的用量,选项C错误;
D.放热越多,焓变越小,,选项D错误。
答案选A。
14.C
【详解】A.过程Ⅱ:,气态水转化为液态水吸热,所以,根据盖斯定律,过程Ⅱ中如果是气态水,则过程Ⅱ的,故A正确;
B.已知反应①和反应②,根据盖斯定律,将
①−2②,有,故B正确;
C.过程I和过程II均为吸热反应,故不存在将化学能转化为热能的过程,故C错误;
D.反应的产物中,氢气为气体,而Fe3O4为固体,铁氧化合物循环制H2的产物易分离,且由于利用太阳能,成本低,故D正确,
故答案选C。
【点睛】本题考查了盖斯定律的应用,题目难度适中,注意从图中提取有用的信息很关键。
15.(1) 1.19 eV N(CH3)3+OH*+H*=N(CH3)3(g)+H2O(g)
(2) < (CH3)2NCHO(g)+2H2(g)=N(CH3)3(g)+H2O(g) ΔH=-1.02NAeV/mol
【详解】(1)如图所示,反应历程中反应物和生成物相对能量差值最大的为最大能垒,即N(CH3)3+OH*+H*=N(CH3)3(g)+H2O(g),反应过程中活化能最大,活化能=2.21 eV -1.02 eV =1.19 eV。
(2)如图所示,根据盖斯定律,反应热只与反应始态和终态有关,与反应过程无关,反应物总能量高于生成物总能量,该反应为放热反应,ΔH<0,单一DMF分子反应释放的能量为1.02eV,1mol该分子放出的能量为1.02NAeV,热化学反应方程式:(CH3)2NCHO(g)+2H2(g)=N(CH3)3(g)+H2O(g) ΔH=-1.02NAeV/mol。
16.(1) 减小 不变 生成物
(2) 玻璃搅拌器 隔热、保温,减少实验过程中的热量损失 H+(aq)+OH-(aq)=H2O(l) ΔH=-56.8kJ•mol-1
(3)N2(g)+3F2(g)=2NF3(g) ΔH=-291.9kJ•mol-1
(4) 放热 NH(aq)+2O2(g)=NO(aq)+2H+(aq)+H2O(l) ΔH=-346kJ•mol-1
【详解】(1)加入催化剂能降低反应所需的活化能,则E1减小,催化剂不能改变反应物的总能量和生成物的总能量,即反应热不变,所以催化剂对反应热无影响,即ΔH不变;从能量的角度分析,能量越低越稳定,故图中最稳定的是生成物;
(2)由图可知,图中仪器A的名称是玻璃搅拌器;为了防止反应产生的热量传递到环境中,故使用隔热层,则隔热层的作用是隔热、保温,减少实验过程中的热量损失;
3次温度差平均值为3.4℃,的NaOH溶液50mL与的硫酸溶液50mL进行中和反应生成水的物质的量为,溶液的质量为:100mL×1g/mL=100g,则生成水放出的热量为,所以实验测得的中和热,故答案为: ;则生成1molH2O的热化学方程式为:H+(aq)+OH-(aq)=H2O(l) ΔH=-56.8kJ•mol-1;
(3)∆H=反应物总键能-生成物总键能=941.7 kJ·mol-1+3×154.8 kJ·mol-1-6×283.0 kJ·mol-1= -291.9 kJ·mol-1,热化学方程式为N2(g)+3F2(g)=2NF3(g) ∆H= -291.9 kJ·mol-1,故答案为:N2(g)+3F2(g)=2NF3(g) ∆H= -291.9 kJ·mol-1;
(4)由图可知,第二步反应的焓变小于0,所以第二步反应为放热反应;第一步的热化学方程式为,第二步的热化学方程式为:,根据盖斯定律则。
17.等于
【详解】根据盖斯定律可知,反应热只与始态和终态有关,而与反应的途径无关,通过观察可知途径Ⅰ和途径Ⅱ是等效的,途径Ⅰ和途径Ⅱ等量的煤燃烧消耗的氧气相等,两途径最终生成物只有二氧化碳,所以途径Ⅰ放出的热量等于途径Ⅱ放出的热量。
18.(1) CH4-8e-+2H2O=CO2+8H+ 85%
(2)-469kJ/mol
(3) C(s)+O2(g)=CO2(g) ∆H=-393.5kJ/mol C(s)+H2O(g)=CO(g)+H2(g) ∆H=+131.0kJ/mol
【详解】(1)由燃料电池是原电池的一种,负极失电子发生氧化反应,正极得电子发生还原反应,甲烷燃烧生成二氧化碳和水,但在酸性介质中,正极不会生成大量氢离子,则电解质参与电极反应,甲醇燃料电池的负极反应式为CH4+2H2O-8e-=CO2+8H+,正极反应式为2O2+8H++8e-=4H2O,又该电池的理论效率为消耗1mol甲烷所能产生的最大电能与其燃烧热之比,则电池的理论效率为=×100%=85% ,故答案为CH4+2H2O-8e-=CO2+8H+;85%;
(2)根据反应物的键能总和减去生成物的键能总和计算反应热,该反应的ΔH=6×389+3×243-946-6×431=-469kJ/mol;
(3)①碳完全燃烧生成二氧化碳的反应,标注物质聚集状态和对应反应的焓变,C完全燃烧的热化学方程式为:C(s)+O2(g)=CO2(g) ΔH=-393.5kJ/mol,故答案为C(s)+O2(g)=CO2(g) ΔH=-393.5kJ/mol;
②由a:C(s)+O2(g)=CO2(g) ΔH=-393.5kJ/mol
b:CO(g)+O2(g)=CO2(g) ΔH=-283.0kJ/mol
c:H2(g)+O2(g)=H2O(l) ΔH=-285.8kJ/mol
d:H2O(g)=H2O(l) ΔH=-44.0kJ/mol,
根据盖斯定律,a-b-c+d得:C(s)+H2O(g)=CO(g)+H2(g) ∆H=+131.0kJ/mol,故答案为C(s)+H2O(g)=CO(g)+H2(g) ∆H=+131.0kJ/mol。
2024届高三新高考化学大一轮专题练习--化学反应热的计算: 这是一份2024届高三新高考化学大一轮专题练习--化学反应热的计算,共18页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。
2024届高三新高考化学大一轮专题练习-化学反应热的计算: 这是一份2024届高三新高考化学大一轮专题练习-化学反应热的计算,共16页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。
2024届高三新高考化学大一轮专题练习--化学反应热的计算: 这是一份2024届高三新高考化学大一轮专题练习--化学反应热的计算,共19页。试卷主要包含了单选题,多选题,非选择题等内容,欢迎下载使用。












