



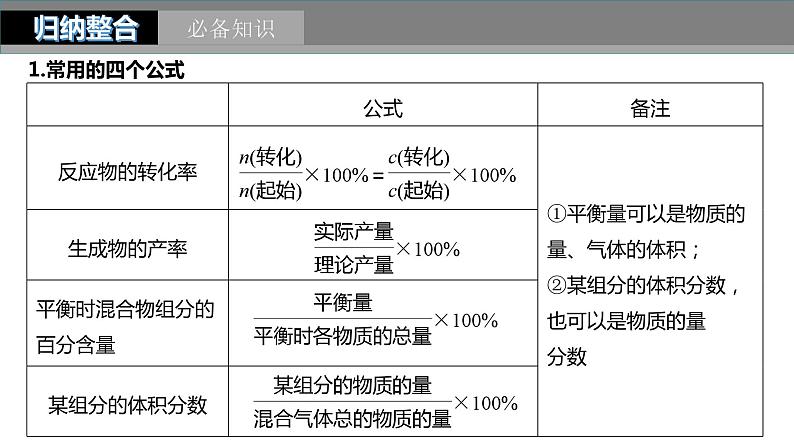











2024年高考化学一轮复习(新高考版) 第8章 第47讲 化学平衡常数的计算
展开1.对于反应2SiHCl3(g)SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。下列说法不正确的是( )
A.该反应的ΔH>0
B.a、b处反应速率大小关系:va大于vb
C.在343 K下,要提高SiHCl3的转化率,可以及时移去产物或增加反应物浓度
D.343 K时,SiHCl3的平衡转化率为22%,可以求得该温度下的平衡常数约为0.02
2.相同温度下,分别在起始体积均为1 L的两个密闭容器中发生反应:X2(g)+3Y2(g)2XY3(g) ΔH=-a kJ·mol-1,实验测得反应的有关数据如下表。
容器 | 反应条件 | 起始物质的量/mol | 达到平衡所用时间/min | 达到平衡过程中的能量变化 | ||
X2 | Y2 | XY3 | ||||
① | 恒容 | 1 | 3 | 0 | 10 | 放热0.1a kJ |
② | 恒压 | 1 | 3 | 0 | t | 放热b kJ |
下列叙述正确的是( )
A.对于上述反应,①②中反应的平衡常数K不同
B.①中:从开始至10 min内的平均反应速率v(X2)=0.1 mol·L-1·min-1
C.②中:X2的平衡转化率小于10%
D.b>0.1a
3.已知:2CrO+2H+Cr2O+H2O。25 ℃时,调节初始浓度为1.0 mol·L-1的Na2CrO4溶液的pH,测定平衡时溶液中c(Cr2O)和c(H+),获得如图所示的曲线。下列说法不正确的是( )
A.平衡时,pH越小,c(Cr2O)越大
B.A点CrO的平衡转化率为50%
C.A点CrO转化为Cr2O反应的平衡常数K=1014
D.平衡时,若溶液中c(Cr2O)=c(CrO),则c(H+)>2.0×10-7 mol·L-1
4.25 ℃时,向40 mL 0.05 mol·L-1的FeCl3溶液中一次性加入10 mL 0.15 mol·L-1的KSCN溶液,发生反应,混合溶液中c(Fe3+)随反应时间(t)的变化如图所示。下列说法正确的是( )
A.该反应的离子方程式为Fe3++3SCN-Fe(SCN)3↓
B.E点对应的坐标为(0,0.05)
C.t4时向溶液中加入50 mL 0.1 mol·L-1 KCl溶液,平衡不移动
D.若该反应是可逆反应,在25 ℃时平衡常数的数值为
5.某固定容积的密闭容器中发生反应:C(s)+CO2(g)2CO(g)。现向该容器内充入1.0 mol·
L-1的CO2,反应过程中气体体积分数随时间的变化情况如图所示。下列说法错误的是( )
A.t1 min时,CO2的转化率为25.0%
B.t2 min时,该反应体系未处于平衡状态
C.t3 min时,向该容器中再充入CO2和CO各1.0 mol·L-1,平衡正向移动
D.t3 min时,该反应的Kp=24.0p总[气体分压(p分)=气体总压(p总)×体积分数]
6.在容积恒为2 L的密闭容器中充入2 mol CH3OH(g)和2 mol CO(g),在一定温度下发生反应:CH3OH(g)+CO(g)HCOOCH3(g),测得容器内的压强随时间的变化如下表所示。
t/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 |
p/kPa | p0 | - | 0.8p0 | - | - | 0.7p0 | 0.7p0 | 0.7p0 |
在此条件,0~4 min的v(CH3OH)=______kPa·min-1,该反应的平衡常数Kp=______kPa-1(以分压表示,分压=总压×物质的量分数)。
7.1 mol CH3CH2OH和1 mol H2O充入恒容密闭容器中发生反应:2CO(g)+4H2(g)CH3CH2OH(g)+H2O(g),在550 K时,气体混合物中H2的物质的量分数x(H2)与反应时间t的关系如表所示。
t/min | 0 | 20 | 40 | 60 | 80 | 100 |
x(H2)/% | 0 | 15 | 29 | 40 | 48 | 48 |
上述反应中,正反应速率v正=k正·x2(CO)·x4(H2),逆反应速率v逆=k逆·x(CH3CH2OH)·x(H2O),其中k正、k逆为速率常数,则k逆=______________(以Kx和k正表示,其中Kx为用物质的量分数表示的平衡常数),若k逆=75 mol·L-1·min-1,在t=80 min时,v逆=______________。
8.乙烷在一定条件下可脱氢制得乙烯:C2H6(g)C2H4(g)+H2(g) ΔH>0。
(1)提高乙烷平衡转化率的措施有________________________________、______________。
(2)一定温度下,向恒容密闭容器中通入等物质的量的C2H6和H2,初始压强为100 kPa,发生上述反应,乙烷的平衡转化率为20%。平衡时体系的压强为________kPa,该反应的平衡常数Kp=________kPa (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
9.已知:N2O4(g)2NO2(g) ΔH>0。298 K时,将一定量N2O4气体充入恒容的密闭容器中发生反应。t1时刻反应达到平衡,混合气体平衡总压强为p,N2O4气体的平衡转化率为25%,则NO2的分压为________(分压=总压×物质的量分数),反应N2O4(g)2NO2(g)的平衡常数Kx=________[对于气相反应,用某组分B的物质的量分数x(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kx]。
10.亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO和Cl2反应得到,化学方程式为2NO(g)+Cl2(g)2NOCl(g)。
(1)在1 L恒容密闭容器中充入2 mol NO(g)和1 mol Cl2(g),在不同温度下测得c(NOCl)与时间t的关系如图A所示:
①反应开始到10 min时NO的平均反应速率v(NO)=________ mol·L-1·min-1。
②T2时该反应的平衡常数K=________。
③T2时Cl2的平衡转化率为__________。
(2)若按投料比n(NO)∶n(Cl2)=2∶1把NO和Cl2加入一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强p(总压)的关系如图B所示:
①该反应的ΔH____(填“>”“<”或“=”)0。
②在p压强条件下,M点时容器内NO的体积分数为________。
③若反应一直保持在p压强条件下进行,则M点的压强平衡常数Kp=________(用含p的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
第47讲 化学平衡常数的计算-2024年高考化学一轮复习高频考点精讲(新教材新高考)课件PPT: 这是一份第47讲 化学平衡常数的计算-2024年高考化学一轮复习高频考点精讲(新教材新高考)课件PPT,共45页。PPT课件主要包含了复习目标,考点一,压强平衡常数Kp,考点二,考点三等内容,欢迎下载使用。
2024年高考化学一轮复习(新高考版) 第8章 第46讲 化学平衡状态与平衡常数: 这是一份2024年高考化学一轮复习(新高考版) 第8章 第46讲 化学平衡状态与平衡常数,文件包含2024年高考化学一轮复习新高考版第8章第46讲化学平衡状态与平衡常数pptx、2024年高考化学一轮复习新高考版第8章第46讲化学平衡状态与平衡常数docx、第8章第46讲化学平衡状态与平衡常数docx、第8章第46练化学平衡状态与平衡常数docx等4份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
2024年高考化学一轮复习(新高考版) 第2章 第8讲 化学计算的常用方法: 这是一份2024年高考化学一轮复习(新高考版) 第2章 第8讲 化学计算的常用方法,文件包含2024年高考化学一轮复习新高考版第2章第8讲化学计算的常用方法pptx、2024年高考化学一轮复习新高考版第2章第8讲化学计算的常用方法docx、第2章第8讲化学计算的常用方法docx、第2章第8练化学计算的常用方法docx等4份课件配套教学资源,其中PPT共60页, 欢迎下载使用。












