






新高考化学一轮复习课件第8章 第47讲 化学平衡常数的计算(含解析)
展开1.掌握平衡常数和平衡转化率计算的一般方法。2.了解速率常数与化学平衡常数的关系并能进行有关计算。
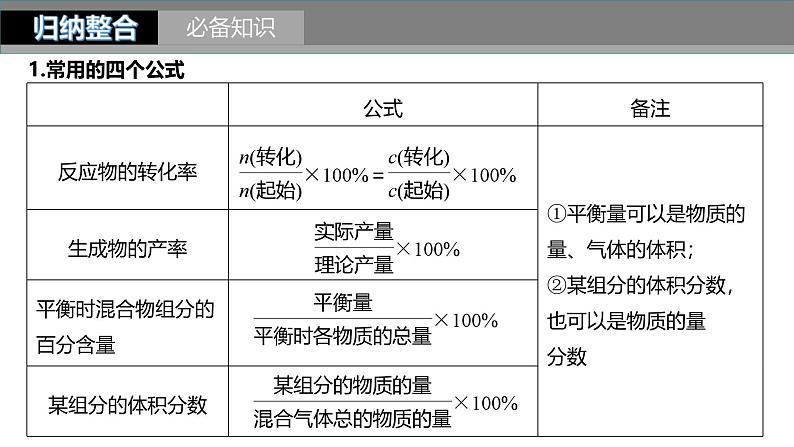
考点一 化学平衡常数与平衡转化率的计算
考点二 化学平衡常数与速率常数的关系
真题演练 明确考向
化学平衡常数与平衡转化率的计算
2.平衡常数的计算步骤(1)写出有关可逆反应的化学方程式,写出平衡常数表达式。(2)利用“三段式”(见化学反应速率及影响因素),确定各物质的起始浓度、转化浓度、平衡浓度。(3)将平衡浓度代入平衡常数表达式。(4)注意单位的统一。
3.压强平衡常数(1)以aA(g)+bB(g) cC(g)+dD(g)为例,
(2)计算方法①根据“三段式”法计算平衡体系中各物质的物质的量或物质的量浓度。②计算各气体组分的物质的量分数或体积分数。③根据分压计算公式求出各气体物质的分压,某气体的分压=气体总压强×该气体的体积分数(或物质的量分数)。④根据平衡常数计算公式代入计算。
例 一定温度和催化剂条件下,将1 ml N2和3 ml H2充入压强为p0的恒压容器中,测得平衡时N2的转化率为50%,计算该温度下的压强平衡常数(Kp)。
N2(g)+3H2(g) 2NH3(g)起始/ml 1 3 0变化/ml 0.5 1.5 1平衡/ml 0.5 1.5 1
一、平衡常数与转化率的相关计算1.已知在密闭容器中发生可逆反应:M(g)+N(g) P(g)+Q(g) ΔH>0。某温度下,反应物的起始浓度分别为c(M)=1 ml·L-1,c(N)=2.4 ml·L-1。思考并解答下列问题:(1)若达到平衡后,M的转化率为60%,列出“三段式”,计算此时N的平衡浓度是多少?平衡常数K是多少?
答案 M(g)+ N(g) P(g) + Q(g)起始/(ml·L-1) 1 2.4 0 0转化/(ml·L-1) 1×60% 1×60% 1×60% 1×60%平衡/(ml·L-1) 0.4 1.8 0.6 0.6
(2)若反应温度不变,反应物的起始浓度分别为c(M)=4 ml·L-1,c(N)=a ml·L-1;达到平衡后,c(P)=2 ml·L-1,则M的转化率为_______,N的起始浓度为___________。
M(g)+N(g) P(g)+Q(g)起始/(ml·L-1) 4 a 0 0转化/(ml·L-1) 2 2 2 2平衡/(ml·L-1) 2 a-2 2 2
2.(2021·重庆1月适应性测试,17)内酯在化工、医药、农林等领域有广泛的应用。内酯可以通过有机羧酸异构化制得。某羧酸A在0.2 ml·L-1盐酸中转化为内酯B的反应可表示为A(aq) B(aq),忽略反应前后溶液体积变化。一定温度下,当A的起始浓度为a ml·L-1时,A的转化率随时间的变化如下表所示:
(1)反应进行到100 min时,B的浓度为________ ml·L-1。
100 min时,A的转化率为45%,所以c(B)=0.45a ml·L-1。
(2)v正(t=50 min)______(填“>”“<”或“=”)v逆(t=∞ min)。
一定温度下,化学反应速率受反应物浓度影响,在反应建立平衡的过程中,反应物浓度不断减小,所以v正(t=50 min)>v逆(t=∞ min)=v正(t=∞ min)。
(3)增加A的起始浓度,A在t=∞ min时转化率将________(填“增大”“减小”或“不变”)。
A(aq) B(aq)起始/(ml·L-1) c 0转化/(ml·L-1) cα cα平衡/(ml·L-1) c-cα cα
(4)该温度下,平衡常数K=_____;在相同条件下,若反应开始时只加入B,B的起始浓度也为a ml·L-1,平衡时B的转化率为________。
A(aq) B(aq)起始/(ml·L-1) 0 a转化/(ml·L-1) x x平衡/(ml·L-1) x a-x
(5)研究发现,其他条件不变时,减小盐酸的浓度,反应速率减慢,但平衡时B的含量不变,原因是____________________________________________________________________。
盐酸是催化剂,浓度减小,反应速率减慢,催化剂不影响化学反应
二、压强平衡常数3.设 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100 kPa)。在某温度下,原料组成n(CO)∶n(NO)=1∶1,发生反应:2CO(g)+2NO(g) N2(g)+2CO2(g),初始总压为100 kPa的恒容密闭容器中进行上述反应,体系达到平衡时N2的分压为20 kPa,则该反应的相对压力平衡常数 =________。
恒容容器中压强之比等于气体的物质的量之比,所以可用压强代替物质的量来进行三段式的计算,根据题意有:2NO(g)+2CO(g) N2(g)+2CO2(g)起始/kPa 50 50 0 0转化/kPa 40 40 20 40平衡/kPa 10 10 20 40
4.在一刚性密闭容器中,CH4和CO2的分压分别为20 kPa、25 kPa,加入Ni/α-Al2O3催化剂并加热至1 123 K使其发生反应:CH4(g)+CO2(g) 2CO(g)+2H2(g)。达到平衡.后测得体系压强是起始时的1.8倍,则该反应的平衡常数的计算式为Kp=________ kPa2(用各物质的分压代替物质的量浓度计算)。
1 123 K恒容时,设达到平衡时CH4的转化分压为x kPa,列三段式: CH4(g)+CO2(g) 2CO(g)+2H2(g)起始分压/kPa 20 25 0 0转化分压/kPa x x 2x 2x平衡分压/kPa 20-x 25-x 2x 2x
化学平衡常数与速率常数的关系
例 温度为T1,在三个容积均为1 L的恒容密闭容器中仅发生反应:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.3 kJ·ml-1,该反应中,正反应速率为v正=k正·c(CH4)·c(H2O),逆反应速率为v逆=k逆·c(CO)·c3(H2),k正、k逆为速率常数,受温度影响。已知T1时,k正=k逆,则该温度下,平衡常数K1=____;当温度改变为T2时,若k正=1.5k逆,则T2______(填“>”“=”或“<”)T1。
解题步骤及过程:步骤1 代入特殊值:平衡时v正=v逆,即k正·c(CH4)·c(H2O)=k逆·c(CO)·c3(H2);步骤2 适当变式求平衡常数,
1.利用NH3的还原性可以消除氮氧化物的污染,其中除去NO的主要反应如下:4NH3(g)+6NO(g) 5N2(g)+6H2O(l) ΔH<0已知该反应速率v正=k正·c4(NH3)·c6 (NO),v逆=k逆·cx(N2)·cy(H2O) (k正、k逆分别是正、逆反应速率常数),该反应的平衡常数K= ,则x=____,y=_____。
2.乙烯气相直接水合法过程中会发生乙醇的异构化反应:C2H5OH(g) CH3OCH3(g) ΔH=+50.7 kJ·ml-1,该反应的速率方程可表示为v正=k正·c(C2H5OH)和v逆=k逆·c(CH3OCH3),k正和k逆只与温度有关。该反应的活化能Ea(正)_____(填“>”“=”或“<”)Ea(逆),已知:T ℃时,k正=0.006 s-1,k逆=0.002 s-1,该温度下向某恒容密闭容器中充入1.5 ml乙醇和4 ml甲醚,此时反应______(填“正向”或“逆向”)进行。
(1)试写出平衡常数K与速率常数k正、k逆之间的关系式为K=______(用含有k正、k逆的式子表示)。
(2)试求出图中c点时,上述反应的平衡常数K=_____ kPa-1。已知k逆=60 s-1,则速率常数k正=______s-1·kPa-1。
4.(2022·青岛高三模拟)乙烯、环氧乙烷是重要的化工原料,用途广泛。实验测得2CH2==CH2(g)+O2(g) 2 (g) ΔH<0中,v逆=k逆·c2( ),v正=k正·c2(CH2==CH2)·c(O2)(k正、k逆为速率常数,只与温度有关)。(1)反应达到平衡后,仅降低温度,下列说法正确的是____(填字母)。A.k正、k逆均增大,且k正增大的倍数更多B.k正、k逆均减小,且k正减小的倍数更少C.k正增大、k逆减小,平衡正向移动D.k正、k逆均减小,且k逆减小的倍数更少
该反应是放热反应,反应达到平衡后,仅降低温度,k正、k逆均减小,平衡向放热方向即正向移动,正反应速率大于逆反应速率,因此k正减小的倍数更少。
(2)若在1 L的密闭容器中充入1 ml CH2==CH2(g)和1 ml O2(g),在一定温度下只发生上述反应,经过10 min反应达到平衡,体系的压强变为原来的0.875倍,则0~10 min内v(O2)=____________________, =________。
0.025 ml·L-1·min-1
2CH2==CH2(g)+O2(g) 2 (g)开始/ml 1 1 0转化/ml 2x x 2x平衡/ml 1-2x 1-x 2x
5.(1)将CFe2O4负载在Al2O3上,产氧温度在1 200 ℃,产氢温度在1 000 ℃时,可顺利实现水的分解,氢气产量高且没有明显的烧结现象。循环机理如下,过程如图1所示,不考虑温度变化对反应ΔH的影响。
第Ⅱ步:CAl2O4(s)+2FeAl2O4(s)+H2O(g) CFe2O4(s)+3Al2O3(s)+H2(g) ΔH=b kJ·ml-1
第Ⅱ步反应的v正=k正·c(H2O),v逆=k逆·c(H2),k正、k逆分别为正、逆反应速率常数,仅与温度有关。1 000 ℃时,在体积为1 L的B反应器中加入2 ml H2O发生上述反应,测得H2O(g)和H2物质的量浓度随时间的变化如图2所示,则60 min内,v(CFe2O4)=______g·min-1(结果保留2位小数)。a点时,v正∶v逆=_____(填最简整数比)。
(2)在T2 K、1.0×104 kPa下,等物质的量的CO与CH4混合气体发生如下反应:CO(g)+CH4(g) CH3CHO(g)。反应速率v正-v逆=k正·p(CO)·p(CH4)-k逆·p(CH3CHO),k正、k逆分别为正、逆反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数Kp=4.5×10-5 kPa-1,则CO的转化率为20%时, =_____。
1.(2017·全国卷Ⅰ,28节选)H2S与CO2在高温下发生反应:H2S(g)+CO2(g) COS(g)+H2O(g)。在610 K时,将0.10 ml CO2与0.40 ml H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。(1)H2S的平衡转化率α1=______%,反应平衡常数K=_________(保留三位有效数字)。
设转化的H2S的物质的量为x ml, H2S(g)+ CO2(g) COS(g)+H2O(g)初始/ml 0.40 0.10 0 0转化/ml x x x x平衡/ml 0.40-x 0.10-x x x
(2)在620 K时重复实验,平衡后水的物质的量分数为0.03,H2S的转化率α2____(填“>”“<”或“=”,下同)α1,该反应的ΔH____0。
根据题目提供的数据可知温度由610 K升高到620 K时,化学反应达到平衡后水的物质的量分数由0.02变为0.03,所以H2S的转化率增大,α2>α1;根据题意可知,升高温度,化学平衡向正反应方向移动,所以该反应的正反应为吸热反应,故ΔH>0。
设容器中起始加入I2(g)和环戊烯的物质的量均为a,平衡时转化的环戊烯的物质的量为x,列出三段式:
(g) + I2(g) (g)+2HI(g)起始/ml a a 0 0转化/ml x x x 2x平衡/ml a-x a-x x 2x
3.(2022·全国甲卷,28节选)(1)TiO2转化为TiCl4有直接氯化法和碳氯化法。在1 000 ℃时反应的热化学方程式及其平衡常数如下:(ⅰ)直接氯化:TiO2(s)+2Cl2(g)===TiCl4(g)+O2(g) ΔH1=+172 kJ·ml-1,Kp1=1.0×10-2(ⅱ)碳氯化:TiO2(s)+2Cl2(g)+2C(s)===TiCl4(g)+2CO(g) ΔH2=-51 kJ·ml-1,Kp2=1.2×1012Pa反应2C(s)+O2(g)===2CO(g)的ΔH为________kJ·ml-1,Kp=__________Pa。
(2)在1.0×105 Pa,将TiO2、C、Cl2以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。反应C(s)+CO2(g)===2CO(g)的平衡常数Kp(1 400 ℃)=__________Pa。
4.(2022·湖南,16节选)在一定温度下,向体积固定的密闭容器中加入足量的C(s)和1 ml H2O(g),起始压强为0.2 MPa时,发生下列反应生成水煤气:Ⅰ.C(s)+H2O(g) CO(g)+H2(g)ΔH1=+131.4 kJ·ml-1Ⅱ.CO(g)+H2O(g) CO2(g)+H2(g) ΔH2=-41.1 kJ·ml-1反应平衡时,H2O(g)的转化率为50%,CO的物质的量为0.1 ml。此时,整个体系_______(填“吸收”或“放出”)热量_______kJ,反应Ⅰ的平衡常数Kp=__________(以分压表示,分压=总压×物质的量分数)。
反应达到平衡时,H2O(g)的转化率为50%,则水的变化量为0.5 ml,水的平衡量也是0.5 ml,由于CO的物质的量为0.1 ml,CO和CO2中的O均来自于H2O中,则根据O原子守恒可知CO2的物质的量为0.2 ml,生成0.2 ml CO2时消耗了0.2 ml CO,故在反应Ⅰ实际生成了0.3 ml CO。根据相关反应的热化学方程式可知,整个体系的热量变化为+131.4 kJ·ml-1×0.3 ml-41.1 kJ·ml-1×0.2 ml=39.42 kJ-8.22 kJ=31.2 kJ;由H原子守恒可知,平衡时H2的物质的量为0.5 ml,CO的物质的量为0.1 ml,CO2的物质的量为0.2 ml,水的物质的量为0.5 ml,则平衡时气体的总物质的量为0.5 ml+0.1 ml+0.2 ml+0.5 ml=1.3 ml,在同温同体积条件下,气体的总压之比等于气体的总物质的量之比,
1.对于反应2SiHCl3(g) SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。下列说法不正确的是A.该反应的ΔH>0B.a、b处反应速率大小关系:va大于vbC.在343 K下,要提高SiHCl3的转化率,可以及时移去产 物或增加反应物浓度D.343 K时,SiHCl3的平衡转化率为22%,可以求得该温 度下的平衡常数约为0.02
曲线a代表343 K时的反应,曲线b代表323 K时的反应,由图像可知,温度越高,SiHCl3的平衡转化率越大,所以该反应的ΔH>0,A项正确;a、b两点的转化率相等,可以认为各物质的浓度对应相等,而a点的温度更高,所以反应速率更快,即va>vb,B项正确;设初始加入的SiHCl3的浓度为1 ml·L-1, 2SiHCl3(g) SiH2Cl2(g)+SiCl4(g)起始/(ml·L-1) 1 0 0转化/(ml·L-1) 0.22 0.11 0.11平衡/(ml·L-1) 0.78 0.11 0.11
2.相同温度下,分别在起始体积均为1 L的两个密闭容器中发生反应:X2(g)+3Y2(g) 2XY3(g) ΔH=-a kJ·ml-1,实验测得反应的有关数据如下表。
下列叙述正确的是A.对于上述反应,①②中反应的平衡常数K不同B.①中:从开始至10 min内的平均反应速率v(X2)=0.1 ml·L-1·min-1C.②中:X2的平衡转化率小于10%D.b>0.1a
①②中反应温度相同,平衡常数K相同,A项错误;①中反应放热0.1a kJ,说明10 min内X2反应了0.1 ml,物质的量浓度改变量为0.1 ml·L-1,所以其平均速率为v(X2)=0.01 ml·L-1·min-1,B项错误;据容器①中数据,可算出X2的平衡转化率为10%,容器②是恒温恒压,容器①是恒温恒容,容器②相当于在容器①的基础上加压,平衡右移,所以X2的转化率大于10%,容器②放出的热量比容器①多,C项错误、D项正确。
4.25 ℃时,向40 mL 0.05 ml·L-1的FeCl3溶液中一次性加入10 mL 0.15 ml·L-1的KSCN溶液,发生反应,混合溶液中c(Fe3+)随反应时间(t)的变化如图所示。下列说法正确的是A.该反应的离子方程式为Fe3++3SCN- Fe(SCN)3↓B.E点对应的坐标为(0,0.05)C.t4时向溶液中加入50 mL 0.1 ml·L-1 KCl溶 液,平衡不移动
Fe3+与SCN-反应生成络合物,不是沉淀,离子方程式应为Fe3++3SCN- Fe(SCN)3,故A错误;
t4时向溶液中加入50 mL 0.1 ml·L-1 KCl溶液,相当于稀释溶液,平衡逆向移动,故C错误;
5.某固定容积的密闭容器中发生反应:C(s)+CO2(g) 2CO(g)。现向该容器内充入1.0 ml·L-1的CO2,反应过程中气体体积分数随时间的变化情况如图所示。下列说法错误的是A.t1 min时,CO2的转化率为25.0%B.t2 min时,该反应体系未处于平衡状态C.t3 min时,向该容器中再充入CO2和CO各 1.0 ml·L-1,平衡正向移动D.t3 min时,该反应的Kp=24.0p总[气体分压(p分) =气体总压(p总)×体积分数]
t1 min时,CO的体积分数为40.0%,设t1 min内反应消耗了a ml·L-1的CO2,则根据三段式法进行计算:C(s)+CO2(g) 2CO(g)起始/(ml·L-1) 1.0 0转化/(ml·L-1) a 2at1 min时/(ml·L-1) 1.0-a 2a
t3 min时反应达到平衡,设t3 min内反应消耗了b ml·L-1的CO2,根据三段式法进行计算: C(s)+CO2(g) 2CO(g)起始/(ml·L-1) 1.0 0转化/(ml·L-1) b 2b平衡/(ml·L-1) 1.0-b 2b
6.在容积恒为2 L的密闭容器中充入2 ml CH3OH(g)和2 ml CO(g),在一定温度下发生反应:CH3OH(g)+CO(g) HCOOCH3(g),测得容器内的压强随时间的变化如下表所示。
在此条件,0~4 min的v(CH3OH)=__________kPa·min-1,该反应的平衡常数Kp=______kPa-1(以分压表示,分压=总压×物质的量分数)。
CH3OH(g)+CO(g) HCOOCH3(g)起始/ml 2 2 0转化/ml x x x平衡/ml 2-x 2-x x
7.1 ml CH3CH2OH和1 ml H2O充入恒容密闭容器中发生反应:2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g),在550 K时,气体混合物中H2的物质的量分数x(H2)与反应时间t的关系如表所示。
上述反应中,正反应速率v正=k正·x2(CO)·x4(H2),逆反应速率v逆=k逆·x(CH3CH2OH)·x(H2O),其中k正、k逆为速率常数,则k逆=_______ (以Kx和k正表示,其中Kx为用物质的量分数表示的平衡常数),若k逆=75 ml·L-1·min-1,在t=80 min时,v逆=______________________。
1.47 ml·L-1·min-1
t=80 min时,H2的物质的量分数为48%,则CO的物质的量分数为24%,CH3CH2OH、H2O的物质的量分数均为14%。v逆=k逆·x(CH3CH2OH)·x(H2O)=75 ml·L-1·min-1×0.14×0.14=1.47 ml·L-1·min-1。
8.乙烷在一定条件下可脱氢制得乙烯:C2H6(g) C2H4(g)+H2(g) ΔH>0。(1)提高乙烷平衡转化率的措施有____________、___________________________。
降低压强 (或及时移出生成物)
(2)一定温度下,向恒容密闭容器中通入等物质的量的C2H6和H2,初始压强为100 kPa,发生上述反应,乙烷的平衡转化率为20%。平衡时体系的压强为______kPa,该反应的平衡常数Kp=___kPa (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
一定温度下,向恒容密闭容器中通入等物质的量的C2H6和H2,初始压强为100 kPa,发生上述反应,假设起始物质的量为1 ml,乙烷的平衡转化率为20%,可得三段式: C2H6(g) C2H4(g)+H2(g)起始/ml 1 0 1转化/ml 0.2 0.2 0.2平衡/ml 0.8 0.2 1.2
即平衡时体系的压强为110 kPa,该反应的平衡常数
9.已知:N2O4(g) 2NO2(g) ΔH>0。298 K时,将一定量N2O4气体充入恒容的密闭容器中发生反应。t1时刻反应达到平衡,混合气体平衡总压强为p,N2O4气体的平衡转化率为25%,则NO2的分压为_______(分压=总压×物质的量分数),反应N2O4(g) 2NO2(g)的平衡常数Kx=______[对于气相反应,用某组分B的物质的量分数x(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kx]。
10.亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO和Cl2反应得到,化学方程式为2NO(g)+Cl2(g) 2NOCl(g)。(1)在1 L恒容密闭容器中充入2 ml NO(g)和1 ml Cl2(g),在不同温度下测得c(NOCl)与时间t的关系如图A所示:①反应开始到10 min时NO的平均反应速率v(NO)=______ ml·L-1·min-1。
②T2时该反应的平衡常数K=_____。
③T2时Cl2的平衡转化率为__________。
(2)若按投料比n(NO)∶n(Cl2)=2∶1把NO和Cl2加入一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强p(总压)的关系如图B所示:①该反应的ΔH____(填“>”“<”或“=”)0。
根据图像,升高温度,平衡时NO的转化率减小,平衡逆向移动,说明该反应的正反应属于放热反应,ΔH<0。
②在p压强条件下,M点时容器内NO的体积分数为________。
③若反应一直保持在p压强条件下进行,则M点的压强平衡常数Kp=______(用含p的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
(人教版)高考化学一轮复习讲义课件第11章第47讲 化学平衡常数的综合计算(含解析): 这是一份(人教版)高考化学一轮复习讲义课件第11章第47讲 化学平衡常数的综合计算(含解析),共60页。PPT课件主要包含了练真题明考向,课时精练等内容,欢迎下载使用。
大单元四 第十一章 第47讲 化学平衡常数的综合计算-备战2025年高考化学大一轮复习课件(人教版): 这是一份大单元四 第十一章 第47讲 化学平衡常数的综合计算-备战2025年高考化学大一轮复习课件(人教版),文件包含大单元四第十一章第47讲化学平衡常数的综合计算pptx、大单元四第十一章第47讲化学平衡常数的综合计算教师版docx、大单元四第十一章第47讲化学平衡常数的综合计算学生版docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
第47讲 化学平衡常数的计算-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材): 这是一份第47讲 化学平衡常数的计算-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材),共60页。PPT课件主要包含了复习目标,内容索引,真题演练明确考向,专项突破,归纳整合,压强平衡常数Kp,变式训练,x05,多重平衡体系,连续反应等内容,欢迎下载使用。












