













2024年高考化学一轮复习(新高考版) 第4章 第15讲 铁及其氧化物和氢氧化物
展开第15讲 铁及其氧化物和氢氧化物
[复习目标] 1.掌握铁的主要性质及应用。2.知道不同价态的铁的氧化物的主要性质和用途。3.掌握Fe(OH)2、Fe(OH)3的性质及Fe(OH)2的制备方法。
考点一 铁及其氧化物
1.铁单质
(1)铁的物理性质
______色固体,熔点较高,具有良好的导热、导电、延展性,能被______吸引。
(2)铁的原子结构
Fe的价层电子排布式为______,铁位于元素周期表的第____周期第____族,是应用最广泛的过渡金属元素,其原子结构示意图:____________________________________________。
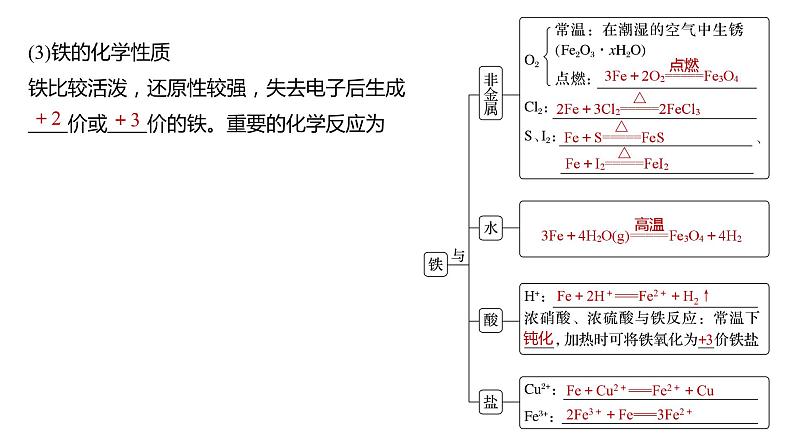
(3)铁的化学性质
铁比较活泼,还原性较强,失去电子后生成____价或____价的铁。重要的化学反应为
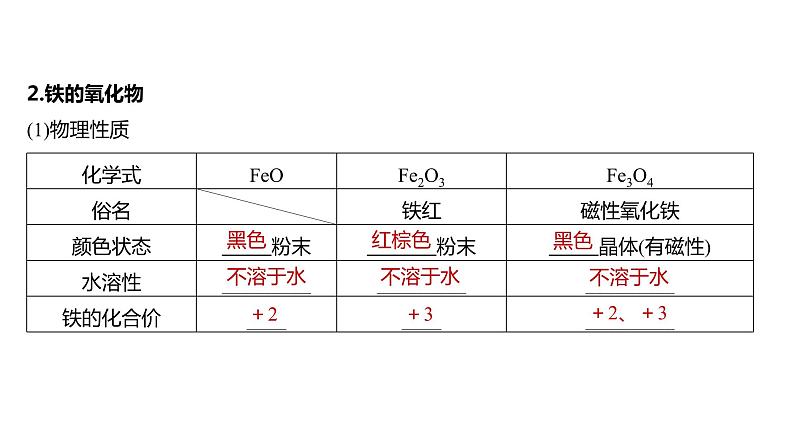
2.铁的氧化物
(1)物理性质
化学式 | FeO | Fe2O3 | Fe3O4 |
俗名 |
| 铁红 | 磁性氧化铁 |
颜色状态 | ______粉末 | ______粉末 | ______晶体(有磁性) |
水溶性 |
|
|
|
铁的化合价 |
|
|
|
(2)化学性质
①FeO、Fe2O3都属于碱性氧化物,能溶于强酸,分别写出它们溶于盐酸的离子方程式:________________________,______________________________________。
②铁的氧化物还能被CO、Al还原,以氧化铁为例写出化学方程式:________________________________________________________________________,
________________________________________________________________________。
③分别写出Fe3O4溶于足量稀硝酸、氢碘酸(HI)的离子方程式:______________、___________。
1.铁的化学性质比较活泼,所以铁在自然界中全部以化合态形式存在( )
2.Fe分别与Cl2和盐酸反应所得氯化物相同( )
3.常温下可用铁制容器储存、运输浓硝酸、浓硫酸( )
4.铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4( )
一、铁及其氧化物的性质与应用
1.下列叙述正确的是( )
A.Fe与I2反应生成FeI3
B.硫酸铜溶液中加入少量铁粉反应的离子方程式:3Cu2++2Fe===2Fe3++3Cu
C.5.6 g Fe与足量的S反应转移的电子数为0.3NA
D.高温下水蒸气与Fe反应,固体的质量增加
2.化学让生活更美好。下列说法不正确的是( )
A.钢铁使用要尽可能减少钢铁的氧化损耗,Fe2O3是一种碱性氧化物
B.常温下,铁的氧化物都不溶于水,也不与水反应
C.故宫是中国最大的古代文化艺术博物馆,氧化铁可作故宫红色外墙的涂料
D.氧化亚铁在空气中加热会被迅速氧化成三氧化二铁
3.铁与水蒸气反应实验改进前后的装置如图所示:
下列说法错误的是( )
A.将湿棉花改为浸水的尿不湿,酒精灯由单头改为双头,可提供足量的水蒸气
B.用具支试管可将试管口附近冷凝的水导出,避免冷凝水与灼热铁粉接触
C.肥皂液改为吹泡泡水,收集H2效果更好,点燃效果更明显
D.悬挂的磁铁仅能吸引铁粉,不能吸引反应产物
二、铁与酸反应的定量分析
4.向含有1 mol HNO3和1 mol H2SO4的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断不正确的是( )
A.a表示Fe3+的关系曲线
B.n1=0.75
C.P点时,n(Fe2+)=0.562 5 mol
D.向P点溶液中加入铜粉,最多可溶解14.4 g
三、铁的氧化物组成分析
5.准确称取某种铁的氧化物2.88 g,用足量的CO进行还原,将生成的CO2全部用足量的澄清石灰水吸收,得到沉淀4.00 g,计算该氧化物的化学式:__________。
6.(2022·丽江质检)有一块铁的“氧化物”样品,用140 mL 5.0 mol·L-1盐酸恰好将之完全溶解,所得溶液还能吸收0.025 mol Cl2,恰好使其中的Fe2+全部转变为Fe3+,则该样品的化学式可能为_________________________________________________。
确定铁的氧化物组成的基本方法
设铁的氧化物中铁元素与氧元素的质量比为m∶n,则氧化物中n(Fe)∶n(O)=∶=a∶b,
若a∶b=1∶1,则铁的氧化物为FeO;
若a∶b=2∶3,则铁的氧化物为Fe2O3;
若a∶b=3∶4,则铁的氧化物是Fe3O4或FeO与Fe2O3按物质的量之比为1∶1组成的混合物或FeO、Fe2O3、Fe3O4的混合物(其中FeO、Fe2O3的物质的量之比为1∶1,Fe3O4的物质的量为任意值)。
考点二 铁的氢氧化物
1.氢氧化铁和氢氧化亚铁的比较
化学式 | Fe(OH)2 | Fe(OH)3 |
色、态 | ____色固体 | ______色固体 |
与盐酸反应 |
|
|
受热分解 |
|
|
制法 | 可溶性亚铁盐与碱溶液反应:_______________________________________________ | 可溶性铁盐与碱溶液反应:____________ |
二者的 关系 | 在空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,现象是_____________________,最后变成______________,化学方程式为________________________________________ | |
2.Fe(OH)2的制备
(1)制备原理
①制备原理:Fe2++2OH-===Fe(OH)2↓。
②成功关键:溶液中不含O2等氧化性物质;制备过程中,保证生成的Fe(OH)2在密闭、隔绝空气的体系中。
(2)常用方法
有机覆盖层法 | 将吸有NaOH溶液的胶头滴管插到FeSO4溶液液面以下,并在液面上覆盖一层苯或煤油(不能用CCl4),以防止____________________发生反应 |
还原性气体保护法 | 先在装置Ⅰ中生成FeSO4溶液,并利用生成的H2将装置内的________排尽后,再把______溶液压入装置Ⅱ中与________混合,这样可长时间观察到白色沉淀 |
电解法 | 用铁作阳极,电解NaCl(或NaOH)溶液,并在液面上覆盖苯(或煤油) |
1.在空气中,白色的Fe(OH)2迅速转变成灰绿色,最终变成红褐色( )
2.FeCl3溶液滴入热的浓NaOH溶液中可得到Fe(OH)3胶体( )
3.Fe(OH)2与HNO3发生反应的离子方程式为Fe(OH)2+2H+===Fe2++2H2O( )
4.Fe(OH)3与氢碘酸反应生成FeI3( )
5.Fe(OH)3呈红褐色、透明,能产生丁达尔效应( )
6.Fe(OH)3在空气中加热分解生成Fe2O3,则Fe(OH)2在空气中加热分解生成FeO( )
7.制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁( )
氢氧化亚铁制备实验探究
1.用FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备Fe(OH)2。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需要加入________________。
(2)除去蒸馏水中溶解的O2常采用______的方法。
(3)生成Fe(OH)2白色沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是________________________________________
_______________________________________________________________________________。
2.下列各图示中能较长时间看到Fe(OH)2白色沉淀的是________(填序号)。
3.用如图所示装置(夹持仪器省略)制备氢氧化亚铁。
实验步骤如下:
Ⅰ.检查装置气密性后,关闭K2、K5、K6,打开K1、K3、K4,使装置A中产生的气体进入装置B中,排尽装置B中空气。
Ⅱ.待装置B中空气排尽后,关闭K3,打开K2,将装置A中溶液压入装置B中并观察现象。
Ⅲ.关闭K1、K2,打开K5、K6,使装置C中气体通入装置B中并观察现象。
回答下列问题:
(1)仪器a的名称是____________,B中长玻璃管的作用是______________________________。
(2)装置A中金属离子的检验方法是_______________________________________________。
(3)步骤 Ⅲ 装置B中的现象是_______________________________________________,
其发生反应的化学方程式为_______________________________________________。
4.利用电解实验可以制得纯净的Fe(OH)2白色沉淀,如图所示,已知两电极的材料分别为石墨和铁。
(1)a电极的材料应为_______________________________________________________,电极反应式为__________________________。
(2)电解液c可以是________(填字母)。
A.纯水 B.NaCl溶液
C.NaOH溶液 D.CuCl2溶液
(3)d为苯,其作用是___________________________________________________________,在加入苯之前对电解液c应作何简单处理?________________________________________。
(4)若c用Na2SO4溶液,当电解一段时间后看到白色Fe(OH)2沉淀,再反接电源电解,除了电极上看到气泡外,另一明显现象为_________________________________________________。
1.下列叙述不正确的是( )
A.浓硝酸与铁在常温下不反应,所以可用铁质容器贮运浓硝酸(2022·浙江6月选考,9C)
B.工人将模具干燥后再注入熔融钢水,是因为铁与H2O高温下会反应(2022·广东,6C)
C.将废铁屑加入FeCl2溶液中,可用于除去工业废气中的Cl2(2019·天津,3A)
D.铁锈的主要成分可表示为Fe2O3·nH2O(2020·浙江1月选考,9B)
2.下列关于铁及其化合物的说法正确的是( )
A.FeS2在沸腾炉中与O2反应主要生成SO3(2020·浙江7月选考,12C)
B.Mg加入到过量FeCl3溶液中可得Fe(2020·浙江7月选考,12B)
C.钢铁在潮湿空气中生锈主要是发生了电化学腐蚀(2020·浙江7月选考,8D)
D.室温下,Fe与浓H2SO4反应生成FeSO4(2020·江苏,6D)
新高考化学一轮复习精品课件 第4章 第15讲 铁及其氧化物和氢氧化物 (含解析): 这是一份新高考化学一轮复习精品课件 第4章 第15讲 铁及其氧化物和氢氧化物 (含解析),共60页。PPT课件主要包含了铁及其氧化物,必备知识,关键能力,铁的氢氧化物,真题演练明确考向,课时精练等内容,欢迎下载使用。
第12讲 铁及其氧化物和氢氧化物-2024年高考化学一轮复习高频考点精讲(新教材新高考)课件PPT: 这是一份第12讲 铁及其氧化物和氢氧化物-2024年高考化学一轮复习高频考点精讲(新教材新高考)课件PPT,共38页。PPT课件主要包含了目标导航,铁及其氧化物,考点一,必备知识,易错辨析,专项突破,归纳总结,铁的氢氧化物,考点二,真题演练等内容,欢迎下载使用。
2024年高考化学一轮复习课件(鲁科版)第3章 第12讲 铁及其氧化物和氢氧化物: 这是一份2024年高考化学一轮复习课件(鲁科版)第3章 第12讲 铁及其氧化物和氢氧化物,文件包含第3章第12讲铁及其氧化物和氢氧化物pptx、第3章第12练铁及其氧化物和氢氧化物docx、第3章第12讲铁及其氧化物和氢氧化物docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。












