




还剩15页未读,
继续阅读
成套系列资料,整套一键下载
人教版化学必修2 第六章 复习提纲(课件PPT)
展开
这是一份人教版化学必修2 第六章 复习提纲(课件PPT),共23页。
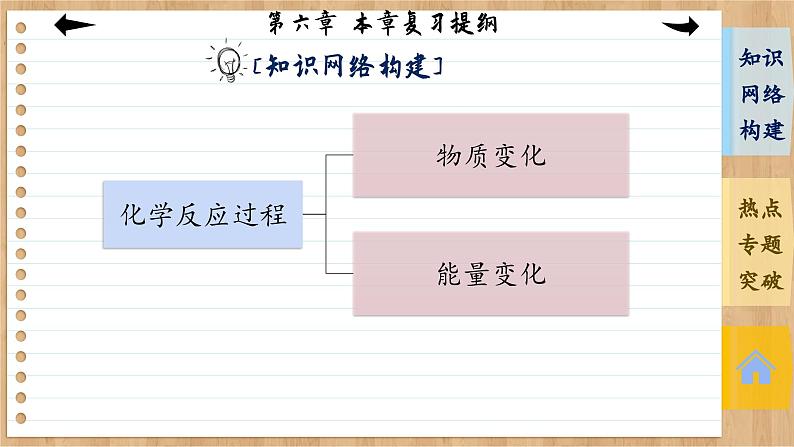
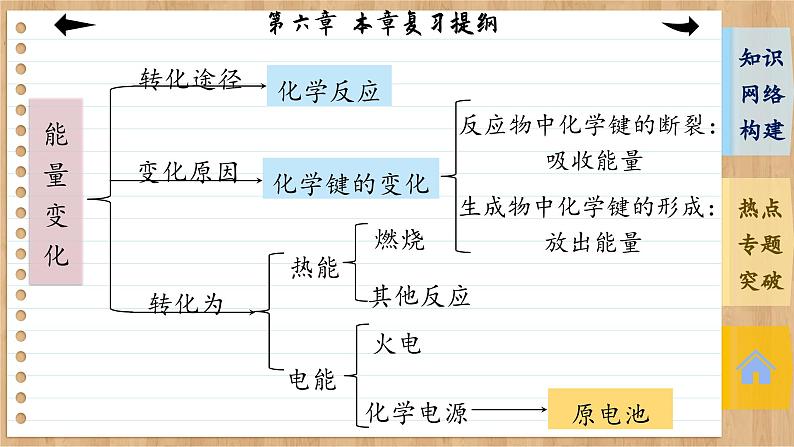
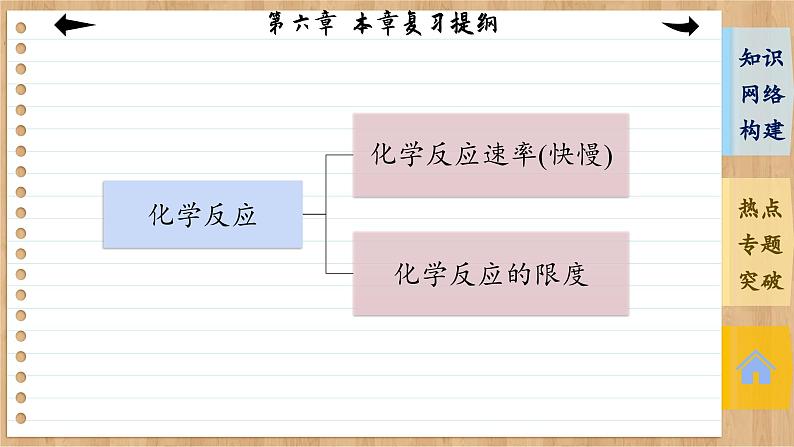
第六章 化学反应与能量 本章复习提纲转化途径变化原因转化为化学反应化学键的变化热能电能燃烧其他反应火电化学电源反应物中化学键的断裂:吸收能量生成物中化学键的形成:放出能量原电池原电池构成:活泼性不同的两电极;电解质溶液;自发进 行的氧化还原反应;闭合回路原理分类:一次电池与二次电池;燃料电池电子流向离子运动方向电极反应专题一 化学键与化学反应中的能量变化1.化学键的断裂与形成是化学反应中能量变化的主要原因(1)化学反应的本质是旧化学键的断裂和新化学键的形成。(2)化学键断裂要吸热,化学键形成要放热。吸收的热量和放出的热量数值不相等就造成了热效应。(3)反应物与生成物的能量差若以热能形式表现,即为放热或吸热。若二者能量比较接近,则放热或吸热不明显。2.吸热、放热与能量的关系3.化学反应中能量变化的计算(1)用E(反应物)表示反应物的总能量,E(生成物)表示生成物的总能量,ΔQ表示能量变化,则ΔQ=E(生成物)-E(反应物)。(2)用Q(吸)表示反应物化学键断裂时吸收的总能量,Q(放)表示生成物化学键形成时放出的总能量,ΔQ表示能量变化,则ΔQ=Q(吸)-Q(放)。例1 在1×105 Pa和298 K时,将1 mol气态AB分子分离成A原子和B原子所需要的能量称为键能(kJ·mol-1)。下面是一些共价键的键能(已知氨分子中有三个等价的氮氢共价键): (1) 根据上表中的数据判断工业合成氨的反应 N2(g)+3H2(g) ========= 2NH3(g)是________(填“吸热”或“放热”)反应。高温、高压催化剂 放热(2)在298 K时,取1 mol氮气和3 mol氢气放入一密闭容器中,在催化剂存在下进行反应,放出或吸收的热量为Q1,则Q1的数值为________。你作出此判断的原因是___________________________________________________________________________________________________________________________________________。<93 kJ 该反应为可逆反应,在密闭容器中进行反应达到平衡时,1 mol N2和3 mol H2不能完全反应生成2 mol NH3,因此放出的热量小于93 kJ解析:(1)化学反应的实质就是反应物化学键断裂、生成物化学键形成的过程,断裂化学键吸收能量,形成化学键放出能量。N2+3H2 ========== 2NH3的反应中断裂化学键共吸收的能量为945 kJ+3×436 kJ=2 253 kJ,形成化学键共放出的能量为2×3×391 kJ=2 346 kJ,所以该反应为放热反应。高温、高压催化剂(2)1 mol N2与3 mol H2完全反应时放出的热量为2 346 kJ-2 253 kJ=93 kJ,但该反应为可逆反应,在密闭容器中进行反应达到平衡时,1 mol N2和3 mol H2不能完全反应生成2 mol NH3,因此放出的热量小于93 kJ。专题二 有关化学反应速率的简单计算1.计算模式设a mol·L-1、b mol·L-1分别为A、B两物质的起始浓度,mx mol·L-1为反应物A的转化浓度,nx mol·L-1为反应物B的转化浓度,则: mA(g)+nB(g) ==== pC(g)+qD(g)起始浓度/(mol·L-1) a b 0 0转化浓度/(mol·L-1) mx nx px qx终态浓度/(mol·L-1) a-mx b-nx px qx2.基本步骤①确定反应物或生成物的起始加入量;②确定反应过程中各物质浓度的变化量;③确定反应进行至某时刻时各物质的量;④依据题干中的条件建立等式关系进行解答;⑤应用化学反应速率之比=浓度变化之比=物质的量变化之比=化学计量数之比进行解答。例2 向某体积固定的密闭容器中加入0.3 mol A、0.1 mol C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:(1)密闭容器的体积是________L。(2)若t1=15 s,则t0~t1阶段以C的物质的量浓度变化表示的反应速率为v(C)=____________________。(3)写出反应的化学方程式:_________________________。(4)B的起始物质的量是__________。20.004 mol·L-1·s-13A(g) ===== B(g)+2C(g) 0.04 mol 本课结束This lesson is overTHANKS!
第六章 化学反应与能量 本章复习提纲转化途径变化原因转化为化学反应化学键的变化热能电能燃烧其他反应火电化学电源反应物中化学键的断裂:吸收能量生成物中化学键的形成:放出能量原电池原电池构成:活泼性不同的两电极;电解质溶液;自发进 行的氧化还原反应;闭合回路原理分类:一次电池与二次电池;燃料电池电子流向离子运动方向电极反应专题一 化学键与化学反应中的能量变化1.化学键的断裂与形成是化学反应中能量变化的主要原因(1)化学反应的本质是旧化学键的断裂和新化学键的形成。(2)化学键断裂要吸热,化学键形成要放热。吸收的热量和放出的热量数值不相等就造成了热效应。(3)反应物与生成物的能量差若以热能形式表现,即为放热或吸热。若二者能量比较接近,则放热或吸热不明显。2.吸热、放热与能量的关系3.化学反应中能量变化的计算(1)用E(反应物)表示反应物的总能量,E(生成物)表示生成物的总能量,ΔQ表示能量变化,则ΔQ=E(生成物)-E(反应物)。(2)用Q(吸)表示反应物化学键断裂时吸收的总能量,Q(放)表示生成物化学键形成时放出的总能量,ΔQ表示能量变化,则ΔQ=Q(吸)-Q(放)。例1 在1×105 Pa和298 K时,将1 mol气态AB分子分离成A原子和B原子所需要的能量称为键能(kJ·mol-1)。下面是一些共价键的键能(已知氨分子中有三个等价的氮氢共价键): (1) 根据上表中的数据判断工业合成氨的反应 N2(g)+3H2(g) ========= 2NH3(g)是________(填“吸热”或“放热”)反应。高温、高压催化剂 放热(2)在298 K时,取1 mol氮气和3 mol氢气放入一密闭容器中,在催化剂存在下进行反应,放出或吸收的热量为Q1,则Q1的数值为________。你作出此判断的原因是___________________________________________________________________________________________________________________________________________。<93 kJ 该反应为可逆反应,在密闭容器中进行反应达到平衡时,1 mol N2和3 mol H2不能完全反应生成2 mol NH3,因此放出的热量小于93 kJ解析:(1)化学反应的实质就是反应物化学键断裂、生成物化学键形成的过程,断裂化学键吸收能量,形成化学键放出能量。N2+3H2 ========== 2NH3的反应中断裂化学键共吸收的能量为945 kJ+3×436 kJ=2 253 kJ,形成化学键共放出的能量为2×3×391 kJ=2 346 kJ,所以该反应为放热反应。高温、高压催化剂(2)1 mol N2与3 mol H2完全反应时放出的热量为2 346 kJ-2 253 kJ=93 kJ,但该反应为可逆反应,在密闭容器中进行反应达到平衡时,1 mol N2和3 mol H2不能完全反应生成2 mol NH3,因此放出的热量小于93 kJ。专题二 有关化学反应速率的简单计算1.计算模式设a mol·L-1、b mol·L-1分别为A、B两物质的起始浓度,mx mol·L-1为反应物A的转化浓度,nx mol·L-1为反应物B的转化浓度,则: mA(g)+nB(g) ==== pC(g)+qD(g)起始浓度/(mol·L-1) a b 0 0转化浓度/(mol·L-1) mx nx px qx终态浓度/(mol·L-1) a-mx b-nx px qx2.基本步骤①确定反应物或生成物的起始加入量;②确定反应过程中各物质浓度的变化量;③确定反应进行至某时刻时各物质的量;④依据题干中的条件建立等式关系进行解答;⑤应用化学反应速率之比=浓度变化之比=物质的量变化之比=化学计量数之比进行解答。例2 向某体积固定的密闭容器中加入0.3 mol A、0.1 mol C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:(1)密闭容器的体积是________L。(2)若t1=15 s,则t0~t1阶段以C的物质的量浓度变化表示的反应速率为v(C)=____________________。(3)写出反应的化学方程式:_________________________。(4)B的起始物质的量是__________。20.004 mol·L-1·s-13A(g) ===== B(g)+2C(g) 0.04 mol 本课结束This lesson is overTHANKS!
相关资料
更多









