
2021北京西城高二(上)期末化学(教师版)
展开2021北京西城高二(上)期末
化 学
2021.1
本试卷共9页,共100分。考试时长90分钟。考生务必将答案写在答题卡上,在试卷上作答无效。
可能用到的相对原子质量:C 12 N 14 Na 23
第一部分(选择题 共42分)
每小题只有一个选项符合题意(每小题3分)
1.下列装置或过程能实现电能转化为化学能的是
A | B | C | D |
锌锰干电池 | 燃气燃烧 | 电池充电 | 水力发电 |
2.下列物质属于弱电解质的是
A.NH3·H2O | B.NaOH | C.NaCl | D.H2SO4 |
3.CuCl2溶液中存在如下平衡:
下列可使黄绿色的CuCl2溶液变成蓝色的方法是
A.升温 | B.加NaCl(s) | C.加压 | D.加AgNO3溶液 |
4.工业上处理含CO、SO2烟道气的一种方法是将其在催化剂作用下转化为S和CO2。
已知:2CO(g) + O2(g) == 2CO2(g) ΔH=− 566 kJ/mol
S(s) + O2(g) == SO2(g) ΔH=− 296 kJ/mol
则该条件下2CO(g) + SO2(g) == S(s) + 2CO2(g)的ΔH等于
A.− 270 kJ/mol | B.+ 26 kJ/mol | C.− 582 kJ/mol | D.+ 270 kJ/mol |
5.锌铜原电池装置如右图,下列说法不正确的是
A.锌电极上发生氧化反应 |
B.电子从锌片经电流计流向铜片 |
C.盐桥中Cl−向正极移动 |
D.铜电极上发生反应:Cu2+ + 2e− == Cu |
6.我国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,主要过程如下图所示。
已知:
下列说法不正确的是
A.过程Ⅱ放出能量 B.若分解2 mol H2O(g),估算出反应吸收482 kJ能量 |
|
C.催化剂能减小水分解反应的焓变 D.催化剂能降低反应的活化能,增大反应物分子中活化分子的百分数 |
|
7.模拟铁制品镀铜的装置如右图,下列说法正确的是
A.a电极为铁制品 B.可用CuSO4溶液作电镀液 |
|
C.b电极上发生氧化反应 D.电镀过程中,溶液中Cu2+浓度不断减小 |
|
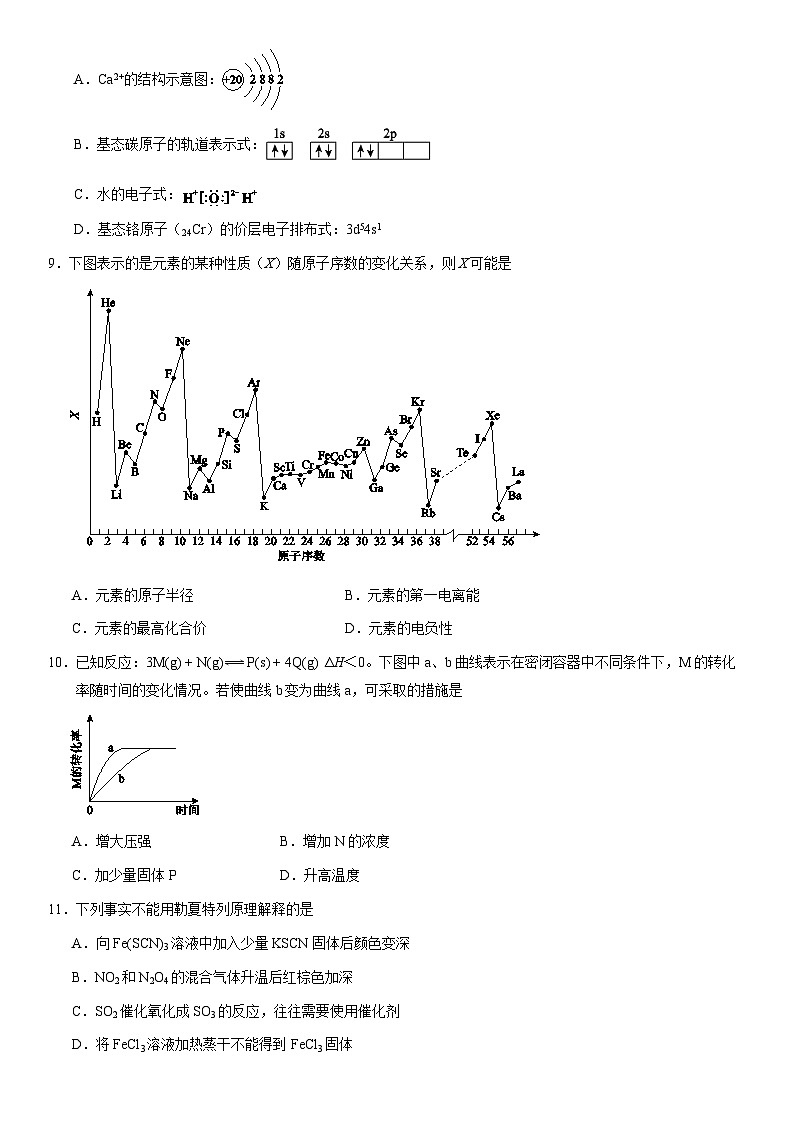
8.下列化学用语表示正确的是
A.Ca2+的结构示意图: B.基态碳原子的轨道表示式: |
|
C.水的电子式: D.基态铬原子(24Cr)的价层电子排布式:3d54s1 |
|
9.下图表示的是元素的某种性质(X)随原子序数的变化关系,则X可能是
A.元素的原子半径 | B.元素的第一电离能 |
C.元素的最高化合价 | D.元素的电负性 |
10.已知反应:3M(g) + N(g)P(s) + 4Q(g) ΔH<0。下图中a、b曲线表示在密闭容器中不同条件下,M的转化率随时间的变化情况。若使曲线b变为曲线a,可采取的措施是
A.增大压强 | B.增加N的浓度 |
C.加少量固体P | D.升高温度 |
11.下列事实不能用勒夏特列原理解释的是
A.向Fe(SCN)3溶液中加入少量KSCN固体后颜色变深 |
B.NO2和N2O4的混合气体升温后红棕色加深 |
C.SO2催化氧化成SO3的反应,往往需要使用催化剂 D.将FeCl3溶液加热蒸干不能得到FeCl3固体 |
12.下列用于解释事实的方程式书写不正确的是
A.将纯水加热至较高温度,水的pH变小:H2OH+ + OH− ΔH>0 |
B.用明矾[KAl(SO4)2·12H2O]作净水剂:Al3++ 3H2OAl(OH)3 + 3H+ |
C.向氢氧化镁悬浊液中滴入酚酞溶液,溶液变红:Mg(OH)2(s)Mg2+(aq) + 2OH−(aq) D.用饱和Na2CO3溶液处理锅炉水垢中的CaSO4:Ca2+ + CO32− == CaCO3 |
13.一定温度下,在三个1 L的恒容密闭容器中分别进行反应:2X(g) + Y(g)Z(g),达
到化学平衡状态时,相关数据如下表。下列说法不正确的是
实验 | 温度/K | 起始时各物质的浓度/(mol/L) | 平衡时物质的浓度/(mol/L) | ||||
c(X) | c(Y) | c(Z) | c(Z) | ||||
Ⅰ | 400 | 0.2 | 0.1 | 0 | 0.08 | ||
Ⅱ | 400 | 0.4 | 0.2 | 0.2 | a | ||
Ⅲ | 500 | 0.2 | 0.1 | 0 | 0.025 | ||
A.达到化学平衡时,Ⅰ中X的转化率为80% | |||||||
B.化学平衡常数:K(Ⅱ)=K(Ⅰ) | |||||||
C.达到化学平衡所需要的时间:Ⅲ<Ⅰ D.按Ⅱ中的起始浓度进行实验,反应逆向进行 | |||||||
14.研究小组将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1)。从胶头滴管中滴入醋酸溶液,容器中的压强随时间的变化曲线如图2。下列说法不正确的是
A.0―t1时压强增大的原因不一定是铁发生了析氢腐蚀 |
B.铁粉发生反应:Fe − 3e−== Fe3+ |
C.碳粉上发生了还原反应 D.t2时,容器中压强明显小于起始压强,原因是铁发生了吸氧腐蚀 |
第二部分(非选择题 共58分)
15.(8分)硼氢化钠(NaBH4)是一种储氢密度较高、价格低廉、兼具安全性与稳定性的
固态储氢材料。
(1)基态B原子中电子占据最高能级的符号是________,占据该能级电子的电子云轮廓图为________形。基态B原子中,核外存在________对自旋相反的电子。
(2)在周期表中,与B元素的化学性质最相似的邻族元素是______。
(3)将物质的量之比为3∶1的NaBH4固体和ScF3固体混合研磨,得到的复合储氢体系可以显著降低放氢温度。基态21Sc原子的简化电子排布式为________。
16.(8分)合成氨是人类科技发展史上的一项重大突破。
(1)在一定条件下,N2(g)和H2(g)反应生成0.2 mol NH3(g),放出9.24 kJ的热量,写出该可逆反应的热化学方程式:________。在右图中画出合成氨反应过程中焓(H )的变化示意图。
(2)将N2和H2通入体积为2 L的恒温恒容密闭容器中,5 min后达到化学平衡,测得NH3的浓度为0.2 mol/L,这段时间内用N2的浓度变化表示的化学反应速率为________mol/(L·min)。
(3)理论上,为了增大平衡时H2的转化率,可采取的措施是________(写出一条)。
(4)下图是某压强下N2和H2按物质的量之比1∶3投料进行反应,反应混合物中NH3
的物质的量分数随温度的变化曲线。Ⅰ是平衡时的曲线,Ⅱ是不同温度下反应经
过相同时间测得的曲线,下列说法正确的是________。
A.图中a点,容器内n(N2)∶n(NH3)=1∶4
B.图中b点,υ正 <υ逆
C.400~530 ℃,Ⅱ中NH3的物质的量分数随温度升高而增大,原因是升高温度化学反应速率增大
17.(12分)研究电解质在水溶液中的离子反应与平衡有重要的意义。
(1)常温下,用0.1 mol/L NaOH溶液滴定10 mL 0.1 mol/L CH3COOH溶液的滴定曲线如下图所示。
① a点溶液的pH ________1(填“>”、“<”或“=”,下同)。
② b点溶液中,c(Na+) ________c(CH3COO−)。
③ c点溶液中,c(Na+)________[c(CH3COO−) + c(CH3COOH)]。
④ 比较a、c两点水的电离程度:a ________c。
(2)已知:25 ℃时CH3COOH、H2CO3和HClO的电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 (Ka) | 1.75×10–5 | Ka1=4.5×10–7 Ka2=4.7×10–11 | 4.0×10–8 |
① CH3COOH的电离平衡常数表达式Ka=________。
② 25 ℃时,等物质的量浓度的NaClO溶液和CH3COONa溶液的pH关系为:
pH(NaClO) ________ pH(CH3COONa) (填“>”、“<”或“=”)。
③ 25 ℃时,若初始时醋酸中CH3COOH的物质的量浓度为0.01 mol/L,达到电离平衡时溶液中c(H+)= mol/L。(已知:=4.2)
④ 下列化学反应能发生的是________。
A.HClO + CH3COONa == CH3COOH + NaClO
B.CH3COOH + Na2CO3 == NaHCO3 + CH3COONa
C.CO2 + H2O + 2NaClO == Na2CO3 + 2HClO
18.(10分)降低能耗是氯碱工业发展的重要方向。
(1)我国利用氯碱厂生产的H2作燃料,将氢燃料电站应用于氯碱工业,其示意图如下。
① a极为________(填“正”或“负”)极。
② 乙装置中电解饱和NaCl溶液的化学方程式为________。
③ 下列说法正确的是________。
A. 甲装置可以实现化学能向电能转化
B. 甲装置中Na+透过阳离子交换膜向a极移动
C. 乙装置中c极一侧流出的是淡盐水
④ 结合化学用语解释d极区产生NaOH的原因:________。
⑤ 实际生产中,阳离子交换膜的损伤会造成OH−迁移至阳极区,从而在电解池阳极能检测到O2,产生O2的电极反应式为________。下列生产措施有利于提高Cl2产量、降低阳极O2含量的是________。
A.定期检查并更换阳离子交换膜
B.向阳极区加入适量盐酸
C.使用Cl−浓度高的精制饱和食盐水为原料
(2)降低氯碱工业能耗的另一种技术是“氧阴极技术”。通过向阴极区通入O2,避免水电离的H+直接得电子生成H2,降低了电解电压,电耗明显减少。“氧阴极技术”的阴极反应为________。
19.(10分)高铁酸盐在能源、环保等领域有着广泛的应用。
资料:高铁酸钾(K2FeO4)固体呈紫色,能溶于水,微溶于浓KOH溶液。K2FeO4在碱性溶液中性质稳定。
(1)研究人员用Ni、Fe作电极电解浓KOH溶液制备K2FeO4,装置示意图如下。
① Ni电极作________(填“阴”或“阳”)极。
② Fe电极上的电极反应为________。
③ 循环使用的物质是________(填化学式)溶液。
④ 向阳极流出液中加入饱和KOH溶液,析出紫色固体。试从平衡的角度解释析出固体的原因:________。
(2)K2FeO4可用于处理废水中的NaCN。用如下方法测定处理后的废水中NaCN的含量(废水中不含干扰测定的物质)。
资料:Ag+ + 2CN− == Ag(CN)2− Ag+ + I− == AgI↓(黄色)
CN−优先于I−与Ag+反应。
取a mL处理后的废水于锥形瓶中,滴加几滴KI溶液作指示剂,再用c mol/L AgNO3溶液滴定,消耗AgNO3溶液的体积为V mL。滴定终点时的现象是________,经处理后的废水中NaCN的含量为________g/L。(已知:NaCN的摩尔质量:49 g/mol)
20.(10分)实验小组制备硫代硫酸钠(Na2S2O3)并探究其性质。
资料:ⅰ.S2O32− + 2H+ == S↓+ SO2 ↑+ H2O。
ⅱ.Fe3+ + 3S2O32−Fe(S2O3)33−(紫黑色)。
ⅲ.Ag2S2O3是难溶于水、可溶于Na2S2O3溶液的白色固体。
(1)实验室可利用反应:2Na2S + Na2CO3 + 4SO2== 3Na2S2O3 + CO2制备Na2S2O3,装置
如下图。
① 用化学用语解释Na2S和Na2CO3的混合溶液呈碱性的原因:
S2− + H2OHS− + OH−、________。
② 为了保证Na2S2O3的产量,实验中通入的SO2不能过量。要控制SO2的生成速率,可以采取的措施有:________(写出一条)。
(2)探究Na2S2O3溶液与不同金属的硫酸盐溶液间反应的多样性。
实 验 | 试剂 | 现象 | |
试管 | 滴管 | ||
2 mL 0.1 mol/L Na2S2O3 溶液 | Ag2SO4溶液 (浓度约为0.03 mol/L) | Ⅰ.局部生成白色沉淀,振荡后 沉淀溶解,得到无色溶液 | |
0.03 mol/L Al2(SO4)3溶液 | Ⅱ.一段时间后,生成沉淀 | ||
0.03 mol/L Fe2(SO4)3溶液 | Ⅲ.混合后溶液先变成紫黑色, 30 s时溶液几乎变为无色 | ||
① Ⅰ中产生白色沉淀的离子方程式为________。
② 经检验,现象Ⅱ中的沉淀有Al(OH)3和S,用平衡移动原理解释Ⅱ中的现象:
________。
③ 经检验,现象Ⅲ中的无色溶液中含有Fe2+。从化学反应速率和限度的角度解释Ⅲ中Fe3+与S2O32−反应的实验现象:________。
以上实验说明:Na2S2O3溶液与金属阳离子反应的多样性和阳离子的性质有关。
2021北京西城高二(上)期末化学
参考答案
第一部分(选择题 共42分)
每小题3分。
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
答案 | C | A | D | A | C | C | B |
题号 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
答案 | D | B | A | C | D | D | B |
第二部分(非选择题 共58分)
说明:其他合理答案均可参照本标准给分。
15.(8分)
(1)2p(2分) 哑铃(2分) 2(2分)
(2)Si(1分)
(3)[Ar]3d14s2(1分)
16.(8分)
(1)N2(g)+3H2(g)2NH3(g) ΔH=− 92.4 kJ/mol(2分)
(1分)
(2)0.02(2分)
(3)降温、增大压强或及时分离出NH3 (2分)
(4)AC(1分)
17.(12分)
(1)① >(2分) ② =(2分)
③ =(2分) ④ <(2分)
(2)① (1分) ② >(1分)
③ 4.2×10–4(1分) ④ B(1分)
18.(10分)
(1)① 负 (1分)
② 2NaCl +2H2O ===== 2NaOH + H2↑+ Cl2↑(2分)
③ AC(2分)
④ d极发生反应:2H2O + 2e− == H2↑+ 2OH−生成OH−,且Na+从阳极区透过阳离子交换膜进入d极区,生成NaOH(2分)
⑤ 4OH−-4e− == O2↑+ 2H2O(1分) ABC(1分)
(2)O2 + 4e−+ 2H2O == 4OH−(1分)
19.(10分)
(1)① 阴(2分)
② Fe-6e− + 8OH−== FeO42− + 4H2O (2分)
③ KOH(2分)
④ 对平衡K2FeO4(s)2K+(aq) + FeO42−(aq),增大c(K+),溶液中的离子积c2(K+)·c(FeO42−)大于平衡常数,使平衡逆向进行,溶液析出固体(2分)
(2)产生黄色沉淀(1分) 98cV/a(1分)
20.(10分)
(1)① CO32− + H2OHCO3− + OH−(2分)
② 控制反应温度或调节硫酸的滴加速率(2分)
(2)① 2Ag+ + S2O32− == Ag2S2O3↓(2分)
② Al3+ + 3H2OAl(OH)3 + 3H+,S2O32−与H+反应生成S,使c(H+)降低,平衡
正向移动,生成Al(OH)3沉淀。(2分)
③ Fe3+与S2O32−反应生成紫黑色Fe(S2O3)33−的化学反应速率大,化学反应的限度相对小;Fe3+与S2O32−反应生成Fe2+的化学反应的限度相对大(2分)
2021北京西城高一(下)期末化学(教师版): 这是一份2021北京西城高一(下)期末化学(教师版),共24页。
2021北京西城高一(下)期末化学(教师版): 这是一份2021北京西城高一(下)期末化学(教师版),共24页。
2022北京西城高二(上)期末化学(教师版): 这是一份2022北京西城高二(上)期末化学(教师版),共19页。












