





2024年高考化学一轮总复习 第5单元 第2讲 盖斯定律及其应用 课件
展开第2讲 盖斯定律及其应用
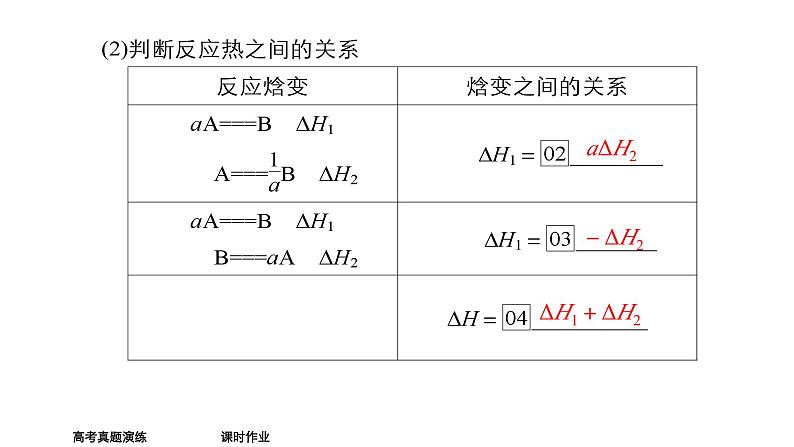
复习目标理解盖斯定律,并能运用盖斯定律进行有关反应焓变的简单计算。
反应放出的热量只和始态与终态有关,与过程无关。
生成液态水放出的热量更多,a
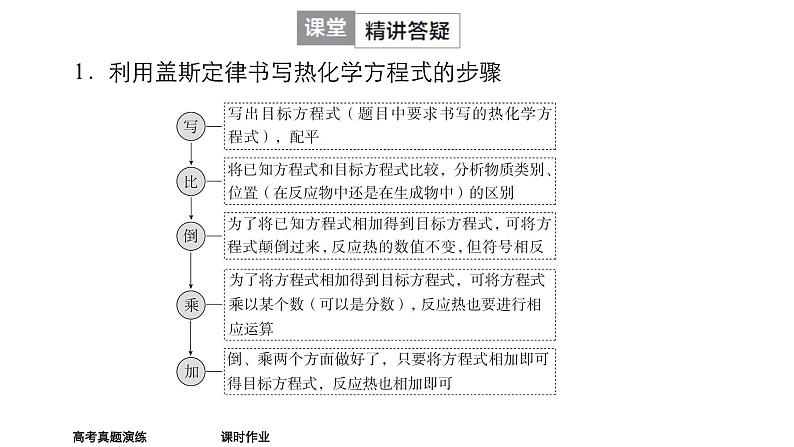
1.利用盖斯定律书写热化学方程式的步骤
(3)根据反应物或生成物的状态比较反应焓变的大小①S(g)+O2(g)===SO2(g) ΔH1②S(s)+O2(g)===SO2(g) ΔH2方法一:图像法由图像可知:|ΔH1|>|ΔH2|,但ΔH1<0,ΔH2<0,故ΔH1<ΔH2。方法二:通过盖斯定律构造新的热化学方程式由①-②可得S(g)===S(s) ΔH=ΔH1-ΔH2<0,故ΔH1<ΔH2。
角度二 利用盖斯定律书写热化学方程式3.发射“嫦娥”五号的火箭第一、二级发动机,所用的燃料为偏二甲肼和四氧化二氮,偏二甲肼可用肼来制备。用肼(N2H4)作燃料,四氧化二氮作氧化剂,二者反应生成氮气和气态水。已知:①N2(g)+2O2(g)===N2O4(g)ΔH=+10.7 kJ·ml-1②N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-543 kJ·ml-1写出气态肼和N2O4反应的热化学方程式:_________________________________________________________________。
2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g) ΔH=-1096.7 kJ·ml-1
4.近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:反应Ⅰ:2H2SO4(l)===2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·ml-1反应Ⅲ:S(s)+O2(g)===SO2(g)ΔH3=-297 kJ·ml-1反应Ⅱ的热化学方程式:________________________________________________________。
3SO2(g)+2H2O(g)===2H2SO4(l)+S(s) ΔH2=-254 kJ·ml-1
角度三 反应热的比较5.根据以下热化学方程式,ΔH1和ΔH2的大小比较错误的是( )A.2H2S(g)+3O2(g)===2SO2(g)+2H2O(l) ΔH12H2S(g)+O2(g)===2S(s)+2H2O(l) ΔH2 则有ΔH1>ΔH2B.Br2(g)+H2(g)===2HBr(g) ΔH1Br2(l)+H2(g)===2HBr(g) ΔH2则有ΔH1<ΔH2C.4Al(s)+3O2(g)===2Al2O3(s) ΔH14Fe(s)+3O2(g)===2Fe2O3(s) ΔH2则有ΔH1<ΔH2D.Cl2(g)+H2(g)===2HCl(g) ΔH1Br2(g)+H2(g)===2HBr(g) ΔH2则有ΔH1<ΔH2
解析将A项的热化学方程式依次编号为①②,根据盖斯定律,由①-②可得2S(s)+2O2(g)===2SO2(g) ΔH=ΔH1-ΔH2<0,即ΔH1<ΔH2,A错误。
6.Li/Li2O体系的能量循环如图所示。下列说法正确的是( )A.ΔH3<0B.ΔH3+ΔH4+ΔH5=ΔH6C.ΔH6>ΔH5D.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0
解析由O2的气态分子变为气态原子,需要断裂分子中的化学键,因此要吸收能量,ΔH3>0,A错误;物质含有的能量只与物质的始态与终态有关,与反应途径无关,根据物质转化关系可知,ΔH1+ΔH2+ΔH3+ΔH4+ΔH5=ΔH6,B、D错误;ΔH1+ΔH2+ΔH3+ΔH4+ΔH5=ΔH6,ΔH1>0,ΔH2>0,ΔH3>0,ΔH4>0,所以ΔH6>ΔH5,C正确。
1.(2021·浙江高考)相同温度和压强下,关于反应的ΔH,下列判断正确的是( ) A.ΔH1>0,ΔH2>0B.ΔH3=ΔH1+ΔH2C.ΔH1>ΔH2,ΔH3>ΔH2D.ΔH2=ΔH3+ΔH4
解析一般,烯烃与氢气发生的加成反应为放热反应,且放出的热量与碳碳双键的数目大致成正比,故ΔH1>ΔH2。苯环结构的特殊性决定了苯环结构的稳定性,苯与氢气发生加成反应生成环己烷比1,3环己二烯与H2发生加成反应生成环己烷所放出的热量少,故ΔH3>ΔH2。
2.(2020·北京高考)依据图示关系,下列说法不正确的是( )A.石墨燃烧是放热反应B.1 ml C(石墨)和1 ml CO分别在足量O2中燃烧,全部转化为CO2,前者放热多C.C(石墨)+CO2(g)===2CO(g) ΔH=ΔH1-ΔH2D.化学反应的ΔH,只与反应体系的始态和终态有关,与反应途径无关
3.(1)(2022·全国甲卷节选)TiO2转化为TiCl4有直接氯化法和碳氯化法。在1000 ℃时反应的热化学方程式及其平衡常数如下:(ⅰ)直接氯化:TiO2(s)+2Cl2(g)===TiCl4(g)+O2(g) ΔH1=172 kJ·ml-1,Kp1=1.0×10-2(ⅱ)碳氯化:TiO2(s)+2Cl2(g)+2C(s)===TiCl4(g)+2CO(g) ΔH2=-51 kJ·ml-1,Kp2=1.2×1012 Pa反应2C(s)+O2(g)===2CO(g)的ΔH为________kJ·ml-1,Kp=____________Pa。
(2)(2022·全国乙卷节选)已知下列反应的热化学方程式:①2H2S(g)+3O2(g)===2SO2(g)+2H2O(g)ΔH1=-1036 kJ·ml-1②4H2S(g)+2SO2(g)===3S2(g)+4H2O(g)ΔH2=94 kJ·ml-1③2H2(g)+O2(g)===2H2O(g) ΔH3=-484 kJ·ml-1计算H2S热分解反应④2H2S(g)===S2(g)+2H2(g)的ΔH4=________ kJ·ml-1。
4.(1)(2022·广东高考节选)催化剂Cr2O3可由(NH4)2Cr2O7加热分解制备,反应同时生成无污染气体。Cr2O3催化丙烷脱氢过程中,部分反应历程如图,X(g)―→Y(g)过程的焓变为__________________________(列式表示)。
(E1-E2)+ΔH+(E3-E4)
解析(1)设反应过程中第一步的产物为M,第二步的产物为N,则X―→M ΔH1=(E1-E2),M―→N ΔH2=ΔH,N―→Y ΔH3=(E3-E4),根据盖斯定律可知,X(g) ―→Y(g)的焓变为ΔH1+ΔH2+ΔH3=(E1-E2)+ΔH+(E3-E4)。(2)根据盖斯定律可得,①+②+2×③可得反应CaO(s)+2Al(s)+7H2O(l)===Ca2+(aq)+2[Al(OH)4]-(aq)+3H2(g),则ΔH4=ΔH1+ΔH2+2ΔH3=(-65.17 kJ·ml-1)+(-16.73 kJ·ml-1)+2×(-415.0 kJ·ml-1)=-911.9 kJ·ml-1。
5.(2021·全国甲卷节选)二氧化碳加氢制甲醇的总反应可表示为:CO2(g)+3H2(g)===CH3OH(g)+H2O(g)该反应一般认为通过如下步骤来实现:①CO2(g)+H2(g)===CO(g)+H2O(g)ΔH1=+41 kJ·ml-1②CO(g)+2H2(g)===CH3OH(g)ΔH2=-90 kJ·ml-1
总反应的ΔH=________kJ·ml-1;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是________(填标号),判断的理由是__________________________________________________________。
ΔH1为正值,ΔH2和ΔH为负值,反应①的活化能大于反应②的
(2)(2020·全国卷Ⅱ节选)乙烷在一定条件可发生如下反应:C2H6(g)===C2H4(g)+H2(g) ΔH,相关物质的燃烧热数据如下表所示:ΔH=________kJ·ml-1。
课时作业建议用时:40分钟
一、选择题(每小题只有1个选项符合题意)1.已知△(g)+H2(g)―→CH3CH2CH3(g) ΔH=-157 kJ·ml-1。已知环丙烷(g)的燃烧热ΔH=-2092 kJ·ml-1,丙烷(g)的燃烧热ΔH=-2220 kJ·ml-1,1 ml液态水蒸发为气态水的焓变为ΔH=+44 kJ·ml-1。则2 ml氢气完全燃烧生成气态水的ΔH(kJ·ml-1)为( )A.-658 B.-482C.-329 D.-285
4.根据Ca(OH)2/CaO体系的能量循环图:下列说法正确的是( )A.ΔH5>0B.ΔH1+ΔH2=0C.ΔH3=ΔH4+ΔH5D.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5=0
5.(2022·天津市和平区高三期末考试)用一氧化碳还原氮氧化物,可防止氮氧化物污染。已知:ⅰ.2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·ml-1ⅱ.N2(g)+O2(g)===2NO(g) ΔH=+181 kJ·ml-1ⅲ.2CO(g)+2NO(g)===2CO2(g)+N2(g) ΔH=-747 kJ·ml-1则12 g C(s)完全燃烧所放出的热量为( )A.787 kJ B.221 kJC.393.5 kJ D.442 kJ
解析根据盖斯定律,将题中所给三个反应ⅰ、ⅱ、ⅲ直接加和可得:2C(s)+2O2(g)===2CO2(g) ΔH=-787 kJ·ml-1,由此可得12 g C(s)完全燃烧所放出的热量为393.5 kJ。
10.已知:①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.31 kJ·ml-1②2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH=-1452 kJ·ml-1③H2O(g)===H2O(l) ΔH=-44.0 kJ·ml-1下列说法不正确的是( )A.CH3OH(l)的燃烧热ΔH=-1452 kJ·ml-1B.3CH4(g)+CO2(g)+2H2O(l)===4CH3OH(l) ΔH=+585.07 kJ·ml-1C.等物质的量的CH4(g)和CH3OH(l)完全燃烧,CH4(g)放出的热量更多D.在中性溶液中,CH4(g)和O2(g)能形成燃料电池
解析由②+③×4可得2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)的ΔH=[-1452+(-44)×4] kJ·ml-1=-1628 kJ·ml-1,所以2 ml甲醇完全燃烧放出的热量为1628 kJ,则1 ml甲醇完全燃烧放出的热量应为814 kJ,所以甲醇的燃烧热ΔH=-814 kJ·ml-1,故A错误;根据盖斯定律,①×3-(②+③×4)×2可得3CH4(g)+CO2(g)+2H2O(l)===4CH3OH(l)的ΔH={-890.31×3-[-1452+(-44)×4]×2} kJ·ml-1=+585.07 kJ·ml-1,故B正确;根据①可知1 ml甲烷完全燃烧放出的热量为890.31 kJ,根据A项分析可知1 ml甲醇完全燃烧放出的热量为814 kJ,所以甲烷放出的热量多,故C正确;只要溶液为电解质溶液且形成闭合回路,就可以形成燃料电池,故D正确。
11.下列各组中两个反应的反应热,其中ΔH1>ΔH2的是( )A.2H2(g)+O2(g)===2H2O(g) ΔH1 2H2(g)+O2(g)===2H2O(l) ΔH2B.S(g)+O2(g)===SO2(g) ΔH1 S(s)+O2(g)===SO2(g) ΔH2C.2SO2(g)+O2(g)===2SO3(g) ΔH1 2SO3(g)===O2(g)+2SO2(g) ΔH2D.已知反应: C(s,金刚石)===C(s,石墨) ΔH<0, C(s,金刚石)+O2(g)===CO2(g) ΔH1 C(s,石墨)+O2(g)===CO2(g) ΔH2
解析 A项,由于2H2O(l)===2H2O(g) ΔH>0,则ΔH2+ΔH=ΔH1,ΔH1-ΔH2=ΔH>0,故ΔH1>ΔH2,正确。
下列说法不正确的是( )A.该过程实现了太阳能到化学能的转化B.SO2和I2对总反应起到了催化剂的作用C.总反应的热化学方程式为:2H2O(l)===2H2(g)+O2(g) ΔH=+286 kJ·ml-1D.该过程降低了水分解制氢反应的活化能,总反应的ΔH不变
CO2(g)+3H2(g)===CH3OH(l)+H2O(l) ΔH=-130.9 kJ·ml-1
4NH3(g)+3O2(g)===2N2(g)+6H2O(g) ΔH=-1266 kJ/ml
(3)用NH3催化还原NOx可以消除氮氧化物的污染。例如:4NH3(g)+3O2(g)===2N2(g)+6H2O(g)ΔH1=-a kJ/ml ①N2(g)+O2(g)===2NO(g)ΔH2=-b kJ/ml ②若1 ml NH3还原NO至N2,则该反应过程中的反应热ΔH3=________kJ/ml(用含a、b的式子表示)。
(1)多种短周期非金属元素的气态氧化物常会造成一些环境污染问题,化学工作者设计出将工业废气中污染物再利用的方案,以消除这些不利影响。以NH3、CO2为原料生产重要的高效氮肥——尿素[CO(NH2)2],两步反应的能量变化示意图如下:
2NH3(g)+CO2(g)===H2O(g)+CO(NH2)2(s)的ΔH=____________________(用Ea1、Ea2、Ea3、Ea4表示)。已知Ea1
人教版高三化学一轮总复习--突破盖斯定律型高考题: 这是一份人教版高三化学一轮总复习--突破盖斯定律型高考题,共18页。PPT课件主要包含了总结归纳,答案是,复习引入等内容,欢迎下载使用。
人教版2022届高中化学一轮复习课件 第16讲 反应热 盖斯定律: 这是一份人教版2022届高中化学一轮复习课件 第16讲 反应热 盖斯定律,共60页。PPT课件主要包含了考点透视,栏目导航,课堂评价,考前8min,+137,-116,kJmol,生成物,反应物,-5716等内容,欢迎下载使用。
人教版 (新课标)选修4 化学反应原理第三节 化学反应热的计算课文内容课件ppt: 这是一份人教版 (新课标)选修4 化学反应原理第三节 化学反应热的计算课文内容课件ppt,共21页。PPT课件主要包含了温故知新,①+②③,影响反应热的因素,盖斯定律,△H20,△H10,S始态,L终态,如何理解盖斯定律,ΔHΔH1+ΔH2等内容,欢迎下载使用。












