














2025年高考化学大一轮大单元四 第十章 第39讲 盖斯定律及应用(课件+讲义+练习)
展开1、全面、系统复习回顾基本知识。了解知识规律的来龙去脉,透彻理解概念的内涵外延,让学生经历教材由薄变厚的过程。要正确理解基础,不是会做几个简单题就叫基础扎实。对于一轮复习,基础就是像盖房子一样,需要着力做好两件大事:一是夯实地基,二是打好框架。2、扎实训练学科基本技能、理解感悟学科基本方法。一轮复习,要以教材为本,全面细致的回顾课本知识,让学生树立“教材是最好的复习资料”的观点,先引导学生对教材中所涉及的每个知识点进行重新梳理,对教材中的概念、定理、定律进一步强化理解。3、培养学生积极的学习态度、良好的复习习惯和运用科学思维方法、分析解决问题的能力。落实解题的三重境界:一是“解”,解决问题。二是“思”,总结解题经验和方法。三是“归”,回归到高考能力要求上去。解题上强化学生落实三个字:慢(审题),快(书写),全(要点全面,答题步骤规范)。 4、有计划、有步骤、有措施地指导学生补齐短板。高三复习要突出重点,切忌主次不分,无的放矢。要在“精讲”上下足功夫。抓住学情,讲难点、重点、易混点、薄弱点;讲思路、技巧、规范;讲到关键处,讲到点子上,讲到学生心里去。
2025年高考化学大一轮复习
1.掌握盖斯定律的内容及意义,并能进行有关反应热的计算。2.能综合利用反应热和盖斯定律比较不同反应体系反应热的大小。
考点一 盖斯定律与反应热的计算
考点二 反应热大小的比较
盖斯定律与反应热的计算
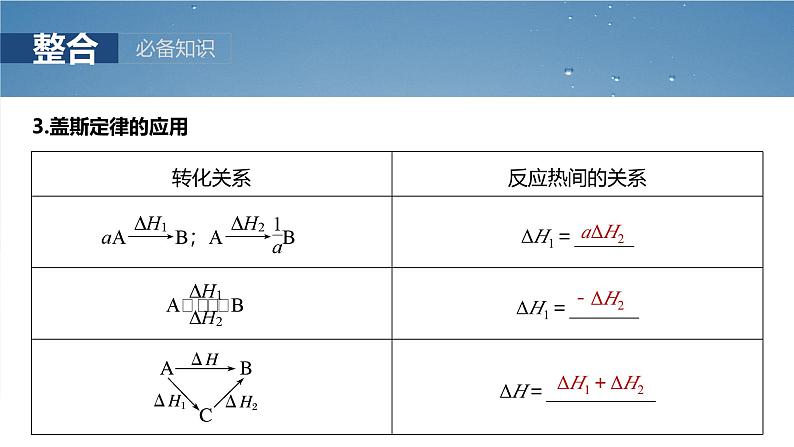
1.盖斯定律的内容一个化学反应,不管是一步完成的还是分几步完成的,其反应热是相同的。即化学反应的反应热只与反应体系的 有关,而与 无关。2.盖斯定律的意义间接计算某些反应的反应热。
一、应用循环图分析焓变关系1.(2022·重庆,13)“千畦细浪舞晴空”,氮肥保障了现代农业的丰收。为探究(NH4)2SO4的离子键强弱,设计如图所示的循环过程,可得ΔH4/(kJ· ml-1)为A.+533 B.+686 C.+838 D.+1 143
③Cl-(g)===Cl-(aq) ΔH3=-378 kJ·ml-1;
则⑤+①-⑥-②+③得④,ΔH4=+838 kJ· ml-1, C正确。
2.[2018·北京,27(1)]近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
反应Ⅰ:2H2SO4(l)===2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·ml-1反应Ⅲ:S(s)+O2(g)===SO2(g) ΔH3=-297 kJ·ml-1反应Ⅱ的热化学方程式:________________________________________________________________。
3SO2(g)+2H2O(g)===2H2SO4(l)+S(s) ΔH2=
-254 kJ·ml-1
3.[2023·山东,20(1)]一定条件下,水气变换反应CO+H2O CO2+H2的中间产物是HCOOH。为探究该反应过程,研究HCOOH水溶液在密封石英管中的分解反应:Ⅰ.HCOOH CO+H2O(快)Ⅱ.HCOOH CO2+H2(慢)一定条件下,反应Ⅰ、Ⅱ的焓变分别为ΔH1、ΔH2,则该条件下水气变换反应的焓变ΔH=____________(用含ΔH1、ΔH2的代数式表示)。
根据盖斯定律,反应Ⅱ-反应Ⅰ=水气变换反应,故水气变换反应的焓变ΔH=ΔH2-ΔH1。
4.[2023·全国乙卷,28(2)改编]硫酸亚铁在工农业生产中有许多用途,如可用作农药防治小麦黑穗病,制造磁性氧化铁、铁催化剂等。已知下列热化学方程式:FeSO4·7H2O(s)===FeSO4(s)+7H2O(g) ΔH1=a kJ·ml-1FeSO4·4H2O(s)===FeSO4(s)+4H2O(g) ΔH2=b kJ·ml-1FeSO4·H2O(s)===FeSO4(s)+H2O(g) ΔH3=c kJ·ml-1则FeSO4·7H2O(s)+FeSO4·H2O(s)===2(FeSO4·4H2O)(s)的ΔH=____________kJ·ml-1。
5.[2023·湖南,16(1)]已知下列反应的热化学方程式:
②C6H5CH===CH2(g)+10O2(g)===8CO2(g)+4H2O(g) ΔH2=-4 263.1 kJ·ml-1
计算反应④C6H5C2H5(g) C6H5CH==CH2(g)+H2(g)的ΔH4=________kJ·ml-1。
根据盖斯定律,将①-②-③可得C6H5C2H5(g) C6H5CH==CH2(g)+H2(g) ΔH4=-4 386.9 kJ·ml-1-(-4 263.1 kJ·ml-1)-(-241.8 kJ·ml-1)=+118 kJ·ml-1。
消元法计算反应热的思维流程
比较反应热大小注意事项(1)在比较反应热(ΔH)的大小时,应带符号比较。(2)同一物质,不同聚集状态时具有的能量不同,相同量的某物质的能量关系:E(物质R,g)>E(物质R,l)>E(物质R,s)。(3)同一化学反应,反应物的用量越多,|ΔH|越大。对于可逆反应,因反应不能进行完全,实际反应过程中放出或吸收的热量要小于理论数值。(4)等量的可燃物完全燃烧所放出的热量比不完全燃烧所放出的热量多,则完全燃烧的ΔH较小。
一、画能量变化图比较反应热大小(同一反应,物质聚集状态不同时)
1.已知:S(g)+O2(g)===SO2(g) ΔH1<0S(s)+O2(g)===SO2(g) ΔH2<0比较ΔH1与ΔH2的大小。
2.已知石墨比金刚石稳定,C(s,石墨)+O2(g)===CO2(g) ΔH1=-a kJ·ml-1C(s,金刚石)+O2(g)===CO2(g) ΔH2=-b kJ·ml-1比较ΔH1与ΔH2的大小。
能量越低越稳定,则燃烧过程中能量变化如图:
由图示可知: b>a,则ΔH2<ΔH1。
二、利用盖斯定律计算比较反应热大小
比较ΔH1与ΔH2的大小,写出分析过程。
答案 由反应①-反应②可得2Al(s)+Fe2O3(s)===2Fe(s)+Al2O3(s) ΔH=ΔH1-ΔH2,已知铝热反应为放热反应,故ΔH<0,ΔH1<ΔH2。
4.对于反应a:C2H4(g) C2H2(g)+H2(g),反应b:2CH4(g) C2H4(g)+2H2(g),当升高温度时平衡都向右移动。①C(s)+2H2(g)===CH4(g) ΔH1;②2C(s)+H2(g)===C2H2(g) ΔH2;③2C(s)+2H2(g)===C2H4(g) ΔH3。则①②③中ΔH1、ΔH2、ΔH3的大小顺序排列正确的是A.ΔH1>ΔH2>ΔH3B.ΔH2>ΔH3>2ΔH1C.ΔH2>2ΔH1>ΔH3D.ΔH3>ΔH2>ΔH1
对于反应a、b,升高温度平衡都向右移动,故二者均为吸热反应,ΔHa>0、ΔHb>0。根据盖斯定律知a=②-③,ΔHa=ΔH2-ΔH3>0,推知ΔH2>ΔH3;b=③-2×①,故ΔHb=ΔH3-2ΔH1>0,推知ΔH2>ΔH3>2ΔH1。
1.下列依据热化学方程式得出的结论正确的是A.已知Ni(CO)4(s)===Ni(s)+4CO(g) ΔH=Q kJ·ml-1,则Ni(s)+4CO(g)=== Ni(CO)4(s) ΔH=-Q kJ·ml-1B.在一定温度和压强下,将0.5 ml N2和1.5 ml H2置于密闭容器中充分反应生成 NH3(g),放出热量19.3 kJ,则其热化学方程式为 N2(g)+ H2(g) NH3(g) ΔH=-19.3 kJ·ml-1C.已知2H2(g)+O2(g)===2H2O(l) ΔH1,2H2(g)+O2(g)===2H2O(g) ΔH2,则ΔH1> ΔH2D.已知C(s,石墨)===C(s,金刚石) ΔH>0,则金刚石比石墨稳定
合成氨的反应是可逆反应,不能进行完全,B错误;H2O(g)转化为H2O(l)放热,且氢气燃烧的焓变ΔH<0,所以ΔH1<ΔH2,C错误;由C(s,石墨)===C(s,金刚石) ΔH>0可知,1 ml石墨的能量小于1 ml金刚石的能量,则石墨比金刚石稳定,D错误。
2.(2023·太原模拟)分别向1 L 0.5 ml·L-1的Ba(OH)2溶液中加入①浓硫酸;②稀硫酸;③稀硝酸,恰好完全反应时的热效应分别为ΔH1、ΔH2、ΔH3,下列关系正确的是A.ΔH1>ΔH2>ΔH3 B.ΔH1<ΔH2<ΔH3C.ΔH1>ΔH2=ΔH3 D.ΔH1=ΔH2<ΔH3
3.(2023·北京市第一六六中学高三期中)以CO和H2为原料合成甲醇是工业上的成熟方法,直接以CO2为原料生产甲醇是目前的研究热点。我国科学家用CO2人工合成淀粉时,第一步就需要将CO2转化为甲醇。已知:①CO(g)+2H2(g)===CH3OH(g) ΔH1=-90.5 kJ·ml-1②CO(g)+H2O(g)===CO2(g)+H2(g) ΔH2=-41.1 kJ·ml-1③2H2(g)+ O2(g)===2H2O(g) ΔH3=-483.6 kJ·ml-1
下列说法不正确的是A.若温度不变,反应①中生成1 ml CH3OH(l)时,放出的热量大于90.5 kJB.CO2与H2合成甲醇的热化学方程式为CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH= -49.4 kJ·ml-1C.通过电解制H2和选用高效催化剂,可降低CO2与H2合成甲醇反应的焓变D.以CO2和H2O为原料合成甲醇,同时生成O2,该反应需要吸收能量
根据盖斯定律,①-②得CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH=ΔH1-ΔH2=-49.4 kJ·ml-1,故B正确;催化剂可降低CO2与H2合成甲醇反应的活化能,但不改变反应的焓变,故C错误;已知反应④CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH4=-49.4 kJ·ml-1,根据盖斯定律④×2—③×3得2CO2(g)+4H2O(g)===2CH3OH(g)+3O2(g) ΔH=2ΔH4-3ΔH3=+1 352 kJ·ml-1>0,则该反应需要吸收能量,故D正确。
4.根据碘与氢气反应的热化学方程式:(ⅰ)I2(?)+H2(g) 2HI(g) ΔH=-9.48 kJ·ml-1;(ⅱ)I2(?)+H2(g) 2HI(g) ΔH=+26.48 kJ·ml-1。下列判断正确的是A.反应(ⅰ)中的I2为固态,反应(ⅱ)中的I2为气态B.1 ml固态碘与1 ml气态碘所含的能量相差35.96 kJC.反应(ⅰ)的生成物比反应(ⅱ)的生成物稳定D.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ
反应(ⅰ)放出能量,反应(ⅱ)吸收能量,故(ⅰ)中I2的能量高,为气态,(ⅱ)中I2为固态,故A项错误;根据盖斯定律可知,(ⅱ)-(ⅰ)即得到I2(s) I2(g) ΔH=+35.96 kJ·ml-1,说明1 ml固态碘与1 ml气态碘所含的能量相差35.96 kJ,故B项正确;两个反应的生成物为相同状态的同种物质,其稳定性相同,故C项错误;254 g I2(g)和2 g H2(g)的物质的量均为1 ml,因反应(ⅰ)是可逆反应,转化率达不到100%,则反应放热小于9.48 kJ,故D项错误。
5.向Na2CO3溶液中滴加盐酸,反应过程中能量变化如图所示,下列说法正确的是A.反应 (aq)+H+(aq)===CO2(g)+H2O(l) 为放热反应B. (aq)+2H+(aq)===CO2(g)+H2O(l) ΔH=ΔH1+ΔH2+ΔH3C.ΔH1>ΔH2;ΔH2<ΔH3D.H2CO3(aq)===CO2(g)+H2O(l),若使用催化 剂,则ΔH3变小
6.在一定温度压强下,依据图示关系,下列说法不正确的是A.C(s,石墨)+ CO2(g) ===2CO(g) ΔH=ΔH1-ΔH2B.1 ml C(s,石墨)和1 ml C(s,金刚石)分别与足量O2反应全部转化为CO2(g) ,前 者放热多C.ΔH5=ΔH1-ΔH3D.化学反应的ΔH只与反应体系的始态和终态有关,与反应途径无关
由题干信息可知,C(s,石墨)===C(s,金刚石) ΔH5>0,即1 ml C(s,石墨)具有的总能量低于1 ml C(s,金刚石),则1 ml C(s,石墨)和1 ml C(s,金刚石)分别与足量O2反应全部转化为CO2(g),后者放热多,B错误;
7.在25 ℃、101 kPa时,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5 kJ·ml-1、285.8 kJ·ml-1、870.3 kJ·ml-1,则2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为A.-488.3 kJ·ml-1 B.+488.3 kJ·ml-1C.-191 kJ·ml-1 D.+191 kJ·ml-1
由题知表示各物质燃烧热的热化学方程式分别为①C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·ml-1;②H2(g)+ O2(g)===H2O(l) ΔH=-285.8 kJ·ml-1;③CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH=-870.3 kJ·ml-1。则2C(s)+2H2(g)+O2(g)===CH3COOH(l)可由反应①×2+②×2-③得出,则反应热为(-393.5 kJ·ml-1)×2+(-285.8 kJ·ml-1)×2-(-870.3 kJ·ml-1)=-488.3 kJ·ml-1。
8.黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为S(s)+2KNO3(s)+3C(s)===K2S(s)+N2(g)+3CO2(g) ΔH=x kJ·ml-1已知:①碳的燃烧热ΔH1=a kJ·ml-1②S(s)+2K(s)===K2S(s) ΔH2=b kJ·ml-1③2K(s)+N2(g)+3O2(g)===2KNO3(s) ΔH3=c kJ·ml-1,则x为A.3a+b-c B.c-3a-bC.a+b-c D.c-a-b
由碳的燃烧热ΔH1=a kJ·ml-1,得反应①C(s) + O2(g)===CO2(g) ΔH1=a kJ·ml-1,目标反应可由反应①×3+②-③得到,所以ΔH=3ΔH1+ΔH2-ΔH3,即x=3a+b-c。
9.室温下,将1 ml的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1 ml的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4·5H2O(s)受热分解的化学方程式为CuSO4·5H2O(s)===CuSO4(s)+5H2O(l),热效应为ΔH3。下列判断正确的是A.ΔH2>ΔH3 B.ΔH1<ΔH3C.ΔH1+ΔH3=ΔH2 D.ΔH1+ΔH2>ΔH3
根据题干信息,构建多步反应中总反应与分步反应的关系,快速得出反应方程式和反应热之间的关系
ΔH1=ΔH3+ΔH2,ΔH1>0,ΔH3>0,ΔH2<0。
⑤2Al(s)+Fe2O3(s)===Al2O3(s)+2Fe(s) ΔH5下列关于上述反应焓变的判断正确的是A.ΔH1<0,ΔH3>0B.ΔH5<0,ΔH4<ΔH3C.ΔH1=ΔH2+ΔH3D.ΔH3=ΔH4+ΔH5
10.已知:①2H2(g)+O2(g)===2H2O(g) ΔH1②3H2(g)+Fe2O3(s)===2Fe(s)+3H2O(g) ΔH2
大多数化合反应为放热反应,而放热反应的反应热(ΔH)为负值,故A错误;铝热反应为放热反应,故ΔH5<0,而由④-③可得:2Al(s)+Fe2O3(s)===Al2O3(s)+2Fe(s) ΔH5=ΔH4-ΔH3<0,可得ΔH4<ΔH3、ΔH3=ΔH4-ΔH5,故B正确、D错误;
11.镁和氯气反应生成氯化镁的能量关系图如图所示。已知:气态的卤素原子得电子生成气态的卤素离子是放热过程。下列说法正确的是A.ΔH6=ΔH1+ΔH2+ΔH3+ΔH4+ΔH5B.Ca(g)-2e-===Ca2+(g) ΔH7,则ΔH7>ΔH3C.I(g)+e-===I-(g) ΔH8,则ΔH8>ΔH4D.MgCl2(s)===Mg2+(aq)+2Cl-(aq) ΔH9, 则ΔH9>ΔH5
根据盖斯定律可知,ΔH6=ΔH1+ΔH2+ΔH3+ΔH4-ΔH5,故A错误;原子失去电子变为离子是吸热过程,Ca和Mg属于同主族元素,Ca的金属性强于Mg,Ca→Ca2+吸收的热量小于Mg→Mg2+吸收的热量,即ΔH7<ΔH3,故B错误;
气态卤素原子得电子生成气态卤素离子是放热过程,Cl非金属性强于I,即Cl→Cl-放出的热量比I→I-放出的热量多,即ΔH8>ΔH4,故C正确;
MgCl2(s)===Mg2+(g)+2Cl-(g)属于吸热过程,即ΔH5>0,Mg2+(g)、2Cl-(g)转化成Mg2+(aq)、2Cl-(aq)要放出热量,发生MgCl2(s)===Mg2+(aq)+2Cl-(aq)吸收热量比MgCl2(s)===Mg2+(g)+2Cl-(g)少,即ΔH9<ΔH5,故D错误。
12.(2021·浙江6月选考,21)相同温度和压强下,关于反应的ΔH,下列判断正确的是
A.ΔH1>0,ΔH2>0B.ΔH3=ΔH1+ΔH2C.ΔH1>ΔH2,ΔH3>ΔH2D.ΔH2=ΔH3+ΔH4
环己烯、1,3-环己二烯分别与氢气发生的加成反应均为放热反应,因此,ΔH1<0,ΔH2<0,A不正确;苯分子中没有碳碳双键,其中的碳碳键是介于单键和双键之间的特殊的共价键,因此,其与氢气完全加成的反应热不等于环己烯、1,3-环己二烯分别与氢气发生的加成反应的反应热之和,即ΔH3≠ΔH1+ΔH2,B不正确;由于1 ml 1,3-环己二烯与氢气完全加成后消耗的氢气是等量环己烯的2倍,故其放出的热量更多,则ΔH1>ΔH2;苯与氢气发生加成反应生成1,3-环己二烯的反应为吸热反应(ΔH4>0),根据盖斯定律可知,苯与氢气完全加成的反应热:ΔH3=ΔH4+ΔH2,因此ΔH3>ΔH2,ΔH2=ΔH3-ΔH4,C正确、D不正确。
13.(1)[2023·全国甲卷,28(1)节选]已知下列反应的热化学方程式:①3O2(g)===2O3(g) ΔH1=+285 kJ·ml-1②2CH4(g)+O2(g)===2CH3OH(l) ΔH2=-329 kJ·ml-1反应③CH4(g)+O3(g)===CH3OH(l)+O2(g)的ΔH3=________kJ·ml-1。
(2)[2023·浙江6月选考,19(1)]水煤气变换反应是工业上的重要反应,可用于制氢。水煤气变换反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-41.2 kJ·ml-1该反应分两步完成:3Fe2O3(s)+CO(g) 2Fe3O4(s)+CO2(g) ΔH1=-47.2 kJ·ml-12Fe3O4(s)+H2O(g) 3Fe2O3(s)+H2(g) ΔH2则ΔH2=_______kJ·ml-1。
14.(1)[2022·广东,19(1)②]Cr2O3催化丙烷脱氢过程中,部分反应历程如图,X(g)→Y(g)过程的焓变为_____________________(列式表示)。
E1-E2+ΔH+E3-E4
设反应过程中第一步的产物为M,第二步的产物为N,则X→M的ΔH1=E1-E2,M→N的ΔH2=ΔH,N→Y的ΔH3=E3-E4,根据盖斯定律可知,X(g)→Y(g)的焓变为ΔH1+ΔH2+ΔH3=E1-E2+ΔH+E3-E4。
(2)[2022·湖北,19(1)]已知:①CaO(s)+H2O(l) Ca(OH)2(s) ΔH1=-65.17 kJ·ml-1②Ca(OH)2(s) Ca2+(aq)+2OH-(aq) ΔH2=-16.73 kJ·ml-1③Al(s)+OH-(aq)+3H2O(l) [Al(OH)4]-(aq)+ H2(g) ΔH3=-415.0 kJ·ml-1则CaO(s)+2Al(s)+7H2O(l)===Ca2+(aq)+2[Al(OH)4]-(aq)+3H2(g)的ΔH4=__________kJ·ml-1。
根据盖斯定律,①+②+2×③可得反应CaO(s)+2Al(s)+7H2O(l)===Ca2+(aq)+2[Al(OH)4]-(aq)+3H2(g),则ΔH4=ΔH1+ΔH2+2ΔH3=(-65.17 kJ·ml-1)+(-16.73 kJ·ml-1)+2×(-415.0 kJ·ml-1)=-911.9 kJ·ml-1。
15.(1)[2022·福建,13(1)]异丙醇(C3H8O)可由生物质转化得到,催化异丙醇脱水制取高值化学品丙烯(C3H6)的工业化技术已引起人们的关注。其主要反应如下:Ⅰ.C3H8O(g) C3H6(g)+H2O(g) ΔH1=+52 kJ·ml-1Ⅱ.2C3H6(g) C6H12(g) ΔH2=-97 kJ·ml-1已知2C3H8O(g)+9O2(g)===6CO2(g)+8H2O(g) ΔH=-3 750 kJ·ml-1,则C3H6(g)燃烧生成CO2(g)和H2O(g)的热化学方程式为____________________________________________________________。
2C3H6(g)+9O2(g)===6CO2(g)+6H2O(g)
ΔH=-3 854 kJ·ml-1
设Ⅲ.2C3H8O(g)+9O2(g)===6CO2(g)+8H2O(g) ΔH=-3 750 kJ·ml-1,根据盖斯定律Ⅲ-2×Ⅰ得2C3H6(g)+9O2(g)===6CO2(g)+6H2O(g) ΔH=-3 854 kJ·ml-1。
第五单元 第二讲 盖斯定律及其应用-2025年高考化学一轮复习方案课件: 这是一份第五单元 第二讲 盖斯定律及其应用-2025年高考化学一轮复习方案课件,文件包含第2讲pptx、第2讲doc等2份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
大单元四 第十章 第39讲 盖斯定律及应用-备战2025年高考化学大一轮复习课件(人教版): 这是一份大单元四 第十章 第39讲 盖斯定律及应用-备战2025年高考化学大一轮复习课件(人教版),文件包含大单元四第十章第39讲盖斯定律及应用pptx、大单元四第十章第39讲盖斯定律及应用教师版docx、大单元四第十章第39讲盖斯定律及应用学生版docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
2024年高考化学一轮总复习 第5单元 第2讲 盖斯定律及其应用 课件: 这是一份2024年高考化学一轮总复习 第5单元 第2讲 盖斯定律及其应用 课件,共60页。PPT课件主要包含了ΔH2+ΔH3,aΔH2,-ΔH2,ΔH1+ΔH2,ΔH1>ΔH2,高考真题演练,-223,2×1014,-9119,-49等内容,欢迎下载使用。












