



2024届高考化学一轮复习课件 第六章 化学反应与能量 第1讲 化学反应的热效应
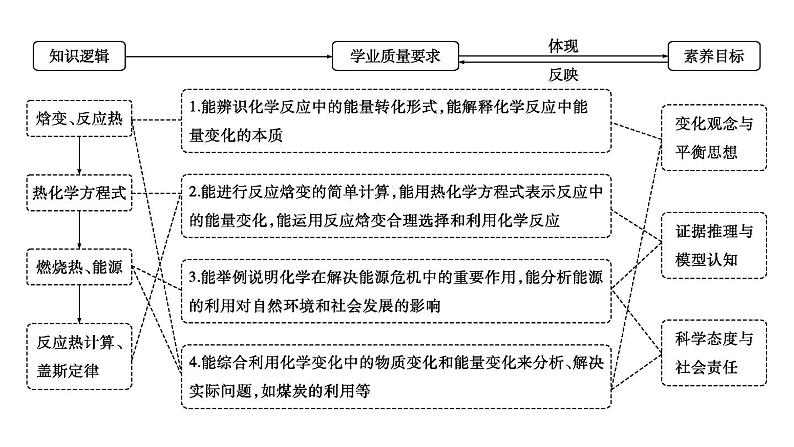
展开第六章 化学反应与能量第1讲 化学反应的热效应
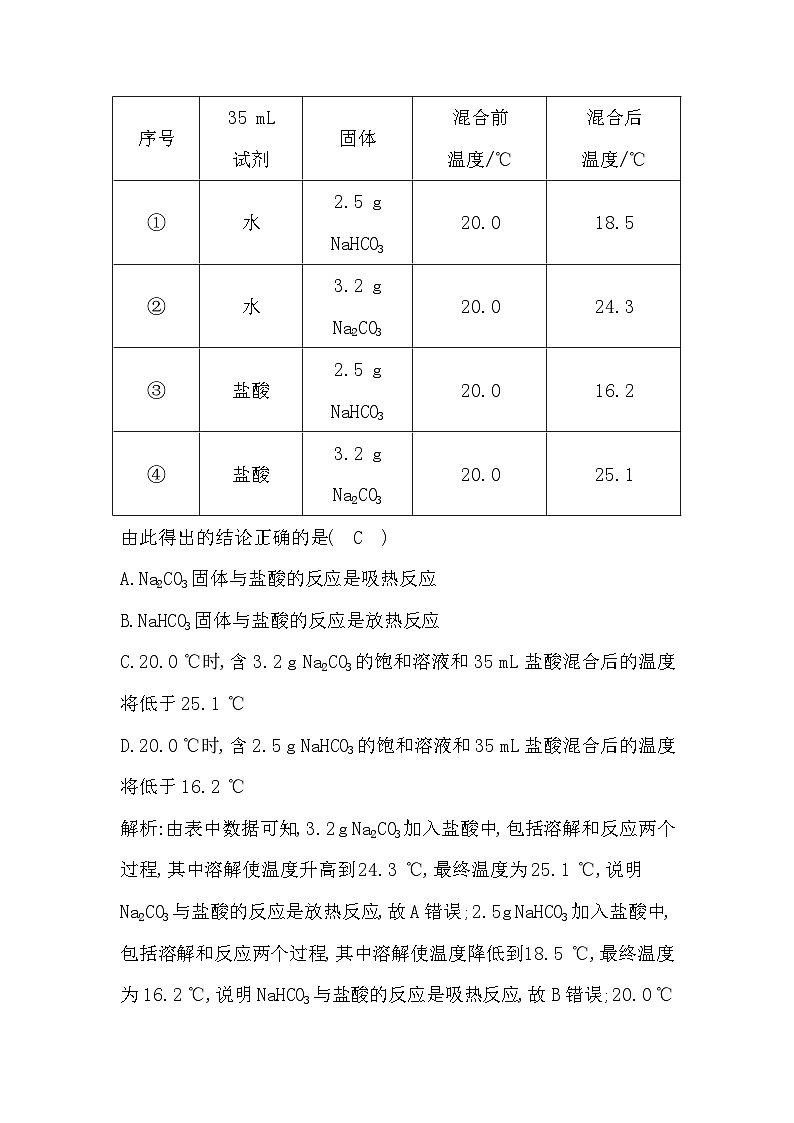
必备知识·整合
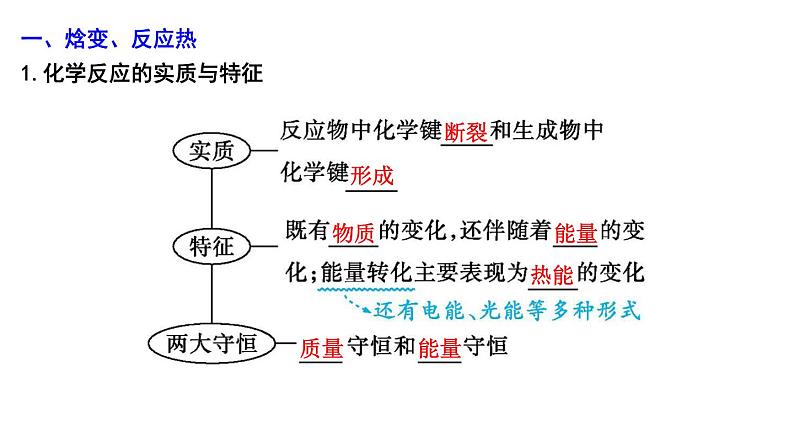
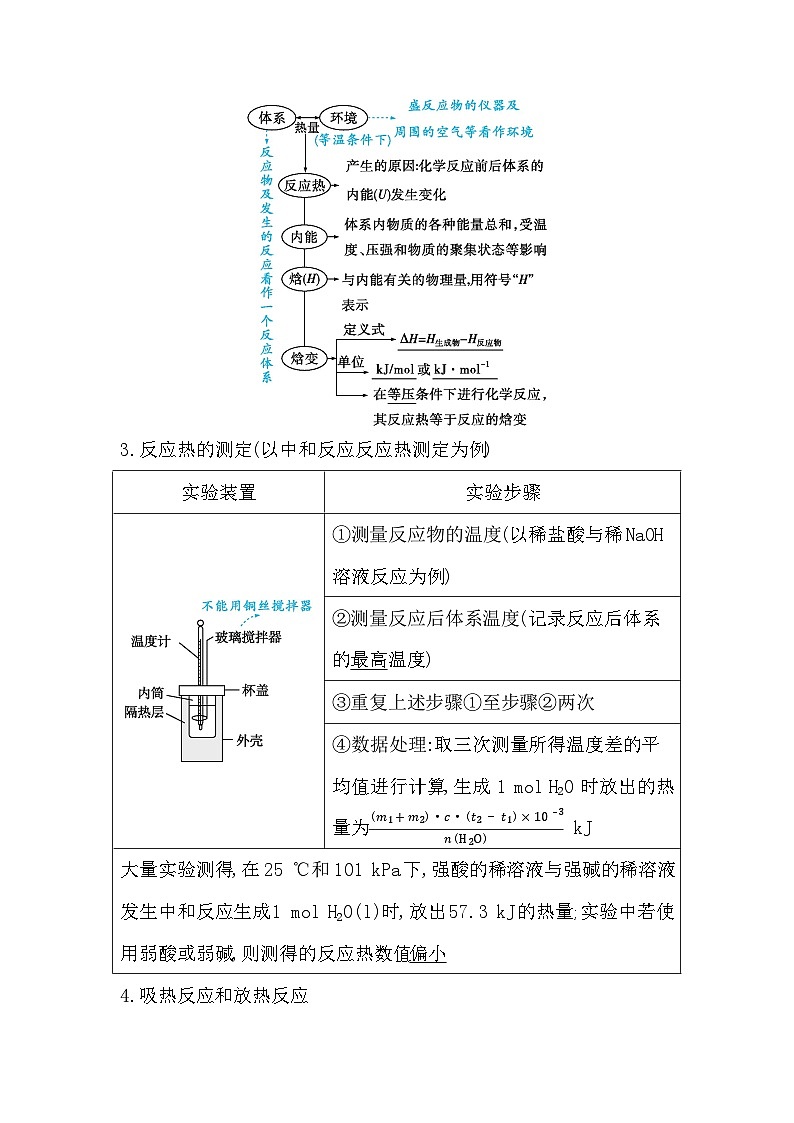
一、焓变、反应热1.化学反应的实质与特征
断裂
形成
物质
能量
热能
质量
能量
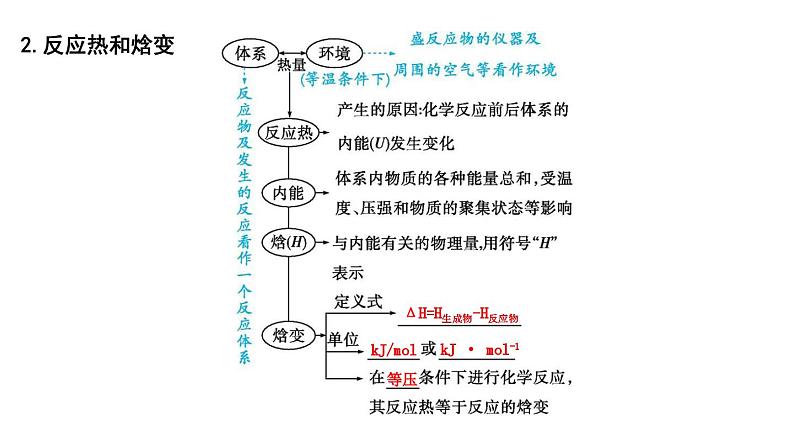
2.反应热和焓变
ΔH=H生成物-H反应物
kJ/mol
kJ · mol-1
等压
3.反应热的测定(以中和反应反应热测定为例)
最高
偏小
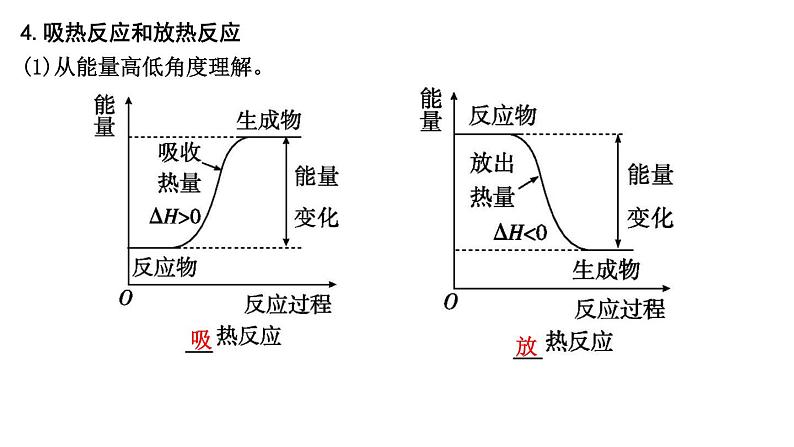
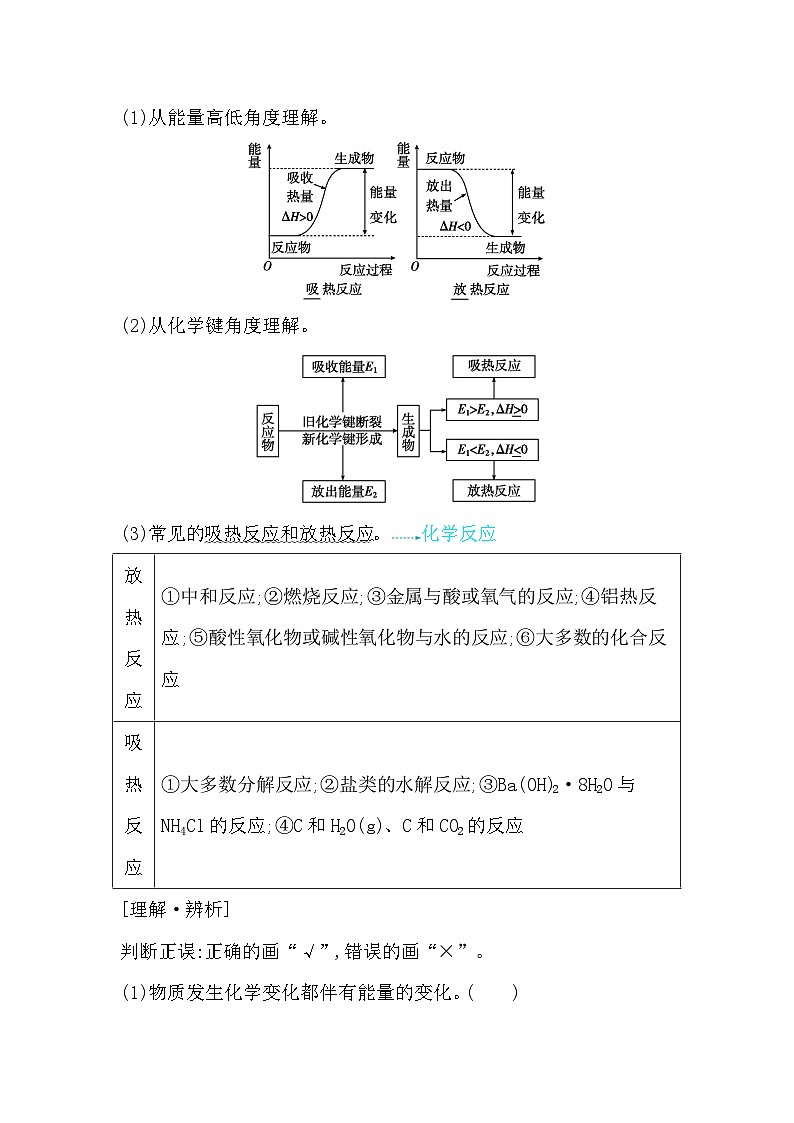
4.吸热反应和放热反应(1)从能量高低角度理解。
吸
放
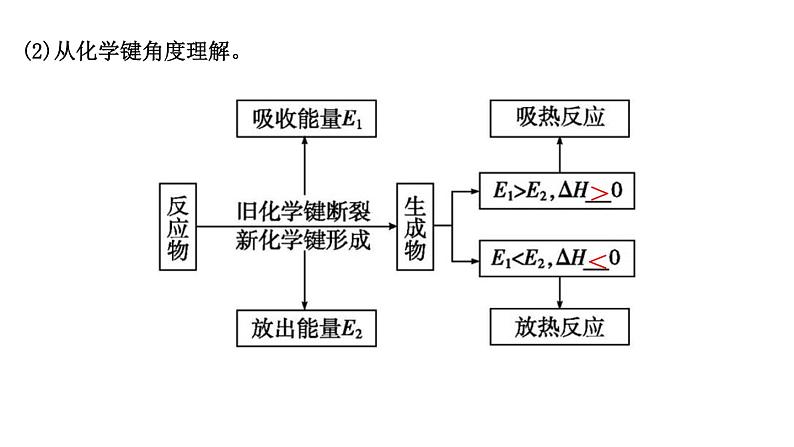
(2)从化学键角度理解。
>
<
[理解·辨析] 判断正误:正确的画“√”,错误的画“×”。(1)物质发生化学变化都伴有能量的变化。( )解析:(1)化学反应的本质是旧化学键断裂和新化学键形成,任何化学反应都具有热效应。(2)需加热的反应一定为吸热反应,不需加热的反应一定为放热反应。( )解析:(2)不能根据反应条件判断反应是放热还是吸热。
√
(4)在中和反应反应热测定时,加酸、碱液时动作缓慢,测定的反应热ΔH可能偏小。( )(5)吸热反应中,反应物化学键断裂吸收的总能量高于生成物形成化学键放出的总能量。( )
解析:(3)ΔH与反应条件无关。
×
×
×
√
2 mol 氢气和 1 mol 氧气反应生成2 mol
二、热化学方程式1.概念表示反应所释放或吸收的热量的化学方程式。
液态水时放出571.6 kJ的热量
3.热化学方程式的书写步骤及要求
[理解·辨析] 判断正误:正确的画“√”,错误的画“×”。
×
解析:(1)可逆反应的ΔH表示完全反应的热量变化,与反应是否可逆无关。但加入1 mol N2和3 mol H2时,不能完全反应。
解析:(2)热化学方程式如不注明温度和压强,即表示在25 ℃和101 kPa下测定。
×
解析:(3)ΔH1与ΔH2数值相等,符号相反。
×
√
三、燃烧热、能源1.燃烧热
101 kPa
1 mol
2.能源(1)分类。
(2)科学开发利用能源的措施。
[理解·辨析] 判断正误:正确的画“√”,错误的画“×”。(1)化石燃料和植物燃料燃烧时放出的能量均来源于太阳能。( )
√
解析:(2)燃烧热是1 mol 纯物质完全燃烧生成指定产物时所放出的热量,H2燃烧的稳定产物为H2O(l)。
解析:(3)葡萄糖的燃烧热指1 mol 葡萄糖完全燃烧生成指定产物时所放出的热量。
×
√
四、盖斯定律、反应热的计算1.盖斯定律(1)盖斯定律内容:一个化学反应,不管是一步完成的还是分几步完成的,其反应热是 的。即:在一定条件下,化学反应的反应热只与反应体系的 有关,而与反应的 无关。
相同
始态和终态
途径
ΔH1+ΔH2
ΔH3+ΔH4+ΔH5
(3)盖斯定律的应用。①计算某些反应的反应热。②判断反应热之间的关系。
2.反应热的计算(1)根据化学反应过程中的能量变化图来计算。
正反应的活化能
逆反应的活化能
反应热
总生成物
总反应物
放热
吸热
(2)利用化学键进行计算:ΔH= 的键能总和- 的键能总和。(3)利用盖斯定律进行计算。(4)利用热化学方程式进行计算。(5)利用燃烧热、中和反应反应热进行计算。计算公式:Q=燃烧热×n(可燃物的物质的量)。
反应物
3.反应热大小的比较(1)看物质的聚集状态。物质的气、液、固三态转化时的能量变化如下:
生成物
(2)看ΔH的符号。比较反应热大小时不能只比较ΔH数值的大小,还要考虑其符号。(3)看化学计量数。当反应物、生成物的聚集状态相同时,化学计量数越大,放热反应的ΔH越小,吸热反应的ΔH越大。(4)看反应的程度。对于可逆反应,参加反应的物质的量和聚集状态相同时,反应进行的程度越大,热量变化越大。
[理解·辨析] 我国自主研制的新一代中型运载火箭长征八号,采用无毒、无污染的液氢、液氧为推进剂,真正实现了无毒、无污染、零排放,是一支环保“绿箭”。
问题3:假设火箭一次装载1 t液氢燃料,燃烧生成液态水,最多可放热多少?
关键能力·提升
考点一 反应热与热化学方程式
反应热与物质的能量变化关系图分析
(2022·广东卷,节选)铬及其化合物在催化、金属防腐等方面具有重要应用。Cr2O3催化丙烷脱氢过程中,部分反应历程如图,X(g)→Y(g)过程的焓变为 (列式表示)。
(E1-E2)+ΔH+(E3-E4)
1.根据盖斯定律,在一定条件下,化学反应的反应热只与反应体系的始态(X)和终态(Y)有关,而与反应的途径无关。2.ΔH=Ea正-Ea逆。
(1)写出丙烷催化脱氢制丙烯的化学方程式。
(2)若改用铂系催化剂,丙烷催化脱氢过程的焓变是否改变?提示:不改变。
(3)若该过程反应历程如图所示,反应历程中最大能垒(活化能)是多少?该过程的焓变是多少?
提示:最大能垒为(E4-E3);焓变为E5。
D
1.(2022·湖北华中师大附中模拟)乙炔(HC≡CH)能在Hg(Ⅱ)催化下与水反应生成CH3CHO,反应历程如图所示。下列说法正确的是( )
2.(2022·福建福州二模)苯与Br2的催化反应历程如图所示。关于该反应历程,下列说法正确的是( )A.苯与Br2的催化反应为放热反应B.该反应历程,苯与Br2的催化反应可生成溴苯、邻二溴苯C.苯与Br2的催化反应决速步骤伴随着极性键的断裂与形成D.从反应速率角度,苯与Br2的催化反应主反应为取代反应,原因是该反应活化能更低
D
[思维建模] 三步突破能量变化能垒图
根据键能计算焓变
(2021·湖南卷,节选)氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过下面方法由氨气得到氢气。方法Ⅰ:氨热分解法制氢气相关化学键的键能数据
+90.8
从化学反应的本质理解化学反应的反应热产生的原因并加以计算。一是结合物质结构明确“总”键能,二是明确“前”减“后”,即ΔH=反应物总键能(旧键断裂吸收的能量)-生成物总键能(新键生成释放的能量)。
合成氨过程中,每生成1 mol NH3 (填“吸收”或“放出”)热量 kJ。
答案:放出 45.4
1.(2022·山东省实验中学一诊)中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程如图所示。
已知:几种物质中化学键的键能如表所示。
D
解析:过程Ⅲ为1 mol 过氧化氢生成1 mol 氧气和1 mol 氢气,吸收的能量大于放出的能量,该过程为吸热反应,故D错误。
C
热化学方程式的书写
依据事实书写热化学方程式。(1)已知1 mol 单质Na在足量O2中燃烧,恢复至室温,放出255.5 kJ的热量,写出该反应的热化学方程式: 。 (2)已知2.0 g燃料肼(N2H4)气体完全燃烧生成N2和水蒸气时,放出33.4 kJ的热量,则表示肼燃烧的热化学方程式为 . 。 (3)在25 ℃、101 kPa下,将1 mol N2和3 mol H2充入一密闭容器中发生反应生成氨气,达到平衡时N2的转化率为25%,放出Q kJ的热量,写出N2与H2反应的热化学方程式: 。
ΔH=-534.4 kJ·mol-1
考点二 燃烧热、中和反应反应热、能源
燃烧热、中和反应反应热的含义
A
2.(2022·陕西西安长安一中月考)在测定中和反应反应热的实验中,下列说法正确的是( )A.使用环形玻璃搅拌棒是为了使酸碱充分反应,减小实验误差B.为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触C.用0.5 mol ·L-1NaOH溶液分别与0.5 mol ·L-1的盐酸、醋酸溶液反应,如所取的溶液体积相等,则测得的中和热数值相同D.测定中和反应反应热实验中需要使用的仪器有天平、量筒、烧杯、滴定管、温度计、环形玻璃搅拌棒
中和反应反应热的测定
A
解析:使用环形玻璃搅拌棒是为了使酸碱充分反应,能加快反应速率,减小实验误差,故A正确;温度计测烧杯内液体的温度,水银球不能接触烧杯底部,故B错误;用0.5 mol ·L-1NaOH溶液分别与 0.5 mol ·L-1的盐酸、醋酸溶液反应,如所取的溶液体积相等,醋酸是弱酸,电离吸热,测出的中和热数值偏小,故C错误;中和热测定用不到天平,故D错误。
3.利用如图所示装置测定中和反应反应热的实验步骤如下:
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液的最高温度。回答下列问题。(1)为什么所用NaOH溶液要稍过量? 。
解析:(1)在中和反应反应热的测定实验中,为了确保反应物被完全中和,常常使加入的一种反应物稍微过量一些。
答案:(1)确保盐酸被完全中和
3.利用如图所示装置测定中和反应反应热的实验步骤如下:
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液的最高温度。回答下列问题。(2)倒入NaOH溶液的正确操作是 (填字母,下同)。 A.沿玻璃棒缓慢倒入B.分三次倒入C.一次迅速倒入
解析:(2)为了减少热量损失,倒入NaOH溶液应该一次迅速倒入。
答案:(2)C
3.利用如图所示装置测定中和反应反应热的实验步骤如下:
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液的最高温度。回答下列问题。(3)使盐酸与NaOH溶液混合均匀的正确操作是 。 A.用温度计小心搅拌B.揭开硬纸片用玻璃棒搅拌C.轻轻地振荡烧杯D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
解析:(3)使盐酸与NaOH溶液混合均匀的正确操作是用套在温度计上的环形玻璃搅拌棒轻轻地搅动。
答案:(3)D
3.利用如图所示装置测定中和反应反应热的实验步骤如下:
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液的最高温度。回答下列问题。(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为 。
解析:(4)稀氢氧化钠溶液和稀氢氧化钙溶液中溶质都完全电离,它们的中和反应反应热相同,稀氨水中的溶质是弱电解质,它与盐酸的反应中一水合氨的电离要吸收热量,故反应热的数值要小一些(注意中和反应反应热与ΔH的关系)。
答案:(4)ΔH1=ΔH2<ΔH3
3.利用如图所示装置测定中和反应反应热的实验步骤如下:
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液的最高温度。(5)假设盐酸和氢氧化钠溶液的密度都是 1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算反应热,某学生实验记录数据如下:
解析:(5)取三次实验的平均值代入公式计算即可。
答案:(5)-51.8 kJ·mol-1
3.利用如图所示装置测定中和反应反应热的实验步骤如下:
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液的最高温度。回答下列问题。(6) (填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是 。
解析:(6)硫酸与Ba(OH)2溶液反应生成BaSO4沉淀的生成热会影响中和反应的反应热,故不能用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸。
答案:(6)不能 H2SO4与Ba(OH)2反应生成BaSO4沉淀,沉淀的生成热会影响中和反应的反应热
能源
4.未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列符合未来新能源标准的是( )①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能A.①②③④ B.⑤⑥⑦⑧C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
B
解析:天然气、煤、石油都是化石能源,不可再生,因此不属于未来新能源,①②④不符合;核能使用不当会造成环境污染,且不可再生,故核能不属于未来新能源,③不符合;太阳能、生物质能、风能资源丰富,在使用时对环境无污染或污染很小,属于未来新能源,⑤⑥⑦符合;氢能可以再生,燃烧产物是水,生产氢气的原料为水,属于未来新能源,⑧符合。因此符合未来新能源标准的是⑤⑥⑦⑧,B项正确。
解析:古代曾使用木炭、铁矿石熔炼铸铁,木炭燃烧放热,木炭不完全燃烧产生的CO把铁矿石还原为铁单质,故A错误;在古代蜡烛的主要成分是动物油脂,油脂不属于高分子化合物,故B错误;植物油的组成元素是C、H、O,煤油的组成元素是C、H,两者组成元素不相同,煤油主要来自石油的分馏,故C错误;天然气的主要成分是甲烷,可作为化工原料用于合成氨和生产甲醇等,故D正确。
5.(2023·山东滨州模拟)能源的开发与利用促进了人类发展和社会进步,下列有关能源及其利用说法正确的是( )A.古代曾使用木炭、铁矿石熔炼铸铁,其中木炭的作用只是燃烧供热B.《世说新语》记载“……用蜡烛作炊”,其中蜡烛的主要成分是油脂,属于天然高分子化合物C.植物油、煤油等都曾用于提供照明,两者组成元素相同,其中煤油主要来自煤的干馏D.天然气不仅是一种清洁的化石燃料,还可作为化工原料用于合成氨和生产甲醇等
D
考点三 盖斯定律及应用
1.(2022·重庆育才中学模拟)“世上无难事,九天可揽月”,我国的航空航天事业取得了举世瞩目的成就。碳酰肼类化合物[Mn(L)3](ClO4)2是种优良的含能材料,可作为火箭推进剂的组分,其相关反应的能量变化如图所示,已知ΔH2=-299 kJ/ mol ,则ΔH1(kJ/ mol )为( )A.-1 703 B.-1 389 C.-1 334 D.-1 160
解析:由盖斯定律可知,ΔH1=2ΔH2+ΔH3-ΔH4=2×(-299 kJ/mol )+(-1 018 kJ/mol )-(+87 kJ/mol )=-1 703 kJ/mol ,故选A。
A
2.(2022·安徽合肥第八中学模拟,节选)甲醇是重要的化工原料,可以使用多种方法制备甲醇。利用CO和H2合成甲醇,已知在一定温度和压强下,发生如下反应:
解析:由盖斯定律可知,反应Ⅰ+反应Ⅱ可得二氧化碳和氢气合成甲醇的热化学方程式。
[思维建模] 盖斯定律求算反应热的思路
微专题12 多路径书写热化学方程式
热化学方程式的书写路径1.根据反应事实描述书写2.根据燃烧热书写3.根据能量变化图像书写4.根据反应机理或反应历程图书写5.利用盖斯定律书写
(2021·河北卷,节选)当今,世界多国相继规划了碳达峰、碳中和的时间节点,因此,研发二氧化碳利用技术、降低空气中二氧化碳含量成为研究热点。大气中的二氧化碳主要来自煤、石油及其他含碳化合物的燃烧。已知25 ℃时,相关物质的燃烧热数据如下表:
则25 ℃时H2(g)和C(石墨,s)生成C6H6(l)的热化学方程式为 。
标准摩尔生成焓是指在25 ℃和101 kPa时,最稳定的单质生成1 mol 化合物的焓变。H2O的标准摩尔生成焓是 ;写出表示C6H6的标准摩尔生成焓的热化学方程式: 。
-285.8 kJ·mol-1
1.(根据反应事实描述书写)依据事实,写出下列硅及其化合物有关反应的热化学方程式。(1)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下2 g SiH4自燃放出热量89.2 kJ。SiH4自燃的热化学方程式为 。 (2)Si与Cl两元素的单质反应生成1 mol Si的最高价化合物,恢复至室温,放热687 kJ,已知该化合物的熔点、沸点分别为-69 ℃和58 ℃。写出该反应的热化学方程式: 。 (3)用H2还原SiCl4蒸气可制取纯度很高的硅,当反应中有1 mol 电子转移时吸收59 kJ热量,则该反应的热化学方程式为 . 。
ΔH=+236 kJ·mol-1
答案:-1 306.1 kJ·mol-1
3.甲醇燃料可替代汽油、柴油,用于各种机动车、锅灶炉使用。(1)(根据反应机理或反应历程图书写)利用一氧化碳与氢气的反应生成甲醇的历程如图,其中吸附在催化剂表面上的物种用*标注。
①该反应历程中控速步骤的能垒为 eV。
解析:(1)①能垒最大的步骤为控速步骤,由图可知最大能垒为0.8 eV;
答案:(1)①0.8
3.甲醇燃料可替代汽油、柴油,用于各种机动车、锅灶炉使用。(1)(根据反应机理或反应历程图书写)利用一氧化碳与氢气的反应生成甲醇的历程如图,其中吸附在催化剂表面上的物种用*标注。
②写出虚线框内发生反应的化学方程式: 。
3.甲醇燃料可替代汽油、柴油,用于各种机动车、锅灶炉使用。(2)(根据能量变化图像书写)在一定条件下,由CO2和H2合成甲醇已成为现实,该合成对解决能源问题具有重大意义。该过程中有两个竞争反应,反应过程能量关系如图。
请写出CO(g)与H2(g)生成CH3OH(g)的热化学方程式: 。
4.硫酸是一种重要的基本化工产品。
4.硫酸是一种重要的基本化工产品。
高考真题·导向
AD
1.(不定项)(2022·湖南卷)反应物(S)转化为产物(P或P·Z)的能量与反应进程的关系如下图所示:下列有关四种不同反应进程的说法正确的是( )A.进程Ⅰ是放热反应B.平衡时P的产率:Ⅱ>ⅠC.生成P的速率:Ⅲ>ⅡD.进程 Ⅳ中,Z没有催化作用
解析:由题图信息可知,进程Ⅰ中S的能量大于产物P的能量,因此进程Ⅰ是放热反应,A说法正确;进程Ⅱ中使用了催化剂X,但是催化剂不能改变平衡产率,因此在两个进程中平衡时P的产率相同,B说法不正确;进程Ⅲ中由S·Y转化为P·Y的活化能高于进程Ⅱ中由S·X转化为P·X的活化能,由于这两步反应分别是两个进程的决速步骤,因此生成P的速率为Ⅲ<Ⅱ,C说法不正确;进程Ⅳ中S吸附到Z表面生成S·Z,然后S·Z转化为产物P·Z,由于P·Z没有转化为P+Z,因此,Z没有催化作用,D说法正确。
解析:根据盖斯定律,由①+②+2×③可得目标反应,则ΔH4=ΔH1+ΔH2+2ΔH3=(-65.17 kJ·mol-1)+(-16.73 kJ·mol-1)+2×(-415.0 kJ·mol-1)=-911.9 kJ·mol-1。
答案:-911.9
3.(2022·河北卷,节选)氢能是极具发展潜力的清洁能源,以氢燃料为代表的燃料电池有良好的应用前景。298 K时,1 g H2燃烧生成H2O(g)放热121 kJ,1 mol H2O(l)蒸发吸热44 kJ,表示H2燃烧热的热化学方程式为 。
答案:(1)170(或+170)
答案:(2)副产物氢气可作燃料 耗能高
4.(2022·全国乙卷,节选)油气开采、石油化工、煤化工等行业废气普遍含有的硫化氢,需要回收处理并加以利用。回答下列问题:(2)较普遍采用的H2S处理方法是克劳斯工艺。即利用反应①和②生成单质硫。另一种方法是,利用反应④高温热分解H2S。相比克劳斯工艺,高温热分解方法的优点是 ,缺点是 。
点击进入 课后作业·集训
2024届高考一轮复习 第六章 化学反应与能量 第1讲 化学反应的热效应课件PPT: 这是一份2024届高考一轮复习 第六章 化学反应与能量 第1讲 化学反应的热效应课件PPT,共60页。PPT课件主要包含了kPa,mol,molCs,CO2g,能源1分类等内容,欢迎下载使用。
2024届高考化学一轮总复习第六章化学反应与能量第一节化学反应的热效应课件: 这是一份2024届高考化学一轮总复习第六章化学反应与能量第一节化学反应的热效应课件,共60页。PPT课件主要包含了物质的物质的量,kJmol,同等倍数,保护环境,热值大小,天然气,不可再生,可再生,始态和终态,反应的途径等内容,欢迎下载使用。
2024版新教材高考化学全程一轮总复习第六章化学反应与能量第18讲化学反应的热效应(课件+课时作业+学生用书)(3份): 这是一份2024版新教材高考化学全程一轮总复习第六章化学反应与能量第18讲化学反应的热效应(课件+课时作业+学生用书)(3份),文件包含2024版新教材高考化学全程一轮总复习第六章化学反应与能量第18讲化学反应的热效应课件pptx、2024版新教材高考化学全程一轮总复习第六章化学反应与能量第18讲化学反应的热效应学生用书doc、2024版新教材高考化学全程一轮总复习课时作业18化学反应的热效应doc等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。












