






2025届高考化学一轮总复习第7章化学反应与能量第35讲新型化学电源课件
展开1.了解常考新型化学电源的类型,会分析新型化学电源的工作原理。2.能根据原电池原理正确书写新型化学电源的电极反应式。
考点一 锂电池与锂离子电池 1.锂电池锂电池是一类由金属锂或锂合金负极材料和非水电解质溶液组成的电池。锂电池的负极材料是金属锂或锂合金,工作时金属锂失去电子被氧化为Li+,负极反应均为Li-e-===Li+,负极生成的Li+经过电解质溶液定向移动到正极。
2.锂离子二次电池(1)锂离子电池基于电化学“嵌入/脱嵌”反应原理,替代了传统的“氧化—还原”理念;充放电时,Li+可以从电极材料提供的“空间”中“嵌入”或“脱嵌”。(2)锂离子电池充电时阴极反应一般为6C+xLi++xe-===LixC6;放电时负极反应是充电时阴极反应的逆过程:LixC6-xe-===6C+xLi+。(3)锂离子电池的正极材料一般为含Li+的化合物,目前已商业化的正极材料有LiFePO4、LiCO2、LiMn2O4等。
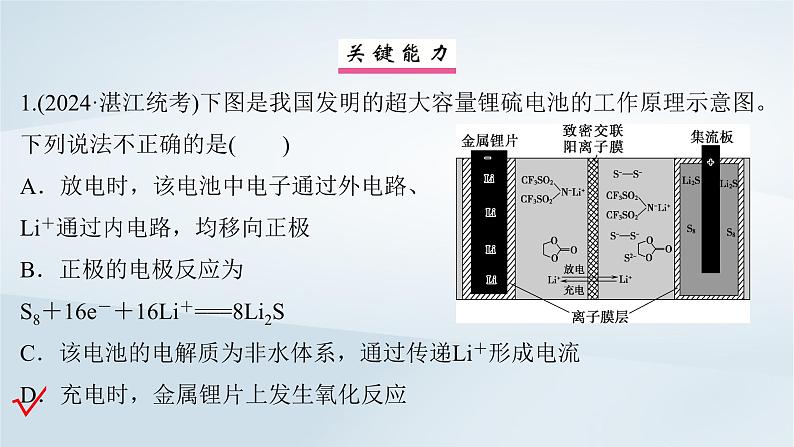
1.(2024·湛江统考)下图是我国发明的超大容量锂硫电池的工作原理示意图。下列说法不正确的是( ) A.放电时,该电池中电子通过外电路、Li+通过内电路,均移向正极B.正极的电极反应为S8+16e-+16Li+===8Li2SC.该电池的电解质为非水体系,通过传递Li+形成电流D.充电时,金属锂片上发生氧化反应
解析:放电时,金属锂片为负极,Li元素化合价升高、失电子、发生氧化反应;充电时,金属锂片连接电源的负极,为阴极,Li+得电子、发生还原反应。放电时,该电池中电子通过外电路,Li+通过内电路,均移向正极,A正确;正极上S8得到电子,转化为Li2S,电极反应为S8+16e-+16Li+===8Li2S,B正确;锂能与水反应,电池中电解质溶液不能为水溶液,该电池的电解质为非水体系,通过传递Li+形成电流,C正确;充电时,金属锂片为阴极,发生还原反应,D错误。
A.LiPON薄膜在充放电过程中质量发生变化B.导电介质c可为Li2SO4溶液C.放电时b极为正极,电极反应为Li1-xCO2+xLi++xe-===LiCO2D.充电时,当外电路通过0.2 ml电子时,非晶硅薄膜上质量减少1.4 g
B项,由于2Li+2H2O===2LiOH+H2↑,故导电介质c中不能有水,不能为Li2SO4溶液,B错误;C项,放电时b极为正极,电极反应为Li1-xCO2+xLi++xe-===LiCO2,C正确;D项,充电时,a极为阴极,电极反应为xLi++xe-+Si===LixSi,当外电路通过0.2 ml电子时,非晶硅薄膜上质量增加0.2 ml×7 g·ml-1=1.4 g,D错误。
考点二 微生物燃料电池 微生物燃料电池是一种利用微生物将有机化合物中的化学能直接转化成电能的装置。其基本工作原理是在负极室厌氧环境下,有机化合物在微生物作用下分解并释放出电子和质子,电子依靠合适的电子传递介体在生物组分和负极之间进行有效传递,并通过外电路传递到正极形成电流,而质子通过质子交换膜传递到正极,氧化剂(一般为氧气)在正极得到电子被还原与质子结合成水。
1.(2024·汕头金禧中学高三月考)微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如下图所示。下列有关微生物电池的说法错误的是( )A.正极反应中有CO2生成B.微生物促进了反应中电子的转移C.质子通过质子交换膜从负极区移向正极区D.电池总反应为C6H12O6+6O2===6CO2+6H2O
解析:A.由题图可知,负极上C6H12O6失电子和H2O反应生成CO2和H+,电极反应式为C6H12O6+6H2O-24e-===6CO2↑+24H+,正极上O2得电子和H+反应生成水,电极反应式为O2+4e-+4H+===2H2O,故CO2在负极产生,故A错误;B.葡萄糖在微生物的作用下分解,此过程中化学能转化为电能,形成原电池,有电流产生,故微生物促进了反应中电子的转移,故B正确;C.由A项分析可知,负极区产生了H+,根据原电池中阳离子向正极移动可知,质子(H+)通过质子交换膜从负极区移向正极区,故C正确;D.电池总反应式为C6H12O6+6O2===6CO2+6H2O,故D正确。
解析:A.由题图可知,处理废水过程中,附着微生物的石墨电极上反应物为CH4,生成物为CO2,C元素化合价从-4 价升高为+4价,失去电子,为负极,A项正确;B.微生物在高温下会死亡,所以处理废水时,不宜在高温下进行,B项正确; D.在附着微生物的石墨电极上CH4被氧化为CO2气体,电极反应式为CH4-8e-+2H2O===CO2+8H+,溶液pH减小,D项错误。
考点三 液流循环电池 液流循环电池是正、负极电解质溶液分开、各自循环的一种高性能蓄电池,具有容量高、使用领域(环境)广、循环使用寿命长的特点。它通过正、负极电解质溶液活性物质发生可逆氧化还原反应(即价态的可逆变化)实现电能和化学能的相互转化。充电时,阳极(正极)发生氧化反应使活性物质价态升高,阴极(负极)发生还原反应使活性物质价态降低,放电过程与之相反。与一般固态电池不同的是,液流电池的正极和(或)负极电解质溶液储存于电池外部的储罐中,通过泵和管路输送到电池内部进行反应。
根据题图可知,电池工作时,膜a、膜b之间生成NaOH,膜a为阳离子交换膜,膜b为阴离子交换膜,故B错误;连接电源时,阳极反应式为4OH--4e-===O2↑+2H2O,电路中通过2 ml电子,消耗2 ml NaOH,所以消耗NaOH的质量为80 g,故D错误。
2.(2024·佛山顺德区高三质检)2023年我国首个兆瓦级铁铬液流电池储能项目在内蒙古成功运行。电池利用溶解在盐酸中的铁、铬离子价态差异进行充放电,工作原理如下图所示。下列有关叙述不正确的是( )A.阴极在充电过程中可能会产生H2B.接输电网时,a极的电极电势高于b极的C.充电时,阳极的电极反应为Fe2+-e-===Fe3+D.放电时,每1 ml Cl-移向b极,c(Fe3+)减少1 ml/L
解析:由题图可知,充电时,左侧亚铁离子失去电子发生氧化反应生成铁离子,a为阳极;右侧三价铬离子得到电子发生还原反应生成二价铬离子,b为阴极;放电时该装置为原电池。A.阴极在充电过程中,氢离子可能得到电子发生还原反应生成H2,A正确;B.由分析可知,a为阳极,接输电网的正极,a极的电极电势高于b极的,B正确;C.由分析可知,充电时,阳极上Fe2+失电子生成Fe3+,电极反应为Fe2+-e-===Fe3+,C正确;D.放电时,该装置为原电池,阴离子向负极(b极)移动,故每1 ml Cl-移向b极,就有1 ml铁离子参与反应,但溶液体积未知,故不确定铁离子减少的浓度,D错误。
考点四 浓差电池 浓差电池是利用物质的浓度差产生电势的一种装置。两侧半电池中的特定物质有浓度差,离子均是由“高浓度”移向“低浓度”,依据阴离子移向负极区域,阳离子移向正极区域判断电池的正、负极,这是解题的关键。
1.浓差电池中的电动势是由于电池中存在浓度差而产生的。某浓差电池的工作原理示意图如下,该电池从浓缩海水中提取LiCl的同时又获得了电能。下列有关该电池的说法错误的是( )A.电池工作时,Li+通过离子导体移向Y极区B.电流由X极通过外电路流向Y极C.正极发生的反应为2H++2e-===H2↑D.Y极每生成1 ml Cl2,X极区得到 2 ml LiCl
解析:X极上H+发生还原反应:2H++2e-===H2↑,X极为正极,Y极上Cl-发生氧化反应:2Cl--2e-===Cl2↑,Y极是负极,电池工作时,Li+通过离子导体移向X极区,A项错误、C项正确;在外电路中电流由正极流向负极,B项正确;Y极每生成1 ml Cl2,转移2 ml电子,有2 ml Li+向正极移动,故X极区得到2 ml LiCl,D项正确。
2.利用同种气体在两极浓度不同而产生电势差可设计成气体浓差电池,利用浓差电池可测定混合气体中某气体含量。实验室通过氧气浓差电池测定空气中氧气含量的工作原理示意图如下,其中在参比电极上通入纯氧气,测量电极上通入空气。下列说法错误的是( )A.熔融ZrO2、CaO混合物可用于传递O2-B.工作时,电子由测量电极经外电路流向参比电极C.工作时,用初期读数计算所得空气中氧气含量更准确D.相同压强下,电势差越大,空气中氧气含量越高
解析:A.纯氧气在反应中得到电子发生还原反应转化为O2-,故参比电极为正极,负极上O2-失电子生成氧气,熔融金属氧化物电离出的氧离子向负极定向移动可用于传递O2-,A正确;B.电子由负极经外电路流向正极,故工作时,电子由测量电极经外电路流向参比电极,B正确;C.由工作原理知,负极上氧离子失去电子发生氧化反应会不断生成氧气,混合气体中氧气浓度增大,故用初期读数计算所得空气中氧气含量更准确,C正确;D.两极氧气浓度差越大,两极电势差越大,故相同压强下,电势差越大,空气中氧气含量越低,D错误。
1.(2022·新高考湖南卷)海水电池在海洋能源领域备受关注,一种锂-海水电池构造示意图如图,下列说法错误的是( )A.海水起电解质溶液作用B.N极仅发生的电极反应:2H2O+2e-===2OH-+H2↑C.玻璃陶瓷具有传导离子和防水的功能D.该锂-海水电池属于一次电池
2.(2022·新高考广东卷)科学家基于Cl2易溶于CCl4的性质,发展了一种无需离子交换膜的新型氯流电池,可作储能设备(如图)。充电时电极a的反应为NaTi2(PO4)3+2Na++2e-===Na3Ti2(PO4)3。下列说法正确的是( )A.充电时电极b是阴极B.放电时NaCl溶液的pH减小C.放电时NaCl溶液的浓度增大D.每生成1 ml Cl2,电极a质量理论上增加23 g
解析:由充电时电极a的反应可知,电极a上发生还原反应,电极a为阴极,电极b为阳极,A项错误;放电时,负极上Na3Ti2( PO4)3发生氧化反应释放出Na+,正极上Cl2发生还原反应生成Cl-,NaCl溶液的浓度增大,但溶液一直呈中性,故放电时NaCl溶液的pH不变,B项错误、C项正确;充电时,每生成1 ml Cl2,转移2 ml电子,由题干电极a的反应可知,有2 ml Na+参与反应,电极a质量理论上增加46 g,D项错误。
3.(2022·高考全国乙卷)Li-O2电池比能量高,在汽车、航天等领域具有良好应用前景。近年来,科学家研究了一种光照充电Li-O2电池结构,如下图所示。光照时,光催化电极产生电子(e-)和空穴(h+),驱动阴极反应(Li++e-===Li)和阳极反应(Li2O2+2h+===2Li++O2)对电池进行充电。下列叙述错误的是( )A.充电时,电池的总反应为Li2O2===2Li+O2B.充电效率与光照产生的电子和空穴量有关C.放电时,Li+从正极穿过离子交换膜向负极迁移D.放电时,正极发生反应O2+2Li++2e-===Li2O2
2025届高考化学一轮总复习第7章化学反应与能量第34讲原电池化学电源课件: 这是一份2025届高考化学一轮总复习第7章化学反应与能量第34讲原电池化学电源课件,共48页。PPT课件主要包含了氧化还原,原电池的构成条件,自发进行,形成闭合回路,平衡电荷,电极材料等内容,欢迎下载使用。
备战2025届新高考化学一轮总复习第6章化学反应与能量热点专攻16新型化学电源及分析课件: 这是一份备战2025届新高考化学一轮总复习第6章化学反应与能量热点专攻16新型化学电源及分析课件,共21页。PPT课件主要包含了热点精讲,热点精练等内容,欢迎下载使用。
新高考化学一轮复习课件 第6章 第36讲 新型化学电源: 这是一份新高考化学一轮复习课件 第6章 第36讲 新型化学电源,共60页。PPT课件主要包含了高考化学一轮复习策略,新型化学电源,浓差电池,物质循环转化型电池,锂电池与锂离子电池,微生物电池,真题演练明确考向,课时精练等内容,欢迎下载使用。












