




高考化学一轮复习第7章化学反应与能量第33讲化学能与热能课件
展开第33讲 化学能与热能
1.知道常见的吸热反应和放热反应,了解反应热、焓变的概念以及反应热产生的原因。2.了解热化学方程式的含义,能正确书写热化学方程式。3.了解燃烧热的含义和中和反应反应热的测定原理。4.了解盖斯定律及其简单应用,能进行反应焓变的简单计算。
考点一 反应热 焓变 1.反应热与焓变(1)反应热:在等温条件下,化学反应体系____________或____________的热量。(2)焓变①焓(H):与内能有关的物理量。②焓变(ΔH):ΔH=H(生成物)-H(反应物),单位为___________________。③焓变与反应热的关系:等压条件下的反应热等于反应的焓变,常用________表示反应热,常用单位是__________________。
kJ·ml-1(或kJ/ml)
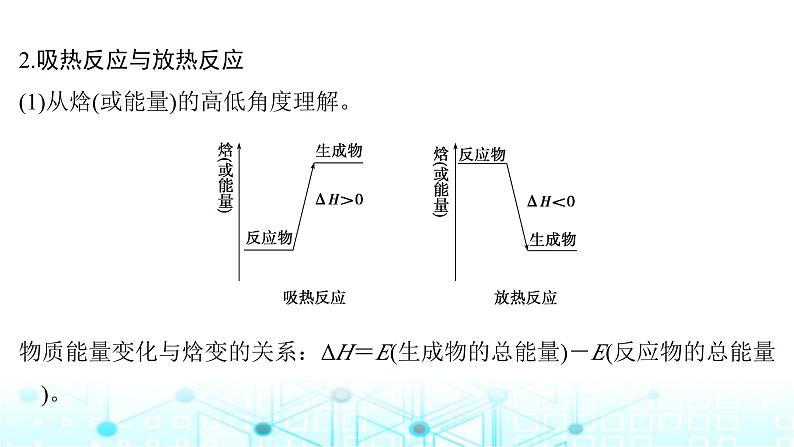
2.吸热反应与放热反应(1)从焓(或能量)的高低角度理解。 物质能量变化与焓变的关系:ΔH=E(生成物的总能量)-E(反应物的总能量)。
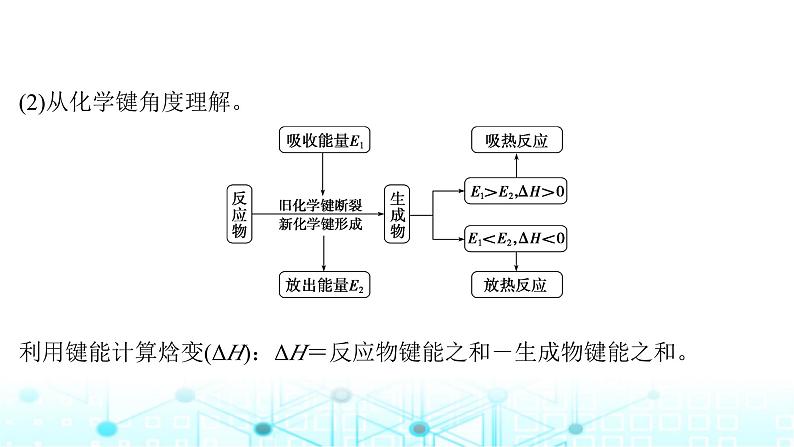
(2)从化学键角度理解。 利用键能计算焓变(ΔH):ΔH=反应物键能之和-生成物键能之和。
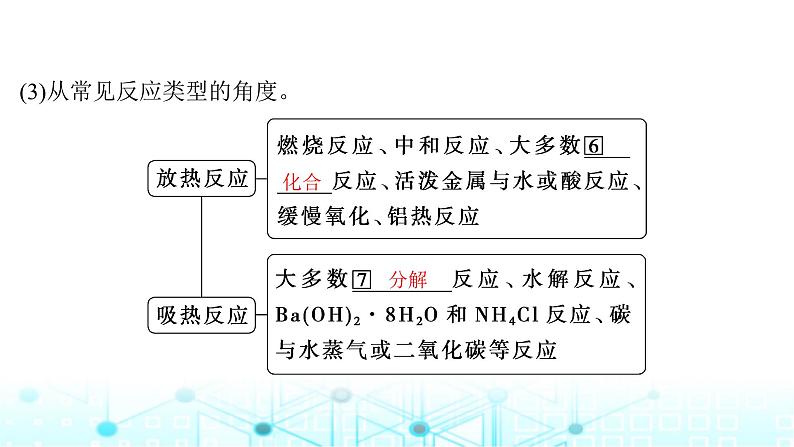
(3)从常见反应类型的角度。
3.热化学方程式(1)意义:表明了化学反应中的__________变化和________变化。例如,2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·ml-1,表示在25℃和101 kPa下,_____________________________________________________________ __________________________。
2 ml气态H2与1 ml气态O2反应生成2 ml液态H2O时,放出571.6 kJ的热量
(2)书写。①热化学方程式中必须注明反应物和生成物的_____________[固体(s)、液体(l)、气体(g)、水溶液(aq)],若为同素异形体,则还要注明名称。②热化学方程式要注明反应时的温度和压强。如不注明,即表示在25 ℃和101 kPa下测定。③热化学方程式中各物质前的化学计量数可以是________,也可以是________。当化学计量数改变时,其ΔH也____________的改变。④要注明ΔH的符号(“+”代表________,“-”代表________)以及单位(____________)。
[易错秒判](1)氢氧化钠固体溶于水放出大量的热,故该过程是放热反应( )(2)放热反应不需要加热就能进行,吸热反应不加热就不能进行( )(3)可逆反应的ΔH表示完全反应时的热量变化,与反应是否可逆无关( )(4)吸热反应中,反应物化学键断裂吸收的总能量高于生成物化学键形成放出的总能量( )(5)活化能越大,表明化学反应吸收的能量越多( )(6)同温同压下,反应H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH相同( )答案:(1)× (2)× (3)√ (4)√ (5)× (6)√
一、能量—反应历程图示分析1.科学家用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下。
回答下列问题:(1)从状态Ⅰ到状态Ⅲ为____________(填“吸热”或“放热”)反应。(2)从状态Ⅰ到状态Ⅱ需要______________(填“吸收”或“释放”)能量,CO分子__________(填“需要”或“不需要”)断键形成C和O。(3)从状态Ⅱ到状态Ⅲ形成的化学键是_______________________________。(4)将相同物质的量的CO转化为CO2,CO与O反应比CO与O2反应放出的热量________(填“多”或“少”),可能的原因是__________________。(5)由该反应过程可知,在化学反应中,旧化学键__________(填“一定”或“不一定”)完全断裂,但一定有新化学键的__________。
答案:(1)放热 (2)吸收 不需要 (3)碳氧双键(或C===O) (4)多 CO与O2反应生成CO2需要先吸收能量断裂O2分子中的共价键 (5)不一定 形成
2.(1)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如下图所示,其中吸附在金催化剂表面上的物种用*标注。
水煤气变换的ΔH________0(填“大于”“等于”或“小于”)。该历程中最大能垒(活化能)E正=________eV,写出该步骤的化学方程式:___________________。
解析:观察始态物质与终态物质的相对能量可知,终态物质的相对能量低于始态物质的相对能量,说明该反应是放热反应,ΔH小于0。过渡态物质的相对能量与其对应始态物质的相对能量相差越大,活化能越大,由题图可知,最大活化能E正=1.86 eV-(-0.16 eV)=2.02 eV,该步始态物质为COOH*+H*+H2O*,产物为COOH*+2H*+OH*。答案:小于 2.02 COOH*+H*+H2O*===COOH*+2H*+OH*(或H2O*===H*+OH*)
(2)(2022·新高考广东卷)铬及其化合物在催化、金属防腐等方面具有重要应用。 Cr2O3催化丙烷脱氢过程中,部分反应历程如下图,X(g)―→Y(g)过程的焓变为________________________________________(列式表示)。
解析:由题图可知,Y(g)的能量比X(g)的高,X(g)转化为Y(g)的反应为吸热反应,焓变为正值,反应共经历三个过程,均 为吸热过程,第一个过程的焓变为(E1-E2),第二个过程的焓变为ΔH,第三个过程的焓变为(E3-E4),根据盖斯定律,将三个过程的焓变相加即为X(g)转化为Y(g)过程的焓变。答案:(E1-E2)+ΔH+(E3-E4)
二、反应热与键能的相关计算3.几种化学键的键能数据见下表(亚硝酰氯的结构式为Cl—N===O): 则反应2NO(g)+Cl2(g)===2ClNO(g)的ΔH=________kJ·ml-1(用含a的代数式表示)。答案:289-2a
(2)根据下图中的能量关系,可求得C—H的键能为__________。
解析:C(s)===C(g) ΔH1=+717 kJ·ml-1,2H2(g)===4H(g) ΔH2=+864 kJ·ml-1,C(s)+2H2(g)===CH4(g) ΔH3=-75 kJ·ml-1。根据ΔH=反应物总键能-生成物总键能可得,-75 kJ·ml-1=(+717 kJ·ml-1)+(+864 kJ·ml-1)-4E(C—H),解得E(C—H)=414 kJ·ml-1。答案:414 kJ·ml-1
[归纳总结]熟记常见1 ml物质中的化学键数目
三、热化学方程式的书写5.依据事实,写出下列反应的热化学方程式。(1)合成氨反应常使用铁触媒提高反应速率。下图为有、无铁触媒时,反应的能量变化示意图。写出该反应的热化学方程式:_____________________。从能量角度分析,铁触媒的作用是__________________________________。
(2)已知25 ℃、101 kPa时,1 ml 葡萄糖[C6H12O6(s)]完全燃烧生成CO2(g)和H2O(l),放出2 804 kJ热量,写出25 ℃、101 kPa时,CO2(g)与H2O(l)经光合作用生成葡萄糖[C6H12O6(s)]和O2(g)的热化学方程式:___________。(3)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下2 g SiH4自燃放出热量89.2 kJ。SiH4自燃的热化学方程式为_________________________________________________________。(4)NaBH4(s)与H2O(l)反应生成NaBO2(s)和H2(g),在25 ℃、101 kPa下,已知每消耗3.8 g NaBH4(s)放热21.6 kJ,该反应的热化学方程式为________________________________________________________________。
答案:(1)N2(g)+3H2(g)⇌2NH3(g) ΔH=-(a-b) kJ·ml-1 降低反应的活化能(2)6CO2(g)+6H2O(l)===C6H12O6(s)+6O2(g) ΔH=+2 804 kJ·ml-1(3)SiH4(g)+2O2(g)===SiO2(s)+2H2O(l) ΔH=-1 427.2 kJ·ml-1(4)NaBH4(s)+2H2O(l)===NaBO2(s)+4H2(g) ΔH=-216 kJ·ml-1
考点二 中和反应反应热 燃烧热 能源 1.中和反应反应热及其测定(1)中和反应反应热。在稀溶液中,强酸和强碱发生中和反应生成 ________________时所放出的热量。
1 ml H2O(l)
(3)测定装置(4)实验步骤①绝热装置组装→②量取一定体积酸、碱稀溶液→③测反应前酸、碱液温度→④混合酸、碱液测反应时最高温度→⑤重复2~3次实验→⑥求平均温度差(t终-t始)→⑦计算中和反应反应热ΔH。
(5)注意事项①隔热层及杯盖的作用是保温、隔热,减少热量损失。②为保证酸、碱完全中和,常采用碱稍过量(0.50 ml·L-1 盐酸、0.55 ml·L-1 NaOH溶液等体积混合)。③实验时不能用铜丝搅拌器代替玻璃搅拌器,理由是铜丝导热性好,比用玻璃搅拌器误差大。
2.燃烧热(1)燃烧热①概念:在101 kPa时,________ ml纯物质______________生成指定产物时所放出的热量,单位是kJ/ml。②意义:衡量燃料燃烧时放出热量的多少。(2)对“完全燃烧”的理解
[易错秒判](1)沼气和天然气的主要成分相同,都属于可再生能源( )(2)在测定中和反应反应热的实验中,可用金属搅拌器代替玻璃搅拌器( )(3)开发利用各种新能源,减少对化石燃料的依赖,可以降低空气中PM2.5的含量( )(4)在测定中和反应反应热的实验中,应把NaOH溶液分多次倒入( )(5)根据2H2(g)+O2(g)===2H2O(l) ΔH=-571 kJ·ml-1可知,氢气的燃烧热ΔH为 -571 kJ·ml-1( )(6)根据H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·ml-1可知,H2S溶液与 Ba(OH)2反应的ΔH=2×(-57.3) kJ·ml-1( )答案:(1)× (2)× (3)√ (4)× (5)× (6)×
解析:所给热化学方程式中有两处错误,一是中和反应反应热指的是反应生成1 ml H2O(l)时所放出的热量,二是当有BaSO4沉淀生成时,反应放出的热量会增加,即该反应生成1 ml H2O(l)时放出的热量大于57.3 kJ,A项错误;燃烧热指的是在101 kPa时,1 ml 纯物质完全燃烧生成指定产物时所放出的热量,产物中的水应为液态,C项错误;2 ml辛烷完全燃烧生成CO2(g) 和H2O(l),放出的热量为 11 036 kJ,且辛烷应为液态,D项错误。
2.已知在25 ℃、101 kPa下,C2H2(g)、甲醇(l)的燃烧热ΔH分别为-1 299.5 kJ·ml-1、-727 kJ·ml-1,则表示C2H2(g)、甲醇(l)燃烧热的热化学方程式分别为______________________________、___________________________。答案:C2H2(g)+2.5O2(g)===2CO2(g)+H2O(l) ΔH=-1 299.5 kJ·ml-1CH3OH(l)+1.5O2(g)===CO2(g)+2H2O(l) ΔH=-727 kJ·ml-1
二、中和反应反应热的测定3.利用如图所示装置测定中和反应反应热的实验步骤如下。①用量筒量取50 mL 0.50 ml·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 ml·L-1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液的最高温度。
回答下列问题。(1)NaOH溶液稍过量的原因是__________________________________。(2)倒入NaOH溶液的正确操作是________(填字母,下同)。A.沿玻璃棒缓慢倒入B.分三次倒入C.一次迅速倒入(3)使盐酸与NaOH溶液混合均匀的正确操作是________。A.用温度计小心搅拌B.揭开杯盖用玻璃棒搅拌C.轻轻地振荡烧杯D.用套在温度计上的玻璃搅拌器轻轻地搅动
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 ml·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,三者的大小关系为_____________________________________________________。
(5)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和反应反应热,某学生实验记录数据如下。 依据该学生的实验数据计算,该实验测得的中和反应反应热ΔH=________________(结果保留一位小数)。
答案:(1)确保盐酸被完全中和(2)C(3)D(4)ΔH1=ΔH2<ΔH3(5)-51.8 kJ·ml-1
考点三 盖斯定律 反应热的相关计算与比较 1.盖斯定律(1)内容:一个化学反应,不管是一步完成的还是分几步完成的,其反应热是相同的。即在一定条件下,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。(2)意义:间接计算某些反应的反应热。
一、盖斯定律的应用1.(2024·茂名高三开学考试)以CO2、H2为原料合成CH3OH涉及的主要反应如下:Ⅰ.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH1=-49.5 kJ·ml-1Ⅱ.CO(g)+2H2(g)⇌CH3OH(g) ΔH2=-90.4 kJ·ml-1Ⅲ.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH3经计算ΔH3=________kJ·ml-1。
解析:分析三个热化学方程式,根据盖斯定律可得,反应Ⅲ=反应Ⅰ-反应Ⅱ,ΔH3=ΔH1 -ΔH2=(-49.5 kJ·ml-1)-(-90.4 kJ·ml-1)=+40.9 kJ·ml-1。答案:+40.9
答案:2V2O5(s)+2SO2(g)===2VOSO4(s)+V2O4(s) ΔH=-351 kJ·ml-1
3.大气中的二氧化碳主要来自煤、石油及其他含碳化合物的燃烧。已知25 ℃时,相关物质的燃烧热数据如下表。 25 ℃时H2(g)和C(石墨,s)反应生成C6H6(l)的热化学方程式为__________。
答案:3H2(g)+6C(石墨,s)===C6H6(l) ΔH=+49.1 kJ·ml-1
[思维建模]利用盖斯定律计算反应热的“四步骤”
5.室温下,将1 ml CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1 ml CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4·5H2O受热分解的化学方程式为 CuSO4·5H2O(s)===CuSO4(s)+5H2O(l),热效应为ΔH3。下列判断正确的是( )A.ΔH2>ΔH3B.ΔH1<ΔH3C.ΔH1+ΔH3=ΔH2D.ΔH1+ΔH2>ΔH3
ΔH1>0,ΔH2<0,ΔH3=ΔH1-ΔH2,则ΔH1<ΔH3,B正确;ΔH3=ΔH1-ΔH2,C错误;ΔH1>0,ΔH2<0,ΔH1<ΔH3,故ΔH1+ΔH2<ΔH3,D错误。
1.(2023·新高考重庆卷)在银催化下,乙烯与氧气反应生成环氧乙烷(EO)和乙醛(AA)。根据图示,回答下列问题: (1)中间体OMC生成吸附态EO(ads)的活化能为________kJ/ml。(2)由EO(g)生成AA(g)的热化学方程式为___________。答案:(1)83 (2)EO(g)⇌AA(g) ΔH=-102 kJ/ml
2.(2023·新高考北京卷)二十世纪初,工业上以CO2和NH3为原料在一定温度和压强下合成尿素。反应分两步:ⅰ.CO2和NH3生成NH2COONH4;ⅱ.NH2COONH4分解生成尿素。
结合反应过程中能量变化示意图,下列说法正确的是________(填序号)。a.活化能:反应ⅰ<反应ⅱb.反应ⅰ为放热反应,反应ⅱ为吸热反应c.CO2(l)+2NH3(l)===CO(NH2)2(l)+H2O(l) ΔH=E1-E4解析:a.反应ⅰ的活化能是E1,反应ⅱ的活化能是E3,E1
4.(2023·浙江6月选考)水煤气变换反应是工业上的重要反应,可用于制氢。水煤气变换反应:CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH=-41.2 kJ·ml-1该反应分两步完成:3Fe2O3(s)+CO(g)⇌2Fe3O4(s)+CO2(g) ΔH1=-47.2 kJ·ml-12Fe3O4(s)+H2O(g)⇌3Fe2O3(s)+H2(g) ΔH2则ΔH2=________kJ·ml-1。
2025届高考化学一轮总复习第7章化学反应与能量第33讲化学能与热能课件: 这是一份2025届高考化学一轮总复习第7章化学反应与能量第33讲化学能与热能课件,共60页。PPT课件主要包含了向环境释放,从环境吸收,聚集状态,同等倍数,kJ·mol-1,答案66475,完全燃烧,能源及利用,aΔH2,-ΔH2等内容,欢迎下载使用。
高考化学一轮复习课件第6章第1讲 化学能与热能(含解析): 这是一份高考化学一轮复习课件第6章第1讲 化学能与热能(含解析),共46页。PPT课件主要包含了知识点1,热效应,kJ·mol-1,kJmol,知识点2,物质的量,反应热,训练二十七等内容,欢迎下载使用。
人教版高考化学一轮复习第6章化学反应与能量第1讲化学能与热能课件: 这是一份人教版高考化学一轮复习第6章化学反应与能量第1讲化学能与热能课件












