
2023届高考化学第二轮专项突破模拟练习——元素或物质推断题(含解析)
展开
这是一份2023届高考化学第二轮专项突破模拟练习——元素或物质推断题(含解析),共27页。
2023届高考化学第二轮专项突破模拟练习
——元素或物质推断题
1.(2023·浙江·校联考三模)固体化合物X(式量介于100~160之间)由两种元素组成,某实验小组按如下流程进行相关实验:
已知:固体单质B为黑色,溶液D中除盐酸外仅有一种含氯的一元弱酸。请回答下列问题:
(1)X的化学式为_______;A、B分别为_______ (写名称)。
(2)绿色溶液E中除、外的主要离子有_______。写出单质A与浓盐酸反应的离子方程式_______。
(3)X在氨水中用空气处理,形成深蓝色溶液,同时生成黑色固体B。写出该反应的离子方程式_______。
(4)在加热条件下,过量C与发生物质的量比为1:1的氧化还原反应,设计实验检验所得混合气体中,常温常压下呈气态的物质_______。
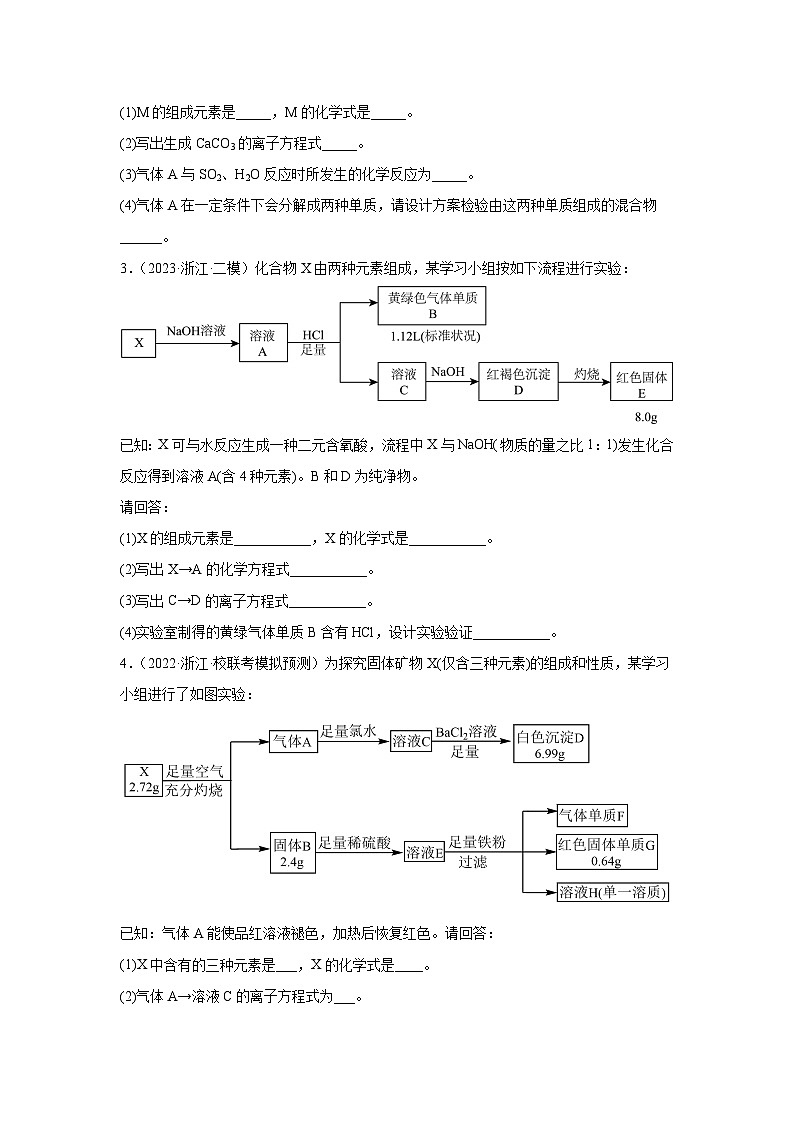
2.(2023·浙江金华·校联考模拟预测)化合物M由三种元素组成,某小组按如图实验流程探究其组成:
已知:物质A、B只含两种元素;白色沉淀F的质量是D的2倍。
请回答:
(1)M的组成元素是_____,M的化学式是_____。
(2)写出生成CaCO3的离子方程式_____。
(3)气体A与SO2、H2O反应时所发生的化学反应为_____。
(4)气体A在一定条件下会分解成两种单质,请设计方案检验由这两种单质组成的混合物______。
3.(2023·浙江·二模)化合物X由两种元素组成,某学习小组按如下流程进行实验:
已知:X可与水反应生成一种二元含氧酸,流程中X与NaOH(物质的量之比1:1)发生化合反应得到溶液A(含4种元素)。B和D为纯净物。
请回答:
(1)X的组成元素是___________,X的化学式是___________。
(2)写出X→A的化学方程式___________。
(3)写出C→D的离子方程式___________。
(4)实验室制得的黄绿气体单质B含有HCl,设计实验验证___________。
4.(2022·浙江·校联考模拟预测)为探究固体矿物X(仅含三种元素)的组成和性质,某学习小组进行了如图实验:
已知:气体A能使品红溶液褪色,加热后恢复红色。请回答:
(1)X中含有的三种元素是___,X的化学式是____。
(2)气体A→溶液C的离子方程式为___。
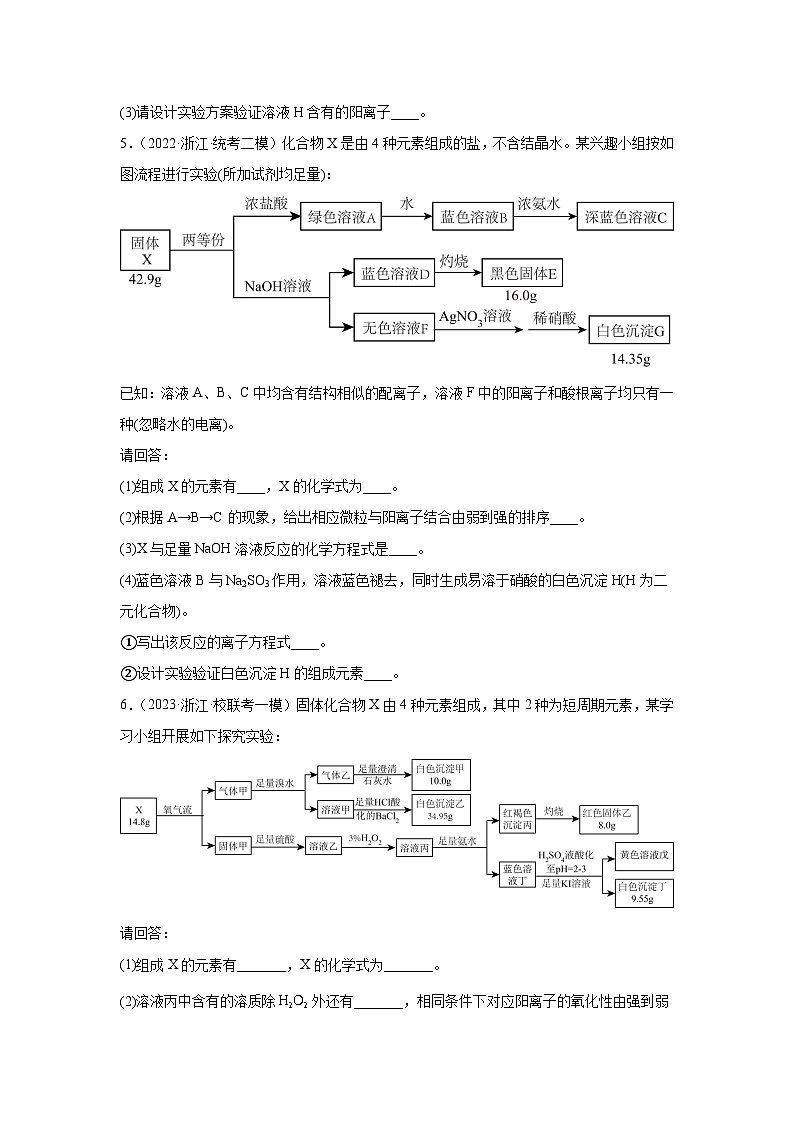
(3)请设计实验方案验证溶液H含有的阳离子____。
5.(2022·浙江·统考二模)化合物X是由4种元素组成的盐,不含结晶水。某兴趣小组按如图流程进行实验(所加试剂均足量):
已知:溶液A、B、C中均含有结构相似的配离子,溶液F中的阳离子和酸根离子均只有一种(忽略水的电离)。
请回答:
(1)组成X的元素有____,X的化学式为____。
(2)根据A→B→C的现象,给出相应微粒与阳离子结合由弱到强的排序____。
(3)X与足量NaOH溶液反应的化学方程式是____。
(4)蓝色溶液B与Na2SO3作用,溶液蓝色褪去,同时生成易溶于硝酸的白色沉淀H(H为二元化合物)。
①写出该反应的离子方程式____。
②设计实验验证白色沉淀H的组成元素____。
6.(2023·浙江·校联考一模)固体化合物X由4种元素组成,其中2种为短周期元素,某学习小组开展如下探究实验:
请回答:
(1)组成X的元素有_______,X的化学式为_______。
(2)溶液丙中含有的溶质除外还有_______,相同条件下对应阳离子的氧化性由强到弱的排序为_______。
(3)溶液丁到沉淀丁的离子方程式是_______。
(4)已知白色沉淀丁几乎不溶于水和乙醇,溶于盐酸且该过程中铜元素化合价没有变化,请设计实验验证白色沉淀丁的组成元素_______。
7.(2021·陕西咸阳·统考一模)有八种短周期主族元素,其中随着原子序数的递增,其原子半径的相对大小、最高正价或最低负价的变化如图1所示。的最高价氧化物对应水化物溶液(浓度均为)的与原子序数的关系如图2所示。
根据上述信息回答下列问题:
(1)g在元素周期表中的位置是___________。
(2)比较的简单离子半径大小为____________________(用离子符号表示);的最高价氧化物对应的水化物酸性较强的是___________(用化学式表示)。
(3)下列可作为比较e和f金属性强弱的依据是___________(填字母)。
A.测等浓度相应氯化物水溶液的B.测两种元素单质的硬度和熔、沸点
C.比较单质作还原剂时失去的电子数目的多少D.比较单质与同浓度盐酸反应的剧烈程度
(4)由元素组成的剧毒化合物不慎泄漏时,通常用过氧化氢溶液处理,以减少污染,反应生成一种酸式盐和一种气体,二者溶于水均呈碱性,该反应的化学方程式为___________。
8.(2021·广东茂名·校联考三模)辣椒素又名辣椒碱(capsaicin),是常见的生物碱之一、辣椒素H的合成路线如下。
请完成下列问题
(1)B的键线式是_______。
(2)E中官能团的名称是_______。
(3)C→D中反应i的化学方程式是_______,反应类型是_______。
(4)F与G反应生成H时,另一产物为_______(填化学式)。
(5)的同分异构体中,同时符合下列条件的有_______种(不含立体异构)。
①具有四取代苯结构,且核磁共振氢谱显示,其苯环上只有一种化学环境的H
②红外光谱测得其分子结构中含有和-OH
③进一步测得,该物质能与NaOH反应,且1mol该物质能消耗2molNaOH写出其中任意两种的结构简式_______。
(6)参照上述合成路线,设计以异丙醇和必要试剂为原料合成2-异丙基丙二酸()的合成路线。_______(其他试剂任选)。
9.(2021·陕西咸阳·统考一模)是中学常见的几种化合物,相关物质间的转化关系如图所示:
已知:是生活中常见的金属单质,都是氧化物且A是红棕色粉末。回答下列问题:
(1)单质X与A反应的化学方程式是___________。
(2)若试剂1和试剂2均为强电解质。
①若试剂1为强碱,则试剂1与B反应的离子方程式为___________。
②若试剂1和试剂2为同种物质,则C溶液显___________(填“酸性”、“碱性”或“中性”)。
(3)若试剂2是稀硝酸。
①写出单质Y与稀硝酸反应生成E的离子方程式___________。
②可用于检验D的阳离子的试剂是___________。
10.(2021·浙江宁波·校联考模拟预测)为探究由三种短周期元素构成的化合物X(其中一种为金属元素)的组成和性质,某研究小组设计并完成了如下实验(步骤中所加试剂均过量)。
请回答下列问题:
(1)组成X的三种元素是___________,X的化学式是___________。
(2)X与足量NaOH溶液反应的化学方程式是___________。
(3)将溶液B加入到溶液A中会出现白色沉淀,该反应离子反应方程式为___________。
(4)常温下,将金属单质C投入到H2O2溶液中并加入少量稀H2SO4,观察到溶液变蓝色且一段时间后产生大量气泡,原因是___________。
(5)已知气体B中会混有另一物质C.请设计实验证明C的存在___________。
11.(2020·福建福州·福建省福州第一中学校考一模)A、B、C、D、E五种物质均含有同一种元素,它们之间有如图所示转化关系。
(1)若A~E均为化合物,均含有Y元素,A是淡黄色固体;物质的量浓度相等的B、C两溶液中,C溶液的pH较小;电解D的水溶液可以生成B和两种气体单质,该反应是工业上生产B的重要反应。写出电解D的水溶液时发生反应的化学方程式:______。
(2)若A为气体单质,C、D的相对分子质量相差16,常温下,0.1mol·L-1 E溶液中只有3种离子,且溶液中的。则:
①A、B、C、D、E中都含有的元素在周期表中是位置为____,B的电子式为____。
②E→ C反应的离子方程式为________________。
(3)若A为短周期元素组成的固体非金属单质,标准状况下2.24 L C气体通入1L0.1mol·L-1的NaOH溶液中,恰好完全反应,所得溶液的pH______(用分子式表示)__________
(3)Q与R两元素组成的分子构型可能是___________(填写序号)。
a.直线型 b.平面形 c.三角锥形 d.正四面体
(4)元素M、Y在周期表中位于同一主族,且为短周期元素,化合物Cu2M和Cu2Y可发生如下转化(其中D是淀粉水解的最终产物):,非金属M_______Y(填“>”或“<”),请用事实说明该结论:________________________.
18.(2019·河南郑州·统考一模)Q、W、X、Y、Z 是位于不同主族的五种短周期元素,其原子序数依次增大。
①W 的氢化物与 W 最高价氧化物对应水化物反应生成化合物甲。
②X、Y、Z 的最高价氧化物对应水化物之间两两反应均可生成盐和水。
③常温下,Q 的最高价气态氧化物与化合物 X2O2 发生反应生成盐乙。
请回答下列各题:
(1)甲的水溶液呈酸性,用离子方程式表示其原因____________________________________________________________________________。
(2)③中反应的化学方程式为________________________________________________________________________________________________。
(3)已知:ZO3n-+M2++H+→Z-+M4+ + H2O(M 为金属元素,方程式未配平)由上述信息可推测 Z 在周期表中位置为________________________________________________________________________________________________。
(4)Y 形成的难溶半导体材料 CuYO2 可溶于稀硝酸,同时生成 NO。写出此反应的离子方秳式_____________________________。
参考答案:
1.(1) Cu2C2 铜、炭
(2) [CuCl4]2-、[Cu(H2O)4]2+、Cu2+ 2Cu+4H++4Cl-=2HCuCl2+H2↑
(3)Cu2C2+O2+8NH3H2O=2[Cu(NH3)]2++4OH-+2C+6H2O
(4)将反应后混合气体依次通过品红溶液和足量氢氧化钠溶液中,若品红溶液褪色,则证明有SO2,若氢氧化钠溶液中有气泡,则证明有CO
【分析】气体F通入澄清石灰水中生成白色沉淀,该白色沉淀是CaCO3,物质的量为=0.05mol,则固体单质B为C,物质的量为0.05mol,固体单质A和浓盐酸反应生成溶液D,溶液D中除盐酸外仅有一种含氯的一元弱酸HCuCl2,溶液D中加入H2O2溶液后得到绿色溶液E,CuCl2在很浓的水溶液中形成[CuCl4]2-呈现黄绿色,可以推知A为Cu,X中Cu元素物质的量为,X中n(Cu):n(C)=1:1,X式量介于100~160之间,则X的化学式为Cu2C2,以此解答。
【详解】(1)由分析可知,X的化学式为Cu2C2;A、B分别为铜、炭。
(2)由分析可知,绿色溶液E中除、外的主要离子有[CuCl4]2-、[Cu(H2O)4]2+、Cu2+;单质Cu与浓盐酸反应生成含氯的一元弱酸HCuCl2和H2,离子方程式为:2Cu+4H++4Cl-=2HCuCl2+H2↑ 。
(3)Cu2C2在氨水中用空气处理,和空气中的O2发生氧化还原反应形成深蓝色的 [Cu(NH3)]2+溶液,同时生成黑色固体C,离子方程式为:Cu2C2+O2+8NH3H2O=2[Cu(NH3)]2++4OH-+2C+6H2O。
(4)在加热条件下,过量C与发生物质的量比为1:1的氧化还原反应,S元素化合价下降可能产生SO2,C元素化合价下降可能产生CO或CO2,验证方法是:将反应后混合气体依次通过品红溶液和足量氢氧化钠溶液中,若品红溶液褪色,则证明有SO2,若氢氧化钠溶液中有气泡,则证明有CO。
2.(1) Ca、Cl、O CaCl2O4
(2)CO+Ca2+=CaCO3↓
(3)2ClO2+5SO2+6H2O=2HCl+5H2SO4
(4)将混合气体通过NaOH溶液,获得溶液和剩余气体,将带火星木条伸入剩余气体中,复燃,证明有氧气;将酚酞滴入溶液中,如果先变红后褪色,证明原气体中有氯气
【分析】化合物M由三种元素组成,3.50gM与氯气反应固体B和生成气体A,A的物质的量是0.896L÷22.4L/mol=0.04mol,A通入二氧化硫水溶液中恰好反应,所得溶液分两份,一份加入足量硝酸银溶液生成白色沉淀D,另一份加入足量氯化钡溶液生成11.65g白色沉淀,沉淀应该是硫酸钡,物质的量是11.65g÷233g/mol=0.05mol,根据电子得失可判断A和SO2反应中A得到0.05mol×2×2=0.2mol,即1分子A得到5个电子,由于物质A、B只含两种元素,因此A中氯元素的化合价是+4价,被还原为-1价,则A是ClO2。固体B中加入足量碳酸钠生成碳酸钙2.00g,物质的量是0.02mol,滤液中加入足量硝酸银溶液生成白色沉淀F,B是氯化钙,物质的量是0.02mol,F的物质的量是0.04mol,白色沉淀F的质量是D的2倍,说明A中氯原子和B中氯原子的物质的量相等,据此解答。
【详解】(1)A是ClO2,A的物质的量是0.04mol,含有氧原子的物质的量是0.08mol,氯化钙的物质的量是0.02mol,M中Ca原子的物质的量是0.02mol,因此M中氯原子的物质的量是=0.04mol,所以M中Ca、Cl、O的原子个数之比是1:2:4,所以M的化学式是CaCl2O4。
(2)氯化钙和碳酸钠反应生成碳酸钙沉淀,则生成CaCO3的离子方程式为CO+Ca2+=CaCO3↓。
(3)根据电子得失守恒和原子守恒可知气体ClO2与SO2、H2O反应时所发生的化学反应为2ClO2+5SO2+6H2O=2HCl+5H2SO4;
(4)ClO2分解生成氧气和氯气,氧气是助燃性气体,氯气具有强氧化性,和水反应生成次氯酸具有漂白性,所以实验方案为将混合气体通过NaOH溶液,获得溶液和剩余气体,将带火星木条伸入剩余气体中,复燃,证明有氧气;将酚酞滴入溶液中,如果先变红后褪色,证明原气体中有氯气。
3.(1) Fe、O FeO2
(2)FeO2+NaOH= NaHFeO3
(3)Fe3++3OH-=Fe(OH)3↓
(4)用四氯化碳除去氯气后,再通入紫色石蕊溶液中,紫色石蕊只变红不褪色,说明Cl2含有HCl
【分析】C与氢氧化钠反应生成红褐色沉淀D,D灼烧生成8g红色固体E,则E是Fe2O3,n(Fe2O3)=0.05mol;C中含有0.1molFe3+,1.12L标准状况下的黄绿色气体单质为氯气,n(Cl2)=0.05mol,溶液A和盐酸发生氧化还原反应生成氯气和Fe3+,根据得失电子守恒,A中Fe元素为+4价,流程中X与NaOH(物质的量之比1:1)发生化合反应得到溶液A(含4种元素),X中含有Fe、O两种元素,X为FeO2,A的化学式为NaHFeO3。
【详解】(1)根据以上分析,X的化学式是FeO2,X的组成元素是Fe、O;
(2)FeO2与NaOH(物质的量之比1:1)发生化合反应得到NaHFeO3,反应的化学方程式为FeO2+NaOH= NaHFeO3;
(3)C→D是氯化铁和氢氧化钠反应生成氢氧化铁沉淀,反应的离子方程式Fe3++3OH-=Fe(OH)3↓;
(4)氯气易溶于四氯化碳,用四氯化碳除去氯气后,再通入紫色石蕊溶液中,紫色石蕊只变红不褪色,说明Cl2含有HCl。
4.(1) Fe、Cu、S或铁、铜、硫 CuFe2S3
(2)SO2+Cl2+2H2O=4H++2Cl-+
(3)方案一:取少量H溶液于试管中,加几滴KSCN溶液无明显现象,再加几滴H2O2或氯水溶液变红色,证明含有Fe2+。
方案二:取少量H溶液于试管中,加几滴KMnO4溶液,若紫色褪去,证明含有Fe2+
【分析】结合转化关系可知:X煅烧产生的气体A能使品红溶液褪色,加热后恢复红色,则气体A是SO2,SO2与氯水发生反应:SO2+Cl2+2H2O=H2SO4+2HCl,溶液C为H2SO4、HCl混合溶液,向其中加入足量BaCl2溶液,生成的白色沉淀为BaSO4,由质量守恒可知X中含有S的物质的量为:n(S)=n()=n(BaSO4)=,m(S)=0.03 mol×32g/mol=0.96 g;灼烧产生的固体B与硫酸反应产生溶液E,E中加入足量铁粉得到的红色单质G为Cu,0.64 g Cu物质的量n(Cu)=;若固体B为CuO,m (B)=0.01 mol×80 g/mol=0.8 g<2.4 g,说明B中还含有其它元素,结合溶液H为单一溶质可知,E中加入足量Fe粉,固体B含有的其它元素只能为Fe,B为Fe2O3、CuO的混合物,E为CuSO4、Fe(SO4)3及过量H2SO4的混合物,向溶液E中加入足量Fe粉,发生反应:2Fe3++Fe=3Fe2+;Cu2++Fe=Cu+Fe2+;Fe+2H+=Fe2++H2↑,溶液H溶质为FeSO4,固体矿物X由三种元素组成,则m(Fe)=2.72 g-0.96 g-0.64 g=1.12 g,n(Fe)=,n(Cu):n(Fe):n(S)=0.01 mol:0.02 mol:0.03 mol=1:2:3,则X的化学式为CuFe2S3,以此分析解答。
【详解】(1)根据上述分析可知:X中含有的三种元素是Fe、Cu、S;X的化学式为CuFe2S3;
(2)气体A为SO2,SO2与氯水反应产生硫酸和盐酸,根据电子守恒、电荷守恒、原子守恒及物质的拆分原则,可知该反应的离子方程式为:SO2+Cl2+2H2O=4H++2Cl-+;
(3)溶液H为FeSO4,可根据Fe2+的还原性及Fe3+遇SCN-使溶液变为血红色判断。操作方案一:取少量H溶液于试管中,加几滴KSCN溶液无明显现象,再加几滴H2O2或氯水溶液变红色,证明溶液H中含有Fe2+。
存在方案二:取少量H溶液于试管中,加几滴KMnO4溶液,若紫色褪去,证明溶液H中含有Fe2+。
5.(1) Cu、O、H、Cl Cu2(OH)3Cl
(2)Cl-NH3 abd < 2H2S + O2 → 2H2O +S
【分析】Q、R、X、Y、Z是原子序数依次增大的五种短周期元素,在短周期的所有元素中Q的原子半径与Z的原子半径之比最小(不包括稀有气体),则Q的原子半径最小,Z的原子半径最大,所以Q是H元素,Z是Na元素;R、X、Y三种元素的原子核外电子层数相同,这三种元素处于第二周期,同一周期中R的一种单质的熔点最高,金刚石的熔点最高,所以R是C元素,Y与Q、R、X、Z均能形成多种常见化合物,则Y是O元素,所以X是N元素,据此分析解答。
【详解】根据上述分析,Q是H元素,R是C元素,X是N元素,Y是O元素,Z是Na元素。
(1)X是N元素,处于第二周期第VA族,其核外电子排布式为1s22s22p3,所以有两种电子云;这五种元素中,最外层有两个未成对电子的元素是C和O元素,故答案为:第2周期第VA族;2;C、O;
(2)Q分别与X、Y形成的最简单化合物是NH3、H2O,非金属的非金属性越强,氢化物的稳定性越强,O的非金属性大于N元素,所以稳定性H2O>NH3,故答案为:H2O>NH3;
(3)Q与R两元素组成的分子可能是甲烷、乙烯、乙炔、苯等烃类物质,其中甲烷为正四面体结构,乙烯为平面结构,乙炔为直线形结构,故选abd,故答案为:abd;
(4)D是淀粉水解的最终产物,D为葡萄糖,根据悬浊液与D的溶液(葡萄糖溶液)生成氧化亚铜,推出Y为O元素,再根据M,Y同主族,推出M为S元素,同一主族,从上往下,非金属性在逐渐减弱,所以,非金属性M<Y;非金属性越强,单质的氧化性越强,因此将氧气通入氢硫酸溶液中会析出硫沉淀,2H2S + O2 → 2H2O +S,故答案为:<;2H2S + O2 → 2H2O +S。
【点睛】本题的第(4)小题给出的流程图感觉是多余的,只需要知道“M、Y在周期表中位于同一主族,且为短周期元素”即可。本题的易错点为(3),要注意常见烃分子的结构。
18. NH4++H2O NH3·H2O+H+ 2Na2O2+2CO2=2Na2CO3+O2 第三周期第ⅦA 族 16H++3CuAlO2+NO3-=3Cu2++ 3Al3++NO+ 8H2O
【分析】根据题干可知 Q、W、X、Y、Z 分别为 C、N、O、Na、Cl 五种元素。
(1)甲为硝酸铵,其水溶液呈酸性,主要是铵根水解显酸性,其离子方程式表示其原因NH4++H2O NH3·H2O+H+。
(2)③中反应为二氧化碳和过氧化钠反应生成碳酸钠和氧气,其化学方程式为2Na2O2+2CO2=2Na2CO3+O2。
(3)根据方程式ZO3n- →Z-,由上述信息可推测Z为Cl,在周期表中位置为第三周期第ⅦA 族。
(4)Y形成的难溶半导体材料 CuYO2 可溶于稀硝酸,同时生成NO。此反应的离子方程式为16H++3CuAlO2+NO3-=3Cu2++ 3Al3++NO+ 8H2O。
【详解】(1)甲为硝酸铵,其水溶液呈酸性,主要是铵根水解显酸性,其离子方程式表示其原因NH4++H2O NH3·H2O+H+,故答案为:NH4++H2O NH3·H2O+H+。
(2)③中反应为二氧化碳和过氧化钠反应生成碳酸钠和氧气,其化学方程式为2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2。
(3)根据方程式ZO3n- →Z-,由上述信息可推测Z为Cl,在周期表中位置为第三周期第ⅦA 族,故答案为:第三周期第ⅦA 族。
(4)Y形成的难溶半导体材料 CuYO2 可溶于稀硝酸,同时生成NO。此反应的离子方程式为16H++3CuAlO2+NO3-=3Cu2++ 3Al3++NO+ 8H2O,故答案为:16H++3CuAlO2+NO3-=3Cu2++ 3Al3++NO+ 8H2O。
相关试卷
这是一份2024届新高考化学第一轮专项训练复习——元素或物质推断题4(含解析),共31页。
这是一份2024届新高考化学第一轮专项训练复习——元素或物质推断题3(含解析),共28页。
这是一份2024届新高考化学第一轮专项训练复习——元素或物质推断题(一)含解析,共32页。试卷主要包含了表格是元素周期表的一部分等内容,欢迎下载使用。









