

山东省济宁邹城市2022-2023学年高一下学期期中考试化学试题(Word版含答案)
展开邹城市2022-2023学年高一下学期期中考试
化 学 试 题 2023.04
说明:①本试卷分第I卷(选择题)和第Ⅱ卷(非选择题)两部分,第I卷40分,第Ⅱ卷
60分,共100分。 考试时间90分钟。
②请考生将第I卷选择题的正确选项用2B铅笔涂写在答题卡上。第Ⅱ卷题目的答
案用0.5毫米黑色中性笔写在答题卡的相应位置上,答案写在试卷上的无效。
③可能用到的相对原子质量: H:1 C:12 N:14 O:16 S:32 Cu:64
第I卷 选择题(共40分)
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1.中国在航天、天文等领域的发展受到世界瞩目。下列说法错误的是
A. “中国天眼”,其镜片材料为SiC,断裂其中化学键Si-C,需要吸收能量
B. 彩色玻璃是制玻璃过程中加入一些金属氧化物或盐制得的,可用于建筑和装饰
C.“天宫二号”空间实验室的太阳能电池板的主要材料是二氧化硅
D.“神舟十一号”宇宙飞船返回舱外表面使用的高温结构陶瓷是新型无机非金属材料
2.化学与生活、生产密切相关。下列说法错误的有
A. “千锤万凿出深山,烈火焚烧若等闲”描述的石灰石煅烧是放热反应
B. “光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化合物有关
C. 工业生产玻璃、水泥均需要用石灰石做原料
D.“冰,水为之,而寒于水”说明等质量的水和冰相比,冰的能量更低
3.用下列实验装置完成对应实验,能达到实验目的的是
A.用甲装置制取并收集少量氨气 B.用乙装置验证浓硫酸有氧化性
C.用丙装置完成喷泉实验 D.用丁装置验证氨气溶于水呈碱性
4.下列指定反应的离子方程式正确的是
A.用酸性高锰酸钾测定空气中SO2的含量5SO2 + 2MnO4- + 4OH- =5SO4 2-+ 2Mn2+ + 2H2O
B.铜与稀硝酸反应:3Cu + 2NO3-+ 8H+ = 3Cu2++2NO+4H2O
C.向稀硝酸中加入过量铁粉:Fe + NO3-+4H+=Fe3++NO+2H2O
D.向NH4HCO3溶液中加入过量的NaOH溶液并加热:NH4++OH- NH3+H2O
5. 加入Al粉能够产生H2的溶液中,下列各组离子一定能够大量共存的是
A.Na+、NH4+、Cl- B. Na+、Fe2+、NO3-
C.Na+、S2O32-、Cl- D. Na+、SO42-、Cl-
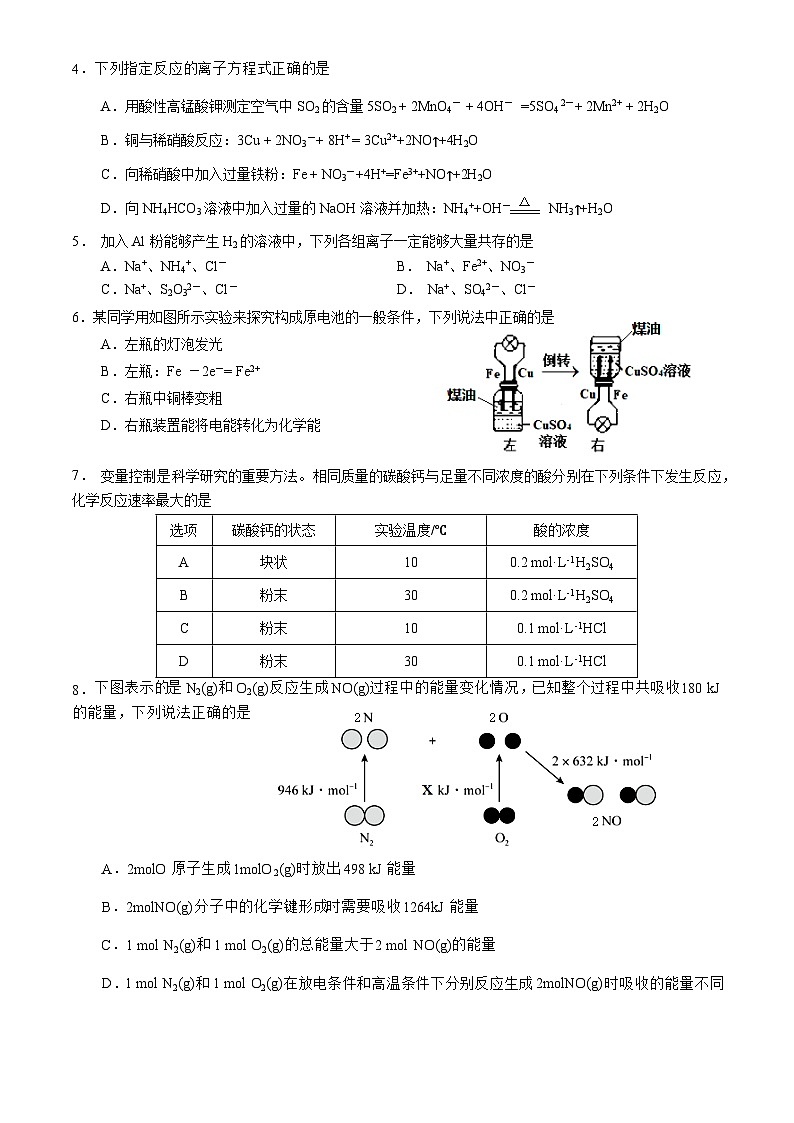
6.某同学用如图所示实验来探究构成原电池的一般条件,下列说法中正确的是
A.左瓶的灯泡发光
B.左瓶:Fe -2e-= Fe2+
C.右瓶中铜棒变粗
D.右瓶装置能将电能转化为化学能
7. 变量控制是科学研究的重要方法。相同质量的碳酸钙与足量不同浓度的酸分别在下列条件下发生反应,化学反应速率最大的是
选项 | 碳酸钙的状态 | 实验温度/℃ | 酸的浓度 |
A | 块状 | 10 | 0.2 mol·L-1H2SO4 |
B | 粉末 | 30 | 0.2 mol·L-1H2SO4 |
C | 粉末 | 10 | 0.1 mol·L-1HCl |
D | 粉末 | 30 | 0.1 mol·L-1HCl |
8.下图表示的是N2(g)和O2(g)反应生成NO(g)过程中的能量变化情况,已知整个过程中共吸收180 kJ的能量,下列说法正确的是
A.2molO原子生成1molO2(g)时放出498 kJ能量
B.2molNO(g)分子中的化学键形成时需要吸收1264kJ能量
C.1 mol N2(g)和1 mol O2(g)的总能量大于2 mol NO(g)的能量
D.1 mol N2(g)和1 mol O2(g)在放电条件和高温条件下分别反应生成2molNO(g)时吸收的能量不同
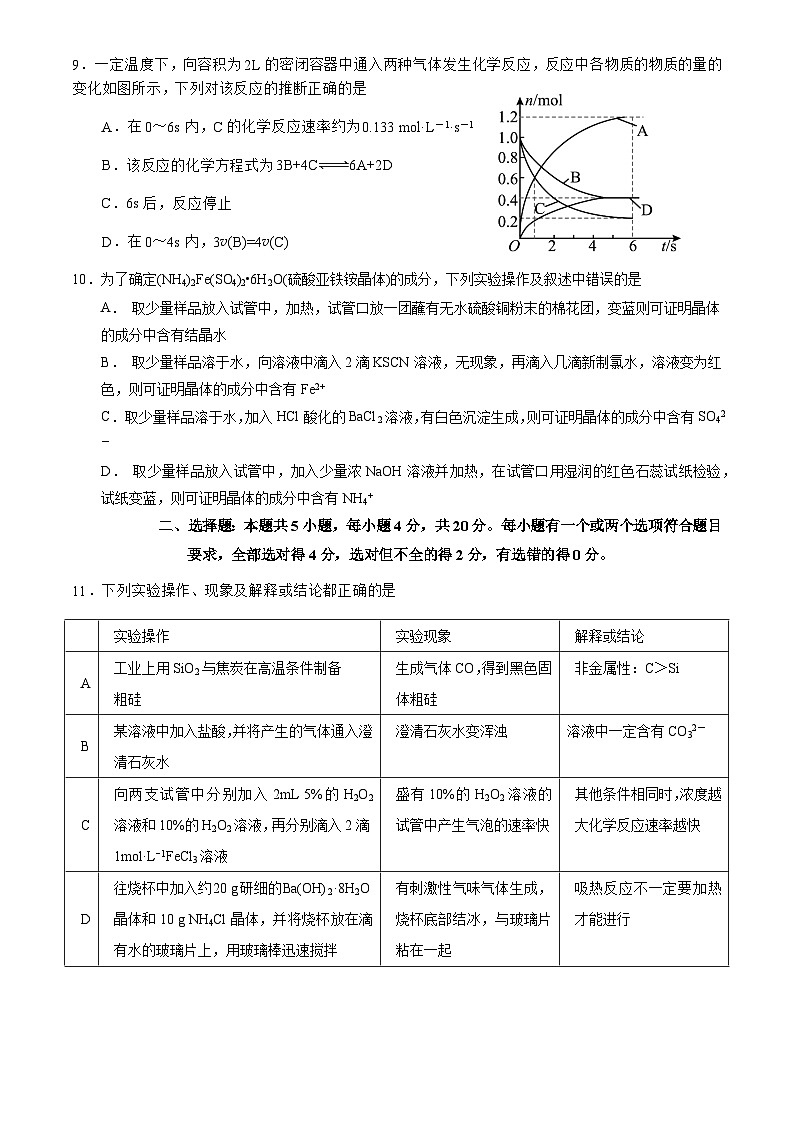
9.一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量的变化如图所示,下列对该反应的推断正确的是
A.在0~6s内,C的化学反应速率约为0.133 mol·L-1·s-1
B.该反应的化学方程式为3B+4C6A+2D
C.6s后,反应停止
D.在0~4s内,3v(B)=4v(C)
10.为了确定(NH4)2Fe(SO4)2•6H2O(硫酸亚铁铵晶体)的成分,下列实验操作及叙述中错误的是
A. 取少量样品放入试管中,加热,试管口放一团蘸有无水硫酸铜粉末的棉花团,变蓝则可证明晶体的成分中含有结晶水
B. 取少量样品溶于水,向溶液中滴入2滴KSCN溶液,无现象,再滴入几滴新制氯水,溶液变为红色,则可证明晶体的成分中含有Fe2+
C. 取少量样品溶于水,加入HCl酸化的BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42-
D. 取少量样品放入试管中,加入少量浓NaOH溶液并加热,在试管口用湿润的红色石蕊试纸检验,试纸变蓝,则可证明晶体的成分中含有NH4+
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.下列实验操作、现象及解释或结论都正确的是
| 实验操作 | 实验现象 | 解释或结论 |
A | 工业上用SiO2与焦炭在高温条件制备 粗硅 | 生成气体CO,得到黑色固体粗硅 | 非金属性:C>Si |
B | 某溶液中加入盐酸,并将产生的气体通入澄清石灰水 | 澄清石灰水变浑浊 | 溶液中一定含有CO32- |
C | 向两支试管中分别加入2mL 5%的H2O2 溶液和10%的H2O2溶液,再分别滴入2滴1mol·L−1FeCl3溶液 | 盛有10%的H2O2溶液的试管中产生气泡的速率快 | 其他条件相同时,浓度越大化学反应速率越快 |
D | 往烧杯中加入约20 g研细的Ba(OH)2·8H2O晶体和10 g NH4Cl晶体,并将烧杯放在滴有水的玻璃片上,用玻璃棒迅速搅拌 | 有刺激性气味气体生成,烧杯底部结冰,与玻璃片粘在一起 | 吸热反应不一定要加热才能进行 |
12.实验室制备下列气体所选试剂、制备装置及收集方法均正确是
| 气体 | 试剂 | 制备装置 | 收集方法 |
A | NH3 | NH4Cl | a | d |
B | NO | Cu + 稀硝酸 | b | e |
C | NO2 | Fe + 浓硝酸 | b | e |
D | SO2 | Cu + 浓硫酸 | b | c |
13.从元素化合价和物质类别两个角度学习、研究物质的性质,是一种行之有效的方法。如图是硫、氮两元素的价类二维图。下列说法错误的是
A. P为无色气体遇空气变红棕色
B. 欲制备Na2S2O3(硫代硫酸钠),从氧化还原反应角度分析,可以选择Na2SO3+S
C. Fe与R的浓溶液在加热条件下可以反应生成Q
D. X与Cu在加热条件下可以生成CuS
14.原电池原理在污染处理方面有重要应用。微生物脱盐池的a极上加入了呼吸细菌,工作时可将工业废
水中的有机污染物转化为CO2,其工作原理如图所示。下列说法正确的是
A.工作时,a极发生氧化反应
B.工作时,电流从a极流向b极
C.M为阳离子交换膜,N为阴离子交换膜,脱盐室最终
可得到淡盐水
D.若b极上消耗标准状况下11.2 L气体,通过N膜的
离子的物质的量为2 mol
15.向27.2 g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5 L,固体物质完全反应,得到标准状况下8.96 L NO和NO2的混合气体及Cu(NO3)2。在所得溶液中加入1.0 mol·L−1的NaOH溶液1.0 L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2 g。下列有关说法错误的是
A.产生的NO2的体积为6.72 L B.Cu、Cu2O与硝酸反应后剩余HNO3为0.2 mol
C.Cu与Cu2O的物质的量之比为2:1 D.硝酸的物质的量浓度为2.4 mol∙L-1
第Ⅱ卷 非选择题(共60分)
三、非选择题:本题共5小题,共60分
16.研究化学反应的快慢和限度具有十分重要的意义,已知:反应aA(g) + bB(g) cC(g),某温度下,在2L的密闭容器中投入一定量的A和B,两种气体的物质的量浓度随时间变化的曲线如图所示。
(1)经测定,前4s内v(C) = 0.05 mol·L-1·s-1,4s时容器内C的物质的量为 ,则该反应的化学方程式为 。
(2)该反应达到化学反应限度时,A的转化率为___________。
(3)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,反应相同时间后,测得三个容器中的化学反应速率分别为:
甲:v(A)=0.3 mol·L-1·s-1;
乙:v(B)=0.2 mol·L-1·s-1;
丙:v(C)=0.6 mol·L-1·min-1,
则甲、乙、丙三个容器中化学反应速率由快到慢的顺序为 (用甲、乙、丙表示)。
(4)下列条件的改变能减小上述反应的反应速率的是___________。
①保持体积不变,充入He
②保持压强不变,充入He
③降低温度
④增大C的浓度
(5)下列叙述能说明该反应达到化学平衡状态的是___________。
①混合气体的总质量不随时间变化而变化
②单位时间内每消耗3 mol A,同时生成1 mol B
③3v(A)正=v(B)逆
④混合气体的密度不随时间变化而变化
⑤A物质的物质的量分数不随时间变化而变化
17.电池是人类生产和生活中的重要能量来源,根据原电池原理,人们研制出了性能各异的化学电池。
(1)生活中利用原电池原理生产了各种各样的电池,下列有关电池的叙述正确的是______(填字母)。
A.锌锰电池工作一段时间后碳棒会变细
B.氢氧燃料电池先将化学能转变为热能,再将热能转化为电能
C.太阳能电池将太阳能直接转化为电能
D.铅蓄电池正极是PbO2,负极是Pb
(2)下图(a)装置中,Al片上看到的现象为 ,(b)装置中Al片上发生反应的电极反应式为_______。
(3)某电池装置下图(c),工作一段时间后,左边ZnSO4的浓度 (填“变大”、“变小”或“不变”,下同),右边电极质量 。
(4)航天技术上使用的氢氧燃料电池具有高能,轻便和不污染环境等优点。上图(d)所示的电池总反应式为:2H2 + O2 = 2H2O,工作一段时间后,A电极附近碱性减弱,请回答下列问题。
①A电极的名称为___________(填正极或负极)。
②当消耗H2的体积为33.6L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的数目为___________。
18. “建设生态文明是中华民族永续发展的千年大计”。控制和治理NOx、SO2是解决光化学烟雾、减少酸
雨、提高空气质量的有效途径,对构建生态文明有着极为重要的意义。
I. 用下图装置可以制取氨气并探究其性质,按下列装置(部分夹持装置已略去)进行实验。
(1)氨气的发生装置选择 (填装置的字母符号),则其化学反应方程式为
(2)装置D中观察到的现象为
(3)用H装置做氨气喷泉实验时,氨气的进气口为 (填“M”或“N”),请写出引发喷泉的简单操作
II. 工业上制取硝酸铵的流程如图所示,请回答下列问题:
(1)设备II中,每有1mol NO生成转移电子数目为 。
(2)设备IV中的尾气主要为NO。NH3催化还原氮氧化物(SCR技术是目前应用最广泛的烟气氮氧化物脱除技术,反应原理下图所示:
SCR催化化反器中NH3还原NO的程式为
19.某化学兴趣小组在实验室中利用下图装置制备SO2并进行相关性质的探究。回答下列问题:
Ⅰ. A与B相连时
(1)滴加浓硫酸之前,先通一段时间的N2,目的是_______。
(2)装置A中反应的化学方程式是 。
装置①中发生反应的化学方程式为 。
(3)通入足量SO2后②中仍无明显现象,将其分成甲、乙两份,甲中加入氯水,乙中加入氨水,均产生白色沉淀。产生沉淀的化学式是:甲_______,乙_______。
Ⅱ. A与C相连时,可用来探究碳、硅元素的非金属性的相对强弱。装置⑤的作用为 ,能说明碳元素的非金属性比硅元素非金属性强的实验现象是 。
20.用硫酸渣(主要成分为Fe2O3、SiO2)制备铁基颜料铁黄(FeOOH)的一种工艺流程如图。
已知:“还原”时,发生反应FeS2+14Fe3++8H2O=2SO42-+15Fe2++16H+;FeS2与H2SO4、NaOH不反应。回答下列有关问题。
(1)“酸溶”时,为了加快反应速率可以采取的措施 (写出一点即可)。
(2)“还原”时,氧化产物与还原产物质的物质的量之比为 。
(3)“过滤I”所得滤液中存在的阳离子主要有 ,滤渣I的成分为SiO2、FeS2,为了从滤渣I
中回收FeS2循环利用,可采取的操作方法为 ,发生反应的离子方程式为 。
(4)“沉降、氧化”时,每生成1 mol铁黄(FeOOH)消耗标准状况下O2的体积为 L。
山东省济宁市邹城市2023-2024学年高一上学期11月期中考试化学试题含答案: 这是一份山东省济宁市邹城市2023-2024学年高一上学期11月期中考试化学试题含答案,共9页。试卷主要包含了下列离子方程式书写正确的是,下列各种微粒中只具有氧化性的是,下列做法符合实验室要求的是等内容,欢迎下载使用。
山东省济宁邹城市名校2023-2024学年高一上学期10月月考化学试题(Word版含答案): 这是一份山东省济宁邹城市名校2023-2024学年高一上学期10月月考化学试题(Word版含答案),共9页。试卷主要包含了下列说法中正确的是,现有下列 10 种物质等内容,欢迎下载使用。
山东省济宁市兖州区2022-2023学年高一下学期期中考试化学试题(Word版含答案): 这是一份山东省济宁市兖州区2022-2023学年高一下学期期中考试化学试题(Word版含答案),共12页。试卷主要包含了04等内容,欢迎下载使用。












