
浙教版科学八年级下册 质量守恒实验探究与化学计算 开学测试
展开浙教版八下开学考——质量守恒实验探究与化学计算
1.1783年,拉瓦锡利用如图装置探究水的组成:往A杯中滴加少量的水,水通过灼热的铁管时发生汽化,水蒸气与灼热的铁反应,生成了一种黑色固体(Fe3O4)和“可燃空气”,将气体通过放在冷水中的铜管,在B装置中收集到纯净的可燃空气。最终,拉瓦锡证明了水是由两种元素组成的。
(1)将气体通过放在冷水中的铜管,目的是除去___________。
(2)将B装置收集到的可燃空气在氧气中点燃,生成了水,可燃空气的名称是___________。
(3)若该实验中生成的黑色固体质量为m1,可燃空气的质量为m2,可燃空气完全燃烧生成水的质量为m3,如果水是由“氧元素”和“可燃空气元素”组成的,则m1、m2、m3三者应满足的关系是___________。
2.某同学以高锰酸钾为原料制取氧气。
(1)用如图方法检查装置的气密性,使劲握住试管,却仍观察不到导管口有气泡冒出。若此装置气密性良好,为顺利完成该装置的气密性检查,提出一条合理的建议
____________________________________________________________________________________。
(2)清洗试管时,试管中的固体物质溅落在衣服上,留下了黑点,用彩漂液(主要成分是过氧化氢)清洗,黑点处迅速产生气泡,请用化学方程式表示气泡产生的原因________________________________。
- 材料一:1673年,玻义耳曾经做过一个实验:在密闭的曲颈瓶中加热金属时,得到了金属灰,冷却后打开容器,称量金属灰的质量,发现与原来金属相比质量增加了。
材料二:1703年,施塔尔提出“燃素学说”,其主要观点有:①燃素是组成物体的一种成分,一般条件下被禁锢在可燃物中;②燃素在可燃物燃烧时会分离出来,且燃素可穿透一切物质。
材料三:1756年,罗蒙诺索夫重做了玻义耳的实验。他将金属铅装入容器后密封、称量。然后把容器放到大火上加热,银白色的金属变成了灰黄色,待容器冷却后再次称量,发现容器的总质量没有发生变化。罗蒙诺索夫对此的解释是:“容器里原来有一定量的空气,且容器中的空气质量减少多少,金属灰的质量就比金属增加多少,在化学变化中物质的质量是守恒的。”后来,拉瓦锡等科学家经过大量的定量实验,推翻了“燃素学说”,质量守恒定律得到公认。
(1)由“燃素学说”可知,物质燃烧后质量应该减少。请根据所学知识写出一个可以推翻“燃素学说”的事实:______________________________________________。
(2)罗蒙诺索夫重做了玻义耳的实验是基于金属加热后,增加的质量并非来自燃素而是来自___________的假设。
(3)对比材料一和材料三,玻义耳错过了发现质量守恒定律的一个重要原因是___________。
(4)质量守恒定律的发现过程,给我们的启示是___________。
A.分析问题应该全面、严谨
B.实验的成功与否,取决于药品的选择
C.定量方法是科学研究的重要方法
D.科学研究既要尊重事实,也要勇于创新
4.1674年,英国化学家约翰·梅为测定空气中的氧气含量开展如下实验(装置如图甲)。
I.将一根长度等于玻璃钟罩最宽部分直径的铁棒横放在钟罩里,把装有稀硝酸的陶罐通过铁钩挂在铁棒上,用绳索将小铁块悬挂在陶罐的正上方(铁块的升降通过在钟罩外拉动或放松绳索来实现)。
Ⅱ.调整水槽中初始水位如图乙,再使铁块浸入稀硝酸中,观察到铁块表面迅速产生大量气泡,钟罩内水面下降。[稀硝酸有强氧化性,能与铁发生如下反应:4HNO3+Fe=Fe(NO3)3+NO↑+2H2O]
IⅢ.当水位降至接近钟罩口时(如图丙),立即取出铁块,以防气体外逸。
IV.等待一段时间后,水面稳定在如图丁的位置。(一氧化氮会与氧气等物质发生如下反应:4NO+3O2+2 ? =4HNO3)
分析与评价:
(1)步骤IV中的“?”处应填__________。
(2)从图丙到图丁过程中,钟罩内水位上升的原因是________________________________________
_________________________________________________________。(忽略温度变化的影响)
(3)小科重复了上述实验,虽实验时装置气密性良好,且钟罩内液面上方气体体积均能精确测量(即测定气体体积的误差忽略不计),但经多次实验测定,发现每次测得空气的含氧量都小于1/5,原因是
_____________________________________________________________________________________。
三、计算题
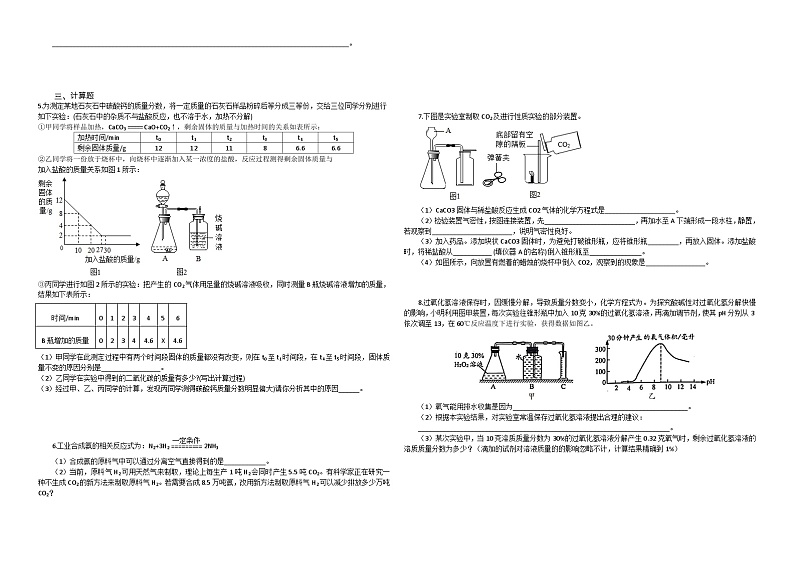
5.为测定某地石灰石中碳酸钙的质量分数,将一定质量的石灰石样品粉碎后等分成三等份,交给三位同学分别进行如下实验:(石灰石中的杂质不与盐酸反应,也不溶于水,加热不分解)
①甲同学将样品加热,CaCO3CaO+CO2↑,剩余固体的质量与加热时间的关系如表所示:
加热时间/min | t0 | t1 | t2 | t3 | t4 | t5 |
剩余固体质量/g | 12 | 12 | 11 | 8 | 6.6 | 6.6 |
②乙同学将一份放于烧杯中,向烧杯中逐渐加入某一浓度的盐酸,反应过程测得剩余固体质量与
加入盐酸的质量关系如图1所示:
③丙同学进行如图2所示的实验:把产生的CO2气体用足量的烧碱溶液吸收,同时测量B瓶烧碱溶液增加的质量,结果如下表所示:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
B瓶增加的质量 | 0 | 2 | 3 | 4 | 4.6 | X | 4.6 |
(1)甲同学在此测定过程中有两个时间段固体的质量都没有改变,则在t0至t1时间段,在t4至t5时间段,固体质量不变的原因分别是_________________。
(2)乙同学在实验中得到的二氧化碳的质量有多少?(写出计算过程)
(3)经过甲、乙、丙同学的计算,发现丙同学测得碳酸钙质量分数明显偏大)请你分析其中的原因______。
6.工业合成氨的相关反应式为:N2+3H22NH3
(1)合成氨的原料气中可以通过分离空气直接得到的是____________。
(2)当前,原料气H2可用天然气来制取,理论上每生产1吨H2会同时产生5.5吨CO2。有科学家正在研究一种不生成CO2的新方法来制取原料气H2。若需要合成8.5万吨氨,改用新方法制取原料气H2可以减少排放多少万吨CO2?
7.下图是实验室制取CO2及进行性质实验的部分装置。
(1)CaCO3固体与稀盐酸反应生成CO2气体的化学方程式是____________________。
(2)检验装置气密性,按图连接装置,先__________________________,再加水至 A下端形成一段水柱,静置,若观察到_______________________,说明气密性良好。
(3)加入药品。添加块状CaCO3固体时,为避免打破锥形瓶,应将锥形瓶_________,再放入固体。添加盐酸时,将稀盐酸从___________ (填仪器A的名称)倒入锥形瓶至_______________。
(4)如图所示,向放置有燃着的蜡烛的烧杯中倒入CO2,观察到的现象是_________________。
8.过氧化氢溶液保存时,因缓慢分解,导致质量分数变小,化学方程式为。为探究酸碱性对过氧化氢分解快慢的影响,小明利用图甲装置,每次实验往锥形瓶中加入10克30%的过氧化氢溶液,再滴加调节剂,使其pH分别从3依次调至13,在60℃反应温度下进行实验,获得数据如图乙。
(1)氧气能用排水收集是因为__________________________________________________。
(2)根据本实验结果,对实验室常温保存过氧化氢溶液提出合理的建议:
________________________________________________________________________。
(3)某次实验中,当10克溶质质量分数为30%的过氧化氢溶液分解产生0.32克氧气时,剩余过氧化氢溶液的溶质质量分数为多少?(滴加的试剂对溶液质量的的影响忽略不计,计算结果精确到1%)
浙教版八下开学考——质量守恒实验探究与化学计算答案
1.1783年,拉瓦锡利用如图装置探究水的组成:往A杯中滴加少量的水,水通过灼热的铁管时发生汽化,水蒸气与灼热的铁反应,生成了一种黑色固体(Fe3O4)和“可燃空气”,将气体通过放在冷水中的铜管,在B装置中收集到纯净的可燃空气。最终,拉瓦锡证明了水是由两种元素组成的。
(1)将气体通过放在冷水中的铜管,目的是除去___________。
(2)将B装置收集到的可燃空气在氧气中点燃,生成了水,可燃空气的名称是___________。
(3)若该实验中生成的黑色固体质量为m1,可燃空气的质量为m2,可燃空气完全燃烧生成水的质量为m3,如果水是由“氧元素”和“可燃空气元素”组成的,则m1、m2、m3三者应满足的关系是___________。
1、(1)水蒸气 (2)氢气 (3)8/29m1+m2=m3
2.某同学以高锰酸钾为原料制取氧气。
(1)用如图方法检查装置的气密性,使劲握住试管,却仍观察不到导管口有气泡冒出。若此装置气密性良好,为顺利完成该装置的气密性检查,提出一条合理的建议
_______________________________________。
(2)清洗试管时,试管中的固体物质溅落在衣服上,留下了黑点,用彩漂液(主要成分是过氧化氢)清洗,黑点处迅速产生气泡,请用化学方程式表示气泡产生的原因
________________________________________。
【答案及解析】(1)双手分开握,增大与试管的接触面积(或“用冷水冲刷试管外壁,擦干后再重新握”,“用酒精灯微热”,“把试管浸入热水”等合理答案均可)
(2)2H2O2 2H2O+O2↑
3. 材料一:1673年,玻义耳曾经做过一个实验:在密闭的曲颈瓶中加热金属时,得到了金属灰,冷却后打开容器,称量金属灰的质量,发现与原来金属相比质量增加了。
材料二:1703年,施塔尔提出“燃素学说”,其主要观点有:①燃素是组成物体的一种成分,一般条件下被禁锢在可燃物中;②燃素在可燃物燃烧时会分离出来,且燃素可穿透一切物质。
材料三:1756年,罗蒙诺索夫重做了玻义耳的实验。他将金属铅装入容器后密封、称量。然后把容器放到大火上加热,银白色的金属变成了灰黄色,待容器冷却后再次称量,发现容器的总质量没有发生变化。罗蒙诺索夫对此的解释是:“容器里原来有一定量的空气,且容器中的空气质量减少多少,金属灰的质量就比金属增加多少,在化学变化中物质的质量是守恒的。”后来,拉瓦锡等科学家经过大量的定量实验,推翻了“燃素学说”,质量守恒定律得到公认。
(1)由“燃素学说”可知,物质燃烧后质量应该减少。请根据所学知识写出一个可以推翻“燃素学说”的事实:______________________________________________。
(2)罗蒙诺索夫重做了玻义耳的实验是基于金属加热后,增加的质量并非来自燃素而是来自___________的假设。
(3)对比材料一和材料三,玻义耳错过了发现质量守恒定律的一个重要原因是___________。
(4)质量守恒定律的发现过程,给我们的启示是___________。
A.分析问题应该全面、严谨
B.实验的成功与否,取决于药品的选择
C.定量方法是科学研究的重要方法
D.科学研究既要尊重事实,也要勇于创新
【答案】(1)镁条、铁丝等在氧气中燃烧后质量会增加
(2)空气
(3)打开容器前没有称量容器的总质量
(4)ACD
【解析】(1)可以推翻“燃素学说”的事实:镁条、铁丝等燃烧后固体质量增大。
(2)罗蒙诺索夫重做了玻义耳的实验是基于在金属加热后,增加的质量并非来自燃素而是来自空气的假设。
(3)对比材料一和材料三,玻义耳错过了发现质量守恒定律的一个重要原因是打开容器前没有称量容器的总质量。
(4)质量守恒定律的发现过程,给我们的启示是:分析问题应该全面、严谨,定量方法是科学研究的重要方法,科学研究既要尊重事实,也要勇于创新。
4.1674年,英国化学家约翰·梅为测定空气中的氧气含量开展如下实验(装置如图甲)。
I.将一根长度等于玻璃钟罩最宽部分直径的铁棒横放在钟罩里,把装有稀硝酸的陶罐通过铁钩挂在铁棒上,用绳索将小铁块悬挂在陶罐的正上方(铁块的升降通过在钟罩外拉动或放松绳索来实现)。
Ⅱ.调整水槽中初始水位如图乙,再使铁块浸入稀硝酸中,观察到铁块表面迅速产生大量气泡,钟罩内水面下降。[稀硝酸有强氧化性,能与铁发生如下反应:4HNO3+Fe=Fe(NO3)3+NO↑+2H2O]
IⅢ.当水位降至接近钟罩口时(如图丙),立即取出铁块,以防气体外逸。
IV.等待一段时间后,水面稳定在如图丁的位置。(一氧化氮会与氧气等物质发生如下反应:4NO+3O2+2 ? =4HNO3)
分析与评价:
(1)步骤IV中的“?”处应填__________。
(2)从图丙到图丁过程中,钟罩内水位上升的原因是________________________________________
_________________________________________________________。(忽略温度变化的影响)
(3)小科重复了上述实验,虽实验时装置气密性良好,且钟罩内液面上方气体体积均能精确测量(即测定气体体积的误差忽略不计),但经多次实验测定,发现每次测得空气的含氧量都小于1/5,原因是
_____________________________________________________________________________________。
【答案】(1):H2O;
(2)一氧化氮与氧气参加了反应,气体减少,使钟罩内气压减小,外界大气压大于钟罩内气压,水被压入钟罩,导致钟罩内水位上升;
(3)实验中较难控制铁与稀硝酸反应生成的一氧化氮恰好与装置中的氧气完全反应,无论是一氧化氮过量还是氧气过量,均会使测定的结果偏小。
【解析】(1)根据质量守恒定律可知:步骤Ⅳ中的“?”处应填水;
(2)从图丙到图丁过程中,钟罩内水位上升的原因是:一氧化氮与氧气参加了反应,气体减少,使钟罩内气压减小,外界大气压大于钟罩内气压,水被压入钟罩,导致钟罩内水位上升;
(3)测得空气的含氧量小于,原因是:实验中较难控制铁与稀硝酸反应生成的一氧化氮恰好与装置中的氧气完全反应,无论是一氧化氮过量还是氧气过量,均会使测定的结果偏小。
三、计算题
5.为测定某地石灰石中碳酸钙的质量分数,将一定质量的石灰石样品粉碎后等分成三等份,交给三位同学分别进行如下实验:(石灰石中的杂质不与盐酸反应,也不溶于水,加热不分解)
①甲同学将样品加热,CaCO3CaO+CO2↑,剩余固体的质量与加热时间的关系如表所示:
加热时间/min | t0 | t1 | t2 | t3 | t4 | t5 |
剩余固体质量/g | 12 | 12 | 11 | 8 | 6.6 | 6.6 |
②乙同学将一份放于烧杯中,向烧杯中逐渐加入某一浓度的盐酸,反应过程测得剩余固体质量与
加入盐酸的质量关系如图1所示:
③丙同学进行如图2所示的实验:把产生的CO2气体用足量的烧碱溶液吸收,同时测量B瓶烧碱溶液增加的质量,结果如下表所示:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
B瓶增加的质量 | 0 | 2 | 3 | 4 | 4.6 | X | 4.6 |
(1)甲同学在此测定过程中有两个时间段固体的质量都没有改变,则在t0至t1时间段,在t4至t5时间段,固体质量不变的原因分别是_________________。
(2)乙同学在实验中得到的二氧化碳的质量有多少?(写出计算过程)
(3)经过甲、乙、丙同学的计算,发现丙同学测得碳酸钙质量分数明显偏大)请你分析其中的原因______。
5.(1)在t0至t1时间段,未达到碳酸钙分解所需温度;在t4至t5时间段,碳酸钙已分解完全
(2)据图可知,参与反应的碳酸钙的质量为:12g-2g=10g
设反应得到的二氧化碳的质量为x。
CaCO3+2HCl=CaCl2 +H2O+CO2 ↑
100 44
10g x
=
x=4.4g
答:乙同学在实验中得到的二氧化碳的质量是4.4克。
(3)盐酸(水蒸气)挥发出的HCl被B瓶中的烧碱溶液吸收
6.工业合成氨的相关反应式为:N2+3H22NH3
(1)合成氨的原料气中可以通过分离空气直接得到的是____________。
(2)当前,原料气H2可用天然气来制取,理论上每生产1吨H2会同时产生5.5吨CO2。有科学家正在研究一种不生成CO2的新方法来制取原料气H2。若需要合成8.5万吨氨,改用新方法制取原料气H2可以减少排放多少万吨CO2?
【答案】(1)N2(或氮气) (2)8.25万吨
【解析】(1)氮气是空气中含量最多的气体,正常的空气中是没有氢气的,因此可以从空气中分离出氮气;
(2)设需要H2的质量为m。
N2+3H22NH3
6 34
m 8.5万吨
m=1.5万吨少排放CO2的质量=1.5×5.5万吨=8.25万吨
7.下图是实验室制取CO2及进行性质实验的部分装置。
(1)CaCO3固体与稀盐酸反应生成CO2气体的化学方程式是____________________。
(2)检验装置气密性,按图连接装置,先__________________________,再加水至 A下端形成一段水柱,静置,若观察到_______________________,说明气密性良好。
(3)加入药品。添加块状CaCO3固体时,为避免打破锥形瓶,应将锥形瓶_________,再放入固体。添加盐酸时,将稀盐酸从___________ (填仪器A的名称)倒入锥形瓶至_______________。
(4)如图所示,向放置有燃着的蜡烛的烧杯中倒入CO2,观察到的现象是_________________。
(1) CaCO3 +2HCl=CaCl2 +H2O+CO2↑
(2)夹紧止水夹 长颈漏斗内水柱不下降
(3)横放;长颈漏斗;浸没长颈漏斗下端口
(4)蜡烛一开始持续燃烧,之后熄灭
8.过氧化氢溶液保存时,因缓慢分解,导致质量分数变小,化学方程式为。为探究酸碱性对过氧化氢分解快慢的影响,小明利用图甲装置,每次实验往锥形瓶中加入10克30%的过氧化氢溶液,再滴加调节剂,使其pH分别从3依次调至13,在60℃反应温度下进行实验,获得数据如图乙。
(1)氧气能用排水收集是因为__________________________________________________。
(2)根据本实验结果,对实验室常温保存过氧化氢溶液提出合理的建议:
________________________________________________________________________。
(3)某次实验中,当10克溶质质量分数为30%的过氧化氢溶液分解产生0.32克氧气时,剩余过氧化氢溶液的溶质质量分数为多少?(滴加的试剂对溶液质量的的影响忽略不计,计算结果精确到1%)
【答案及解析】(1)氧气不易溶于水
(2)在pH约为3~5的酸性条件下保存
(3)设当产生氧气0.32g时,消耗掉的过氧化氢的质量为x。
2H2O2====2H2O+O2↑
68 32
x 0.32g
解得:x=0.68g
剩余过氧化氢的质量m剩=10g×30%-0.68g=2.32g,剩余溶液的质量为10g-0.32g=9.68g
剩余过氧化氢溶液的溶质质量分数H2O2%=≈24%
答:剩余过氧化氢溶液的溶质质量分数为24%
9.如图表示,某国际空间站的水气整合系统中,其中“氧气生成系统”能电解水,产生氢气和氧气;“萨巴蒂尔系统”能把氢气和航天员呼吸产生的二氧化碳反应生成液态水和甲烷气体;液态水及时循环利用,甲烷排放到外太空。
(1)图中化学式标注的物质,属于氧化物的有__________________________。
(2)以这个航天员平均一天要消耗约0.8千克的氧气,请计算一个航天员在空间站30天,理论上至少需要给该水气整合系统补充多少质量的水?(已知二氧化碳足量)
【答案】(1)H2O和CO2
(2)13.5kg
【解析】(1)略;
(2)①设要生成0.8kg的氧气,需要消耗水的质量为x,同时产生氢气的质量为y。
2H2O 2H2↑+O2↑
36 4 32
x y 0.8kg
由解得,x=0.9kg,y=0.1kg
②设与CO2反应了0.1kg的H2,可以生成水的质量为z。
4H2+CO2 CH4+2H2O
8 36
0.1kg z
由,解得z=0.45kg
故一个月需要补充水的质量为:(0.9kg-0.45kg)×30=13.5kg。
浙教版科学八年级下册 期末专项复习 精选实验探究题(含答案): 这是一份浙教版科学八年级下册 期末专项复习 精选实验探究题(含答案),共19页。试卷主要包含了77lg/L,空气的密度为l,设计合理方案等内容,欢迎下载使用。
浙教版中考科学尖子生培优训练化学实验探究篇1(含答案): 这是一份浙教版中考科学尖子生培优训练化学实验探究篇1(含答案),共5页。试卷主要包含了根据以下装置图,回答下列问题,对生命活动具有重大意义的有机物等内容,欢迎下载使用。
浙教版中考科学尖子生培优训练化学实验探究篇3(含答案): 这是一份浙教版中考科学尖子生培优训练化学实验探究篇3(含答案),共9页。试卷主要包含了 鉴别失去标签的五瓶溶液等内容,欢迎下载使用。












