
北京市海淀区、门头沟区、房山区高考化学三年(2020-2022)模拟题分类汇编-10氮族元素及其化合
展开北京市海淀区、门头沟区、房山区高考化学三年(2020-2022)模拟题分类汇编-10氮族元素及其化合物
一、单选题
1.(北京市海淀区2020届高三二模化学试题)实验室药品必须按规定存放,下列对错误存放后出现现象的解释合理的是
A.石灰水敞口存放,出现白色固体:
B.浓硝酸存放于无色细口瓶中,颜色变黄:
C.酸化的硫酸亚铁溶液长时间存放,溶液变黄:
D.将氨水和浓盐酸存放在同一个药品柜中,柜壁出现白色固体:
2.(北京市海淀区2021届高三一模化学试题)用如图装置(夹持装置已略去)进行制备及性质实验。下列说法不正确的是
A.甲中制备利用了的分解反应
B.乙中的集气瓶内a导管短、b导管长
C.若将丙中的换成苯,仍能防止倒吸
D.向收集好的中通入少量,可能观察到白烟
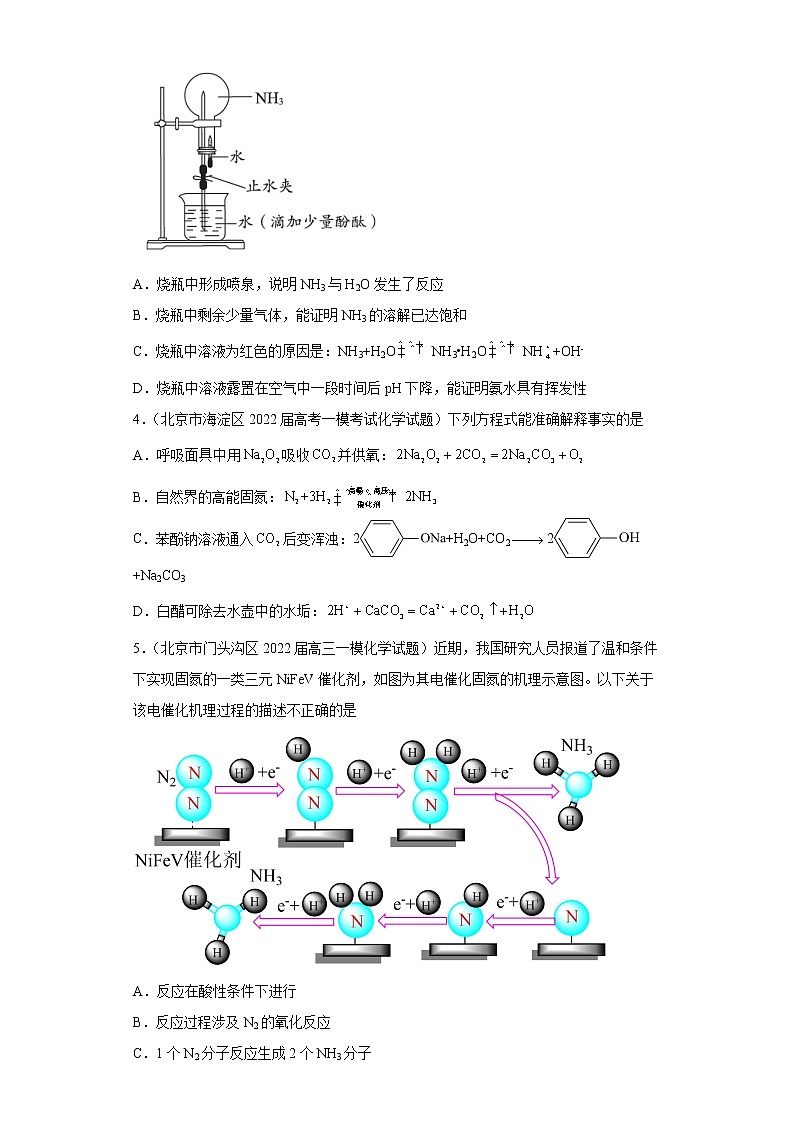
3.(北京市海淀区2022届高三二模化学试题)用圆底烧瓶收集NH3后进行喷泉实验。对实验现象的分析正确的是
A.烧瓶中形成喷泉,说明NH3与H2O发生了反应
B.烧瓶中剩余少量气体,能证明NH3的溶解已达饱和
C.烧瓶中溶液为红色的原因是:NH3+H2ONH3•H2ONH+OH-
D.烧瓶中溶液露置在空气中一段时间后pH下降,能证明氨水具有挥发性
4.(北京市海淀区2022届高考一模考试化学试题)下列方程式能准确解释事实的是
A.呼吸面具中用吸收并供氧:
B.自然界的高能固氮:
C.苯酚钠溶液通入后变浑浊:2+H2O+CO22+Na2CO3
D.白醋可除去水壶中的水垢:
5.(北京市门头沟区2022届高三一模化学试题)近期,我国研究人员报道了温和条件下实现固氮的一类三元NiFeV催化剂,如图为其电催化固氮的机理示意图。以下关于该电催化机理过程的描述不正确的是
A.反应在酸性条件下进行
B.反应过程涉及N2的氧化反应
C.1个N2分子反应生成2个NH3分子
D.反应分多步进行,中间产物为几种不同的氮氢化物
6.(北京市门头沟区2021届高三一模化学试题)某小组同学探究金属钠与不同盐溶液的反应,进行了如下实验。下列说法不正确的是
查阅资料:溶液中离子的浓度越大,离子所带的电荷数目越多,溶液的离子强度越大。
实验 | 序号 | 盐溶液 | 现象 |
① | 溶液 | 与钠与水的反应类似,钠熔化成一个闪亮的小球,四处游动,速度较快,没有火花出现 | |
② | 2.0mol/LKCl溶液 | 反应比①剧烈,没有火花出现 | |
③ | 溶液 | 反应比②剧烈,没有火花出现 | |
④ | 溶液 | 反应瞬间即有黄色火花出现,并立即发生剧烈燃烧 |
A.由①②可知,随着KCl溶液浓度的增加,钠与KCl溶液的反应速率明显加快
B.实验③比②反应更加剧烈,一定是因为钠与碳酸根离子发生氧化还原反应
C.实验④中出现燃烧现象,是因为钠与水、与硝酸根离子发生了氧化还原反应,导致反应放出大量的热,达到了钠的着火点
D.推测若采用溶液进行上述实验,也会出现钠的燃烧现象
7.(北京市门头沟区2020届高三3月综合练习化学试题)中国科学院科研团队研究表明,在常温常压和可见光下,基于LDH(一种固体催化剂)合成NH3的原理示意图。下列说法不正确的是
A.该过程中H2O被还原生成氧气
B.该过程中涉及极性键和非极性键的断裂与生成
C.基于合成NH3的过程属于氮的固定
D.该过程的化学方程式为:2N2+6H2O4NH3+3O2
8.(北京市房山区2020届高三第二次模拟考试化学试题)已知:用Pt—Rh合金催化氧化NH3制NO,其反应的微观模型及含氮生成物产率随反应温度的变化曲线分别如所示:
下列说法中,不正确的是
A.400℃时,生成的产物只有N2、NO
B.800℃时,反应的化学方程式是:4NH3+5O24NO+6H2O
C.Pt—Rh合金可有效提升NH3催化氧化反应的速率
D.800℃以上,发生了反应:2NOO2(g)+N2(g) ΔH>0
9.(北京市房山区2020届高三(一模)学业水平等级性考试化学试题)下列实验中的颜色变化,与氧化还原反应无关的是
A.将 SO2 通入到滴有酚酞的烧碱溶液中红色褪去
B.AgNO3 溶液滴入氯水中产生白色沉淀,随后淡黄绿色褪去
C.H2C2O4 溶液滴入 KMnO4 酸性溶液中产生气泡,随后紫色褪去
D.NO 遇空气变为红棕色
10.(北京市顺义区2020届高三第一次统练化学试题)下列实验方案中,能达到相应实验目的的是
选项 | A | B | C | D |
目的 | 验证锌与硫酸铜反应过程中有电子转移 | 探究亚硝酸钠的氧化性 | 实验室制备乙酸乙酯 | 实验室制备氨气 |
实验方案 |
A.A B.B C.C D.D
11.(北京市房山区2021届高三下学期一模化学试题)下列实验装置不能达成实验目的的是
A | B | C | D |
实验室制取蒸馏水 | 实验室制取氨气 | 除去CO2中的少量HCl | 收集NO2 |
A.A B.B C.C D.D
12.(2018年全国普通高等学校招生统一考试化学(北京卷))下列实验中的颜色变化,与氧化还原反应无关的是
| A | B | C | D |
实验 | NaOH溶液滴入FeSO4溶液中 | 石蕊溶液滴入氯水中 | Na2S溶液滴入AgCl浊液中 | 热铜丝插入稀硝酸中 |
现象 | 产生白色沉淀,随后变为红褐色 | 溶液变红,随后迅速褪色 | 沉淀由白色逐渐变为黑色 | 产生无色气体,随后变为红棕色 |
A.A B.B C.C D.D
13.(北京市房山区2021-2022学年高三下学期一模化学试题)下列实验能达到对应目的的是
A.配制一定物质的量浓度的溶液 | B.实验室制取氨气 | C.含氨气的尾气吸收 | D.除去中的少量 |
A.A B.B C.C D.D
二、实验题
14.(北京市门头沟区2021届高三一模化学试题)亚硝酸钠外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。某学习小组制备亚硝酸钠并探究其性质。
实验一:制备
该小组查阅资料:,
制备装置如图所示(夹持装置略去):
(1)写出A中发生反应的离子方程式___________。
(2)甲同学检查完装置气密性良好后进行实验,发现制得的中混有较多的杂质。为了提高了的纯度,可采取的改进措施是___________。
(3)装置D可将剩余的NO氧化成,发生反应的离子方程式为___________。
实验二:以亚硝酸钠溶液为研究对象,探究的性质。
实验 | 实验编号 | 试剂 | 现象 | |
滴管 | 试管 | |||
① | 1%酚酞溶液 | 溶液 | 溶液变为浅红色,微热后红色加深 | |
② | 溶液 | 溶液 | 开始无明显变化,向溶液中滴加稀硫酸后紫色褪去 | |
③ | 溶液 | 溶液 | 无明显变化 | |
④ | 溶液 | 溶液 | 溶液变黄后迅速变为棕色,再滴加KSCN溶液变红 | |
资料:在溶液中呈棕色。
(4)结合化学用语解释实验①“微热后红色加深”的原因___________。
(5)解释实验④中“溶液变黄后迅速变为棕色”的原因___________(用离子方程式表示)。
(6)取一支试管,加入少量实验④中的棕色溶液,加热,有无色气体逸出,在近试管口处变为红棕色,溶液中有红褐色沉淀生成。解释上述现象产生的原因___________。
参考答案:
1.D
【详解】A. 石灰水敞口存放,吸收空气中的二氧化碳,出现白色固体:,A错误;
B. 浓硝酸存放于无色细口瓶中,颜色变黄,是因为浓硝酸见光易分解产生的二氧化氮气体溶解在其中,方程式为:,B错误;
C. 酸化的硫酸亚铁溶液长时间存放,溶液变黄,是因为亚铁离子被氧化生成铁离子:,C错误;
D. 将氨水和浓盐酸存放在同一个药品柜中,氨水与浓盐酸反应生成氯化铵,出现白色固体:,D正确;
故答案为:D。
2.C
【分析】该实验制备氨气利用碱石灰溶于水放热使氨水分解,氨气极易溶于水,不宜用排水法收集,其密度比空气小,可用排空气法收集。
【详解】A.甲为氨气发生装置,利用氨水受热分解制备氨气的原理,故A正确;
B.氨气密度比空气小,利用向下排空气法,故a短b长,故B正确;
C.因为苯的密度比水小,苯在上层,故将四氯化碳换成苯后不能防止倒吸,故C错误;
D.氨气与氯气反应可以生成氯化铵固体,产生大量白烟,故D正确;
故选C。
3.C
【详解】A.烧瓶中形成喷泉,不一定是因为NH3与H2O发生了反应引起的,还有可能是因为NH3极易溶于水造成的,故不能说明NH3与H2O发生了反应,A错误;
B.烧瓶中剩余少量气体可能是空气,来源于实验中的某个操作,比如图中止水夹下方的玻璃管未插入水中时会有空气进入,故烧瓶中剩余少量气体不能说明NH3的溶解达到饱和,B错误;
C.烧瓶中溶液变为红色,说明溶液呈碱性,原因为NH3+H2ONH3•H2O+OH-,C正确;
D.烧瓶中溶液露置在空气中一段时间后pH下降,不一定是因为氨水的挥发性,还可能是因为吸收了空气中的CO2,故烧瓶中溶液pH下降,不能说明氨水具有挥发性,D错误;
故选C。
4.A
【详解】A.根据反应可知呼吸面具中用吸收并供氧,A符合题意;
B.是人工固氮,自然界的高能固氮是N2和O2在高温或放电条件下反应生成NO的过程,B不合题意;
C.由于酸性:H2CO3>苯酚>,故苯酚钠溶液通入后变浑浊的反应原理为:+H2O+CO2+NaHCO3,C不合题意;
D.由于醋酸是弱酸,则白醋可除去水壶中的水垢的离子方程式为:,D不合题意;
故答案为:A。
5.B
【详解】A.在表面氢化机理中,第一步是H+得到电子发生还原反应,反应在酸性条件下进行,故A正确;
B.由图示可以推出,N2得到电子变为NH3,反应过程涉及了N2的电化学还原,故B错误;
C.由图示可以推出,1个N2分子上图反应生成1个NH3分子,下图生成1个NH3分子,总共生成2个NH3分子,故C正确;
D.间产物有N2H4、NH、NH2,反应分多步进行,中间产物为N2H4、NH、NH2几种不同的氮氢化物,故D正确;
故选:B。
6.B
【详解】A.②中KCl溶液浓度大于①中的,说明随着KCl溶液浓度的增加,钠与KCl溶液的反应速率明显加快,故A正确;
B.实验③比②反应更加剧烈,可能是钾离子浓度变化的结果,故B错误;
C.对比实验②④,两溶液中钾离子浓度相同,阴离子不同,前者为氯离子,后者为硝酸根离子,实验④中出现燃烧现象,可能是因为钠与水、硝酸根离子发生了氧化还原反应,导致反应放出大量的热,达到了钠的着火点,故C正确;
D.推测若采用溶液进行上述实验,溶液有强氧化性,也会出现钠的燃烧现象,故D正确;
答案选B。
7.A
【详解】A. 该过程中O元素化合价升高,则H2O被氧化生成氧气,故A错误;
B. 发生反应为2N2+6H2O=4NH3+3O2,反应反应物和生成中均存在单质和化合物,即涉及极性键与非极性键的断裂与生成,故B正确;
C. 根据题意和图示知氮元素由游离态转变为化合态,属于氮的固定,故C正确;
D. 根据题意和图示,可以写出该反应的化学方程式为:2N2+6H2O4NH3+3O2,故D正确;
故选A。
【点睛】解决此题的关键是明确氮的固定的定义,元素的单质形态属于游离态,化合物形式属于化合态。
8.A
【详解】A.根据图①②,结合原子守恒知,400℃时,生成的产物有N2、NO和水,故A错误;
B.800℃时,生成的含有N元素的产物主要是NO,接近100%,所以发生反应的化学方程式为4NH3+5O24NO+6H2O,故B正确;
C.400℃~800℃间,N2的产率下降、NO产率上升,且NO产率接近100%,Pt—Rh合金作催化剂可加快反应速率,所以Pt-Rh合金有效提升NH3催化氧化反应的速率,故C正确;
D.800℃以上,N2的产率上升、NO的产率下降,说明发生了反应2NOO2(g)+N2(g),升高温度氮气产率增加,说明该反应的正反应是吸热反应,△H>0,故D正确;
故答案选A。
【点睛】本题考查产率随温度变化曲线,为高频考点,侧重考查学生图像分析、判断能力,解题关键在于明确曲线变化原因。
9.A
【详解】A.2NaOH+SO2=Na2SO3+H2O,该反应中各元素化合价不变,没有电子转移,所以不属于氧化还原反应,A符合题意;
B.氯水中存在,Cl2+H2OH++Cl-+HClO,AgNO3 溶液滴入氯水中产生AgCl白色沉淀,Ag++Cl-=AgCl↓,c(Cl-)减小,平衡正向移动,淡黄绿色褪去,该过程中Cl元素的化合价由0价升高为+1价,又降低为-1价,与氧化还原反应有关,B不符合题意;
C.2MnO4−+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,该反应中,Mn元素化合价由+7价变为+2价、C元素化合价由+3价变为+4价,有电子转移,属于氧化还原反应,C不符合题意;
D.2NO+O2=2NO2,该反应中,N元素的化合价由+2价升高为+4价,O元素的化合价由0价降低为-2价,有电子转移,属于氧化还原反应,D不符合题意;故答案为:A。
10.A
【详解】A.构成原电池,Zn为负极,Cu为正极,有电子转移,故A正确;
B.亚硝酸钠可被高锰酸钾氧化,该反应中亚硝酸钠作还原剂,故B错误;
C.制备乙酸乙酯还需要浓硫酸作催化剂、吸水剂,图中装置不能制备,故C错误;
D.氯化铵分解后,在试管口化合生成氯化铵,应选铵盐与碱加热制备,故D错误;
故选:A。
11.C
【详解】A.通过加热自来水,经过冷却后得到蒸馏水,图中蒸馏装置可以用于实验室制取蒸馏水,故A正确;
B.氨气的密度比空气小,试管口略向下倾斜,图中装置可以用于实验室制取氨气,故B正确;
C.二氧化碳和碳酸钠溶液反应生成碳酸氢钠,故应该用饱和碳酸氢钠溶液来进行除杂,故C错误;
D.二氧化氮比空气密度大,故导管应该长进短出,故D正确;
答案选C。
12.C
【详解】分析:A项,白色沉淀变为红褐色沉淀时的反应为4Fe(OH)2+O2+2H2O=4Fe(OH)3;B项,红色褪色是HClO表现强氧化性;C项,白色沉淀变为黑色时的反应为2AgCl+Na2S=Ag2S+2NaCl;D项,气体由无色变为红棕色时的反应为2NO+O2=2NO2。
详解:A项,NaOH溶液滴入FeSO4溶液中产生白色Fe(OH)2沉淀,白色沉淀变为红褐色沉淀时的反应为4Fe(OH)2+O2+2H2O=4Fe(OH)3,该反应前后元素化合价有升降,为氧化还原反应;B项,氯水中存在反应Cl2+H2OHCl+HClO,由于氯水呈酸性,石蕊溶液滴入后溶液先变红,红色褪色是HClO表现强氧化性,与有色物质发生氧化还原反应;C项,白色沉淀变为黑色时的反应为2AgCl+Na2S=Ag2S+2NaCl,反应前后元素化合价不变,不是氧化还原反应;D项,Cu与稀HNO3反应生成Cu(NO3)2、NO气体和H2O,气体由无色变为红棕色时的反应为2NO+O2=2NO2,反应前后元素化合价有升降,为氧化还原反应;与氧化还原反应无关的是C项,答案选C。
点睛:本题考查氧化还原反应的判断,分析颜色变化的原因、理解氧化还原反应的特征是解题的关键。
13.C
【详解】A.配制溶液时,应先在烧杯中溶解,再转移,而不能直接在容量瓶中溶解,A错误;
B.实验室加热氯化铵和氢氧化钙(熟石灰)的混合物制取氨气,若直接加热氯化铵生成的HCl和NH3在试管口又重新反应生成NH4Cl,不能达到实验目的,B错误;
C.氨气极易溶于水,尾气处理时需要防倒吸,装置能达到实验目的,C正确;
D.CO2和HCl均会和NaOH反应,可用饱和的NaHCO3溶液除去中的少量,D错误;
答案选C。
14. 在A装置左边,从左到右持续通入氮气 亚硝酸钠属于强碱弱酸盐,在溶液中亚硝酸根水解呈碱性,加入酚酞溶液溶液变红,加热使水解平衡向右移动,碱性增强,溶液颜色加深 加热使分解生成NO,NO在试管口遇空气被氧化为红棕色二氧化氮,溶液中铁离子水解平衡右移生成氢氧化铁红褐色沉淀
【分析】A装置为制备NO气体,其反应为,B装置为干燥装置,除去NO中的水蒸气;C为反应装置;D为尾气处理装置。
【详解】(1)A中的反应为,其中单质和氧化物不能拆,写成离子方程式为,故填;
(2)装置内若含有较多的空气,会将NO氧化成,故可在反应前将装置内的空气排尽,改进措施为:在A装置左边,从左到右持续通入氮气,故填在A装置左边,从左到右持续通入氮气;
(3)NO与酸性高锰酸钾的反应为氧化还原反应,其反应为,故填;
(4)亚硝酸钠属于强碱弱酸盐,在溶液中亚硝酸根水解呈碱性,加入酚酞溶液溶液变红,加热使水解平衡向右移动,碱性增强,溶液颜色加深,故填亚硝酸钠属于强碱弱酸盐,在溶液中亚硝酸根水解呈碱性,加入酚酞溶液溶液变红,加热使水解平衡向右移动,碱性增强,溶液颜色加深;
(5)亚硝酸亚在酸性条件下具有氧化性,向酸性硫酸亚铁溶液中加入亚硝酸钠,亚铁离子被氧化成铁离子,溶液变黄,生成的NO与亚铁离子结合成,使溶液呈棕色,其反应为,故填;
(6)加热使分解生成NO,NO在试管口遇空气被氧化为红棕色二氧化氮,溶液中铁离子水解平衡右移生成氢氧化铁红褐色沉淀,故填加热使分解生成NO,NO在试管口遇空气被氧化为红棕色二氧化氮,溶液中铁离子水解平衡右移生成氢氧化铁红褐色沉淀。
【点睛】变黄后生成红棕色是生成,而不是铁离子水解。
北京市高考化学三年(2020-2022)模拟题分类汇编25氮族元素及其化合物(2): 这是一份北京市高考化学三年(2020-2022)模拟题分类汇编25氮族元素及其化合物(2),共33页。试卷主要包含了单选题,工业流程题,填空题,实验题等内容,欢迎下载使用。
北京市高考化学三年(2020-2022)模拟题分类汇编24氮族元素及其化合物(1): 这是一份北京市高考化学三年(2020-2022)模拟题分类汇编24氮族元素及其化合物(1),共28页。试卷主要包含了单选题,实验题等内容,欢迎下载使用。
上海高考化学三年(2020-2022)模拟题分类汇编-28氮族元素及其化合物(2): 这是一份上海高考化学三年(2020-2022)模拟题分类汇编-28氮族元素及其化合物(2),共22页。试卷主要包含了单选题,多选题,实验题等内容,欢迎下载使用。