
2023武汉部分重点中学高一下学期期中联考试题化学含答案
展开武汉市部分重点中学2022—2023学年度下学期期中联考
高一化学试卷
命题学校:武汉市第十一中学 命题教师:王延青 审题教师:李修华 刘大波
考试时间:2023年4月19日上午11:00—12:15 试卷满分:100分
答题时可能用到的相对原子质量:H—1 C—12 S—32 N—14 O—16
一、选择题(本题包括15小题,每小题3分,共45分。每小题只有一个选项符合题意)
1.下列关于材料的说法中正确的是( )
A.化学家采用玛瑙研钵摩擦固体反应物进行无溶剂合成,玛瑙的主要成分是硅酸盐
B.航天员手臂“延长器”所用材料为碳纤维,碳纤维与石墨烯互为同位素
C.制造5G芯片的氮化铝晶圆属于新型无机非金属材料
D.光导纤维主要成分为,可用作太阳能电池
2.下列叙述正确的是( )
A.电能是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源
B.水力发电是将化学能直接转化为电能的过程
C.火力发电是将燃料中的化学能直接转化为电能的过程
D.可以寻找特殊物质,用于开发廉价能源,使水分解而获取二次能源氢气,同时释放能量
3.下列关于电池说法正确的是( )
A.原电池的负极材料一定都参与反应
B.在锌锰干电池使用过程中,电子由锌筒流出
C.燃料电池工作时阳离子移向负极
D.碱性锌锰电池的正极材料是锌
4.在给定条件下,下列选项中所示的物质间转化均能实现的是( )
A.
B.
C.
D.
5.下列有关化学反应限度的说法正确的是( )
A.所有化学反应的限度都相同
B.可以通过延长反应时间来改变化学反应的限度
C.当一个化学反应在一定条件下达到限度时,反应即停止
D.一定条件下,炼铁高炉尾气中CO含量不随高炉高度改变而改变,是因为有关反应达到了限度
6.下列有关浓硫酸的叙述正确的是( )
A.常温下不能用铁、铝容器盛放浓硫酸,因为铁、铝是活泼金属
B.浓硫酸具有强氧化性,、、CO具有还原性,故浓硫酸不能干燥、、CO
C.将浓硫酸滴入蔗糖中,产生的气体可使足量的澄清石灰水变浑浊
D.向盛有固体NaCl的试管中加入浓硫酸并加热,管口出现白雾,证明酸性:
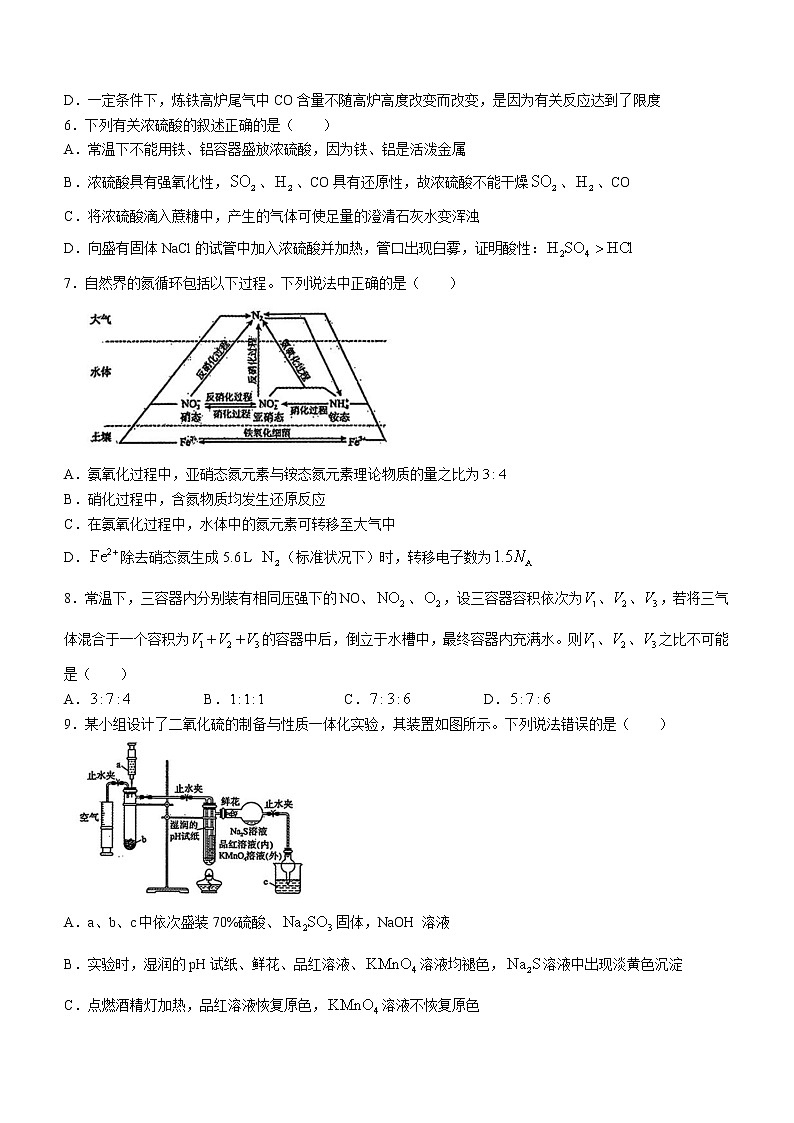
7.自然界的氮循环包括以下过程。下列说法中正确的是( )
A.氨氧化过程中,亚硝态氮元素与铵态氮元素理论物质的量之比为
B.硝化过程中,含氮物质均发生还原反应
C.在氨氧化过程中,水体中的氮元素可转移至大气中
D.除去硝态氮生成5.6 L (标准状况下)时,转移电子数为
8.常温下,三容器内分别装有相同压强下的NO、、,设三容器容积依次为、、,若将三气体混合于一个容积为的容器中后,倒立于水槽中,最终容器内充满水。则、、之比不可能是( )
A. B. C. D.
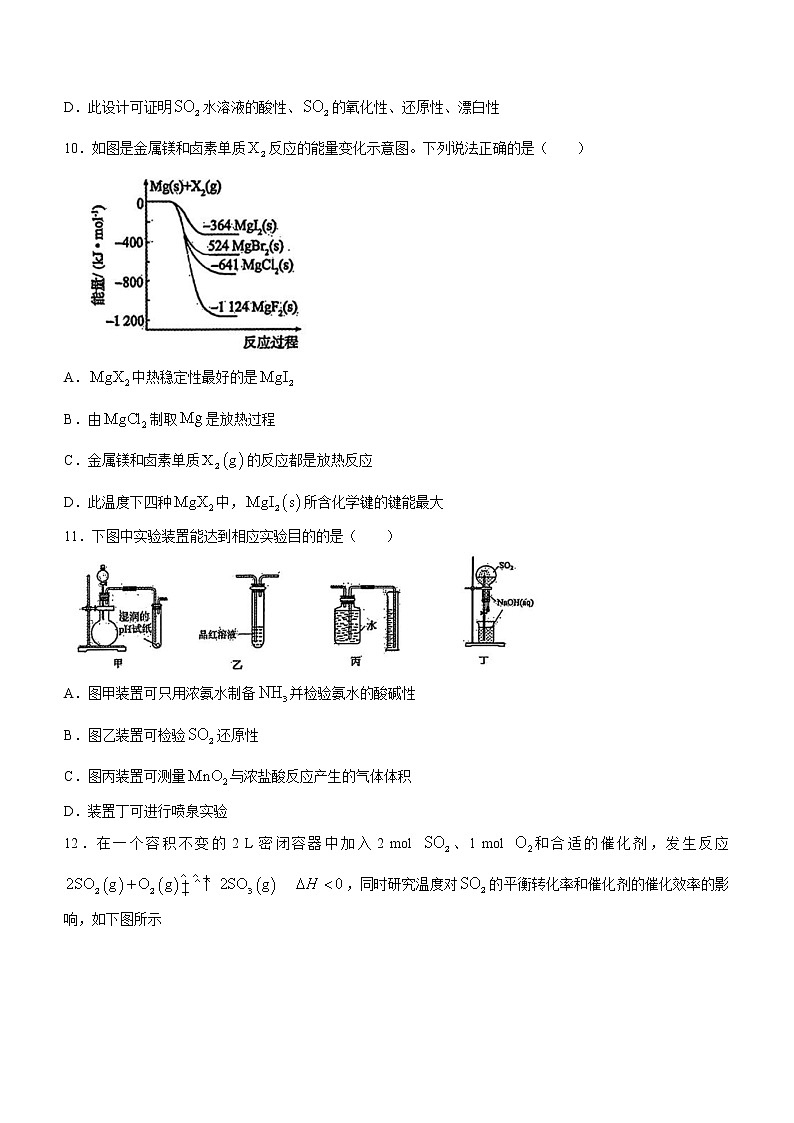
9.某小组设计了二氧化硫的制备与性质一体化实验,其装置如图所示。下列说法错误的是( )
A.a、b、c中依次盛装70%硫酸、固体,NaOH 溶液
B.实验时,湿润的pH试纸、鲜花、品红溶液、溶液均褪色,溶液中出现淡黄色沉淀
C.点燃酒精灯加热,品红溶液恢复原色,溶液不恢复原色
D.此设计可证明水溶液的酸性、的氧化性、还原性、漂白性
10.如图是金属镁和卤素单质反应的能量变化示意图。下列说法正确的是( )
A.中热稳定性最好的是
B.由制取是放热过程
C.金属镁和卤素单质的反应都是放热反应
D.此温度下四种中,所含化学键的键能最大
11.下图中实验装置能达到相应实验目的的是( )
A.图甲装置可只用浓氨水制备并检验氨水的酸碱性
B.图乙装置可检验还原性
C.图丙装置可测量与浓盐酸反应产生的气体体积
D.装置丁可进行喷泉实验
12.在一个容积不变的2 L密闭容器中加入2 mol 、1 mol 和合适的催化剂,发生反应 ,同时研究温度对的平衡转化率和催化剂的催化效率的影响,如下图所示
已知:的平衡转化率。下列说法正确的是( )
A.合成的最佳条件是加催化剂,温度为250 ℃
B.450 ℃时,若5 min达到平衡,则
C.升高温度,正反应速率增大,逆反应速率域小
D.的生成速率:一定大于
13.某同学进行如下实验
装置 | 操作 | 现象 |
将盛有浓硝酸的烧杯A放入盛有淀粉KI溶液的烧杯C中,然后将铜片放入烧杯A后,立即用烧杯B罩住 | 烧杯A液体上方立即出现大量红棕色气体;一段时间后,红棕色气体消失,烧杯A和C中的液体都变成蓝色 |
下列说法合理的是( )
A.烧杯A中开始阶段发生反应:
B.红棕色气体消失只与和烧杯C中的KI发生反应有关
C.若将铜片换成铁片,则C中的液体也可能变蓝
D.烧杯C中溶液变蓝与生成有关
14.某白色固体样品,可能含有、、、、中的一种或几种。对该样品进行如下实验:
①取少量固体加入足量水中,固体部分溶解;
②取①中滤液做焰色试验,透过蓝色钴玻璃未观察到紫色;
③取①中滤渣,向其中加入足量的盐酸,产生气泡,固体部分溶解。
下列说法错误的是( )
A.固体粉末中一定不含
B.固体粉末中一定含有和
C.取①中滤液,加入硝酸酸化的溶液,若未产生白色沉淀,则样品中无
D.为进一步确定原样品组成,可以向③未溶解的固体中加入KOH溶液
15.恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应:,测得不同起始浓度和催化剂表面积下氨浓度随时间的变化如下表所示,下列说法错误的是( )
编号 | 时间/min
表面积 | 0 | 20 | 40 | 60 | 80 |
① | 2.40 | 2.00 | 1.60 | 1.20 | 0.80 | |
② | 1.20 | 0.80 | 0.40 |
| ||
③ | 2.40 | 1.60 | 0.80 | 0.40 | 0.40 |
A.实验②中60 min时,
B.由实验数据可知,相同条件下,增加的浓度,速率不一定增大
C.实验③达到平衡后,的体积分数约为22.7%
D.相同条件下,增加催化剂的表面积,反应速率增大
二、非选择题(本大题55分,共4题。)
16.(13分)以含硅废石(主要成分为、含少量、等杂质)为原料,工业上有以下两种制备高纯硅的工艺。
(1)是玻璃的主要成分之一,保存氢氧化钠溶液的玻璃试剂瓶应用橡胶塞的原因是______________________________(用离子方程式表示)。
(2)酸浸所得的浸液中含有的金属离子是____________________。
(3)写出“还原”过程的化学方程式______________________________。当有1 mol C参与反应时,该反应转移的电子数是________。
(4)写出工艺Ⅱ在高温条件下制各纯硅这一步的化学方程式______________________________,工艺Ⅱ与工艺I相比,其优点___________________________________________________________________________。
(5)产品中硅的纯度可以利用Si与NaOH溶液反应产生氢气的体积进行计算,请写出化学方程式______________________________。
17.(14分)化学反应中的能量变化通常表现为热量变化,研究热量变化具有重要的意义。化学反应的反应热可通过实验测定,也可通过计算间接获得。
(1)下列变化属于吸热反应的是________(填序号)。
①液态水气化 ②胆矾加热变成白色粉末 ③浓硫酸稀释 ④氢气还原氧化铜 ⑤碳酸钙高温分解
⑥氢氧化钾和稀硫酸反应 ⑦灼热的木炭与的反应 ⑧晶体与晶体的反应 ⑨甲烷在空气中燃烧的反应
(2)在25 ℃、101 kPa下,23 g乙醇完全燃烧生成和被态水时放热638.4 kJ。则表示乙醇燃烧热的热化学方程式为______________________________。
Ⅰ.中和反应反应热的实验测定
(3)某化学兴趣小组要完成中和反应反应热的测定,实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、量筒2支、醋酸、 NaOH溶液,实验尚缺少的玻璃用品是_______________、_______________。
(4)在量热计中将100 mL 的醋酸溶液与100mL 的氢氧化钠溶液混合,温度从298.0 K升高到300.7 K,已知量热计的热容常数(各部件温度每升高1 K所需的热量)是,溶液密度均近似为,充分混合后溶液的比热容。求醋酸与氢氧化钠发生中和反应的反应热________。(小数点后保留1位数字)
(5)若用KOH代替NaOH,对测定结果________(填“有”或“无”)影响;若用盐酸代替醋酸做实验,则测定结果________(填“偏大”或“偏小”无影响)。
Ⅱ.通过计算间接获得反应热
(6)利用合成气(主要成分为CO、和)在催化剂作用下合成甲醇,发生的主要反应如下:
①
②
③ ,已知反应①中相关的化学键键能数据如下:
化学键 | |||||
436 | 343 | 1076 | 465 | 413 |
(已知结构式为)
由此计算________;已知,则________。
18.(14分)某小组欲测定与溶液反应的化学反应速率。所用试剂为10 mL 溶液和10 mL 溶液,所得数据如图所示。
(1)写出两溶液混合反应的离子方程式______________________________。
(2)由实验数据可得,该反应在0~4 min的化学反应速率为_______________。
该小组设计了3组实验探究影响化学反应速率的部分因素,具体情况如下表所示。
实验 编号 | 加入 溶液的体积 | 加入 溶液的体积 | 加入水的体积 | 反应温度 |
1 | 10 | 10 | 0 | 25 ℃ |
2 | 10 | 5 | a | 25 ℃ |
3 | 10 | 10 | 0 | 60 ℃ |
(3)表中________,通过实验1和实验3可探究________对化学反应速率的影响。
(4)某同学分析发现在反应过程中该反应的化学反应速率先增大后减小。针对此现象,该小组进一步通过测定随时间变化的曲线探究影响因素,具体如下表所示。(已知、对该反应速率无影响)
方案 | 假设 | 实验操作 |
Ⅰ | 该反应放热,使溶液温度升高,反应速率加快 | 向烧杯中加入10 mL 溶液和10 mL 溶液,插入温度计测量温度。 |
Ⅱ | _______________ | 取10 mL 溶液加入烧杯中,向其中加入少量NaCl固体,再加入10 mL 溶液 |
Ⅲ | 溶液酸性增强加快了化学反应速率 | 分别向2只烧杯中加入10 mL 溶液;向烧杯a中加入1 mL水,向烧杯b中加入1 mL 盐酸;再分别向2只烧杯中加入10 mL 溶液 |
①方案Ⅱ中的假设为________________________________________________________________________。
②已知方案Ⅰ的假设不成立,某同学从控制变量的角度思考,认为方案Ⅲ中实验操作设计不严谨,请进行改进:________________________________________________________________________。
③反应后期,化学反应速率变慢的原因是________________________________________________________。
19.(14分)中国将力争2030年前实现碳达峰、2060年前实现碳中和。二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳排放。回答下列问题:
Ⅰ.某温度下,二氧化碳加氢制甲醇的总反应为 ,将6 mol 和8 mol 充入2 L的恒温刚性密闭容器中,测得氢气物质的量随时间变化如图所示。
(1)下列说法不能表明该反应已经达到平衡状态的是________(填序号)。
A.
B.混合气体的平均相对分子质量不变
C.保持不变
D.压强保持不变
E.容器中浓度与浓度之比为
(2)a点正反应速率________(填大于、等于或小于)b点逆反应速率。
(3)平衡时的转化率为________。(小数点后保留一位数学)
Ⅱ.甲醇()是优质的清洁燃料,可制作碱性甲醇燃料电池,工作原理如下图所示;
(4)电极A为燃料电池的________(填“正”或“负”)极,该电极反应式为:____________________。
(5)当电路中通过1 mol电子时,在电极B附近消耗的体积为________ L(标准状况);电池工作一段时间后,电解质溶液的碱性________(填“增强”、“减弱”或“不变”)。
武汉市部分重点中学2022—2023学年度下学期期中联考
高一化学试卷参考答案
1-15 CABCD CCDBC DBDCA
16.(除标注外,每空2分,共13分)
(1)
(2)、、
(3) (1分)
(4) 没有使用有毒有害的,避免污染环境
(5)
17.(除标注外,每空2分,共14分)
(1)②④⑤⑦⑧
(2)
I.(3)玻璃搅拌器(1分) 温度计(1分)
(4)
(5)无(1分) 偏小(1分)
Ⅱ.(6)
18.(每空2分,共14分)
(1)
(2) (3)5 温度
(4)①生成的氯离子加快了反应速率
②将1 mL水改为1 mL NaCl或KCl
③随着化学反应的进行,体系中的各物质浓度都会逐渐降低,所以反应速率也会逐渐减慢
19.(每空2分,共14分)
Ⅰ.(1)AE (2)大于 (3)33.3%
Ⅱ.(4)负
(5)5.6 减弱
2023武汉部分重点中学高一下学期期末联考化学试题含答案: 这是一份2023武汉部分重点中学高一下学期期末联考化学试题含答案,共10页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
2023武汉部分重点中学高二下学期期中联考试题化学含答案: 这是一份2023武汉部分重点中学高二下学期期中联考试题化学含答案,文件包含湖北省武汉市部分重点中学2022-2023学年高二下学期期中联考化学试题docx、湖北省武汉市部分重点中学2022-2023学年高二下学期期中联考化学试题答案docx等2份试卷配套教学资源,其中试卷共11页, 欢迎下载使用。
2021武汉部分重点中学高一下学期期中联考化学试题PDF版含答案: 这是一份2021武汉部分重点中学高一下学期期中联考化学试题PDF版含答案,共7页。












