



人教版 (2019)选择性必修2第一节 原子结构精品习题ppt课件
展开学习目标 CONTENT
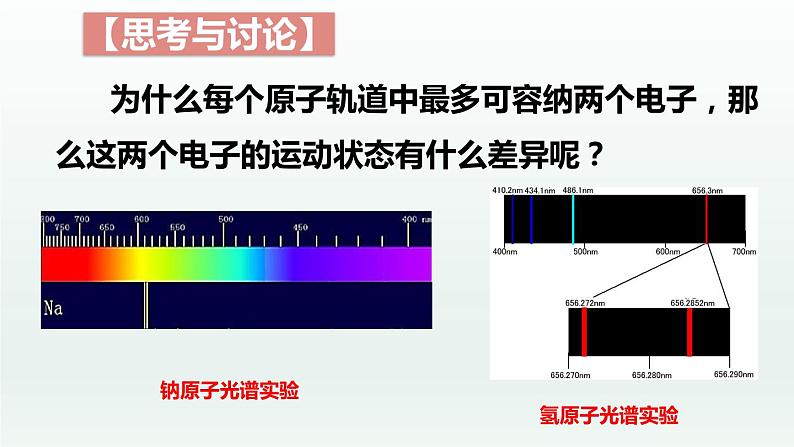
为什么每个原子轨道中最多可容纳两个电子,那么这两个电子的运动状态有什么差异呢?
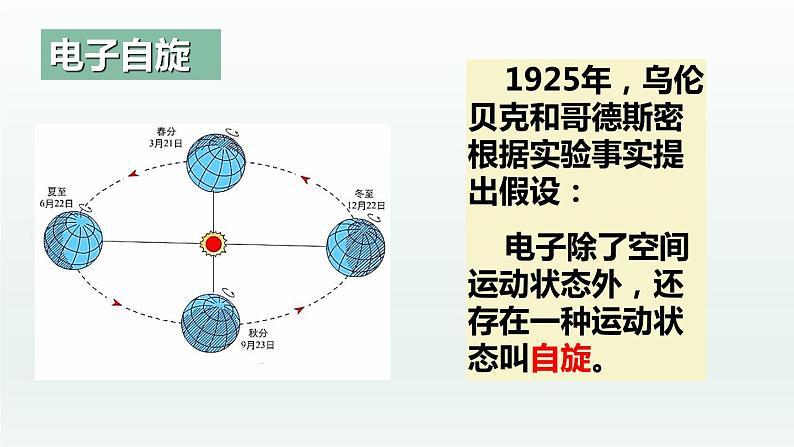
1925年,乌伦贝克和哥德斯密根据实验事实提出假设: 电子除了空间运动状态外,还存在一种运动状态叫自旋。
电子除空间运动状态外,还有一种状态叫做自旋。
电子自旋在空间有顺时针和逆时针两种取向,简称自旋相反,常用上下箭头( “↑”“↓” )表示自旋相反的电子。
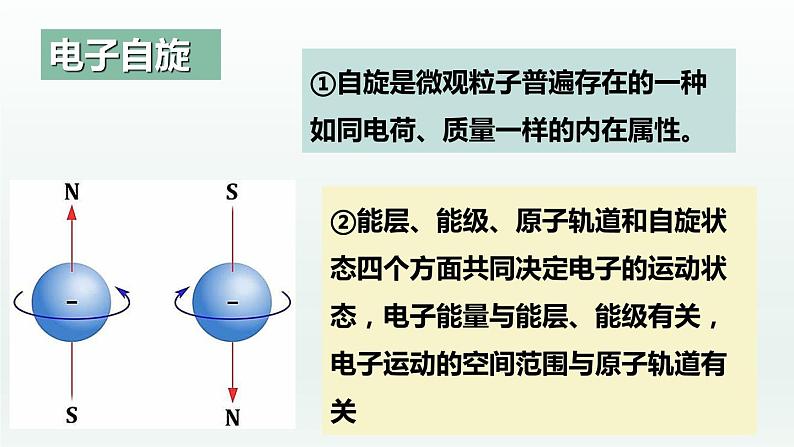
①自旋是微观粒子普遍存在的一种如同电荷、质量一样的内在属性。
②能层、能级、原子轨道和自旋状态四个方面共同决定电子的运动状态,电子能量与能层、能级有关,电子运动的空间范围与原子轨道有关
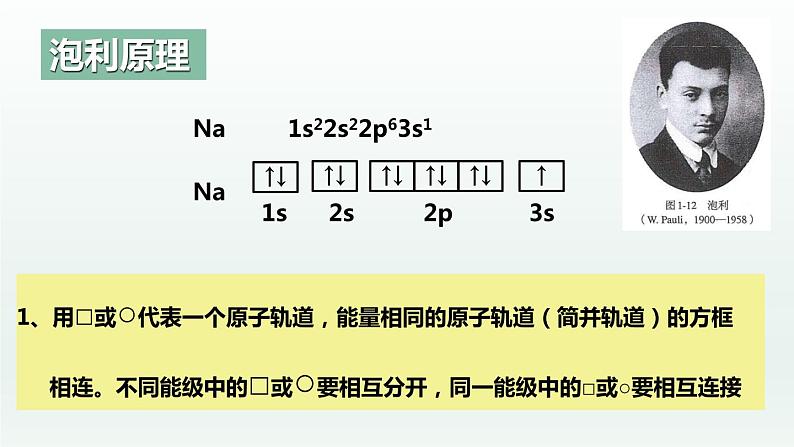
在一个原子轨道里,最多只能容纳2个电子,且它们的自旋相反。这个原理被称为泡利原理(也称泡利不相容原理)
(1)轨道表示式(又称电子排布图):表示电子排布的一种图式,如钠 的基态原子的轨道表示式如下:
1s22s22p63s1
1、用□或○代表一个原子轨道,能量相同的原子轨道(简并轨道)的方框 相连。不同能级中的□或○要相互分开,同一能级中的□或○要相互连接
4、箭头表示一种自旋状态的电子,一个箭头表示一个电子,↓↑”称电子 对 , “↓”或“↑”表示单电子,箭头同向,自旋平行,箭头相反,自 旋相反。
2、整个电子排布图中各能级的排列顺序要与相应的电子排布式一致
3、通常在方框下方或者上方标记能级符号
电子排布的轨道表示式
铝原子外层成对电子对的数目为6,有一个单电子。
1、请写出Li、Be、B的轨道表示式。
请写出基态碳原子可能的轨道表示式。
基态原子中,填入简并轨道的电子总是先单独分占,且自旋平行。
洪特规则不仅适用于基态原子,也适用于基态离子
洪特规则适用于电子填入简并轨道,并不适用于电子填入能量不同的轨道
洪特F.Hund, 1896—1997
全充满(p6,d10,f14)
全空时(p0,d0,f0 )
半充满(p3,d5,f7 )
对于能量相同的轨道(同一能级),当电子排布处于全满、半满、全空时比较稳定,整个体系的能量最低。
Cr:1s22s22p63s23p63d44s2
Cu:1s22s22p63s23p63d94s2
Cr:1s22s22p63s23p63d54s1
Cu:1s22s22p63s23p63d104s1
1. 下列轨道表示式中哪个是硼的基态原子?为什么?
2. 下列轨道表示式中哪个是氧的基态原子?为什么?
在构建基态原子时,电子尽可能地先占有能量低的轨道,然后进入能量高的轨道,使整个原子的能量处于最低状态
能级的能量高低顺序如构造原理所示(对于1~36号元素来说,应重点掌握和记忆“ ”这一顺序)。
1s→2s→2p→3s→3p→4s→3d→4p
在构建基态原子时,电子将尽可能占据能量最低的原子轨道,使整个原子的能量最低,这就是能量最低原理。
(1)最外层只有1个未成对电子的元素(2)最外层有2个未成对电子的元素(3)最外层有3个未成对电子的元素(4)核外电子排布中,未成对电子数最多的元素
ⅠA族(ns1:H、Li、Na、K); ⅢA族(ns2np1:B、Al、Ga);ⅦA族(ns2np5:F、Cl、Br); Cr(3d54s1)、Cu(3d104s1)。ⅣA族(ns2np2:C、Si、Ge); ⅥA族(ns2np4:O、S、Se)。ⅤA族(ns2np3:N、P、As)。Cr(3d54s1,共有6个未成对电子)。
基态原子核外电子排布规律
1.“各能级最多容纳的电子数,是该能级原子轨道数的二倍”,支 撑这一结论的理论是( ) A.构造原理 B.泡利原理 C.洪特规则 D.能量最低原理
2.某原子核外电子排布为ns2np7,它违背了( ) A.泡利原理 B.能量最低原理 C.洪特规则 D.洪特规则特例
3.下列关于硅原子的核外电子排布表示方法中,错误的是( )A.1s22s22p63s23p2 B.[Ne]3s23p2C. D.
高中化学人教版 (2019)选择性必修2第一节 原子结构集体备课课件ppt: 这是一份高中化学人教版 (2019)选择性必修2第一节 原子结构集体备课课件ppt,共16页。PPT课件主要包含了目标一泡利原理,电子自旋,s22s22p4,不要标记电子数,练习1,目标二洪特规则,思考与交流1,s22s22p2,s22s22p3,s22s22p5等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修2第一节 原子结构示范课ppt课件: 这是一份高中化学人教版 (2019)选择性必修2第一节 原子结构示范课ppt课件,共31页。PPT课件主要包含了s22s22p3,或Ar3d6,①⑤⑥,s23p3,洪特规则,d104s1等内容,欢迎下载使用。
人教版 (2019)选择性必修2第一节 原子结构教案配套ppt课件: 这是一份人教版 (2019)选择性必修2第一节 原子结构教案配套ppt课件,共44页。PPT课件主要包含了第一节原子结构等内容,欢迎下载使用。













