
06 考向6 电解质溶液的图像分析——对数曲线(附答案解析)-备战高考化学大二轮专题突破系列(全国通用)
展开电解质溶液的图像分析——对数曲线
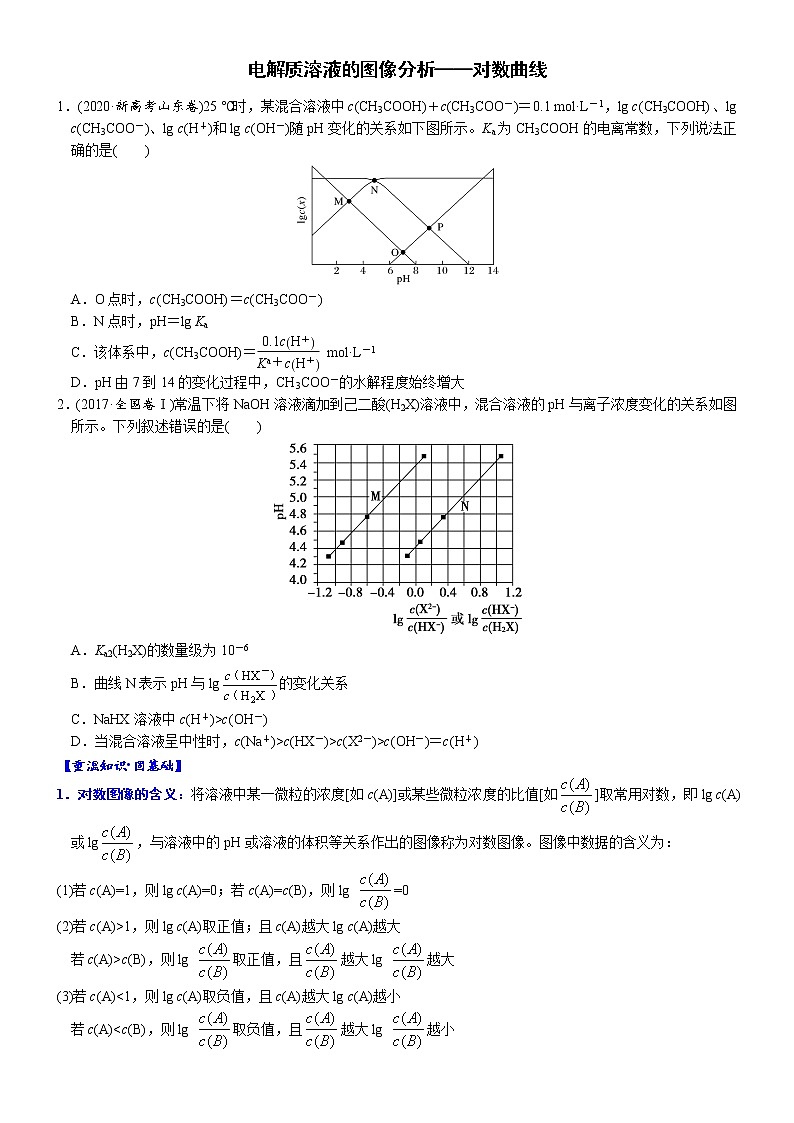
1.(2020·新高考山东卷)25 ℃时,某混合溶液中c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1,lg c(CH3COOH)、lg c(CH3COO-)、lg c(H+)和lg c(OH-)随pH变化的关系如下图所示。Ka为CH3COOH的电离常数,下列说法正确的是( )
A.O点时,c(CH3COOH)=c(CH3COO-)
B.N点时,pH=lg Ka
C.该体系中,c(CH3COOH)= mol·L-1
D.pH由7到14的变化过程中,CH3COO-的水解程度始终增大
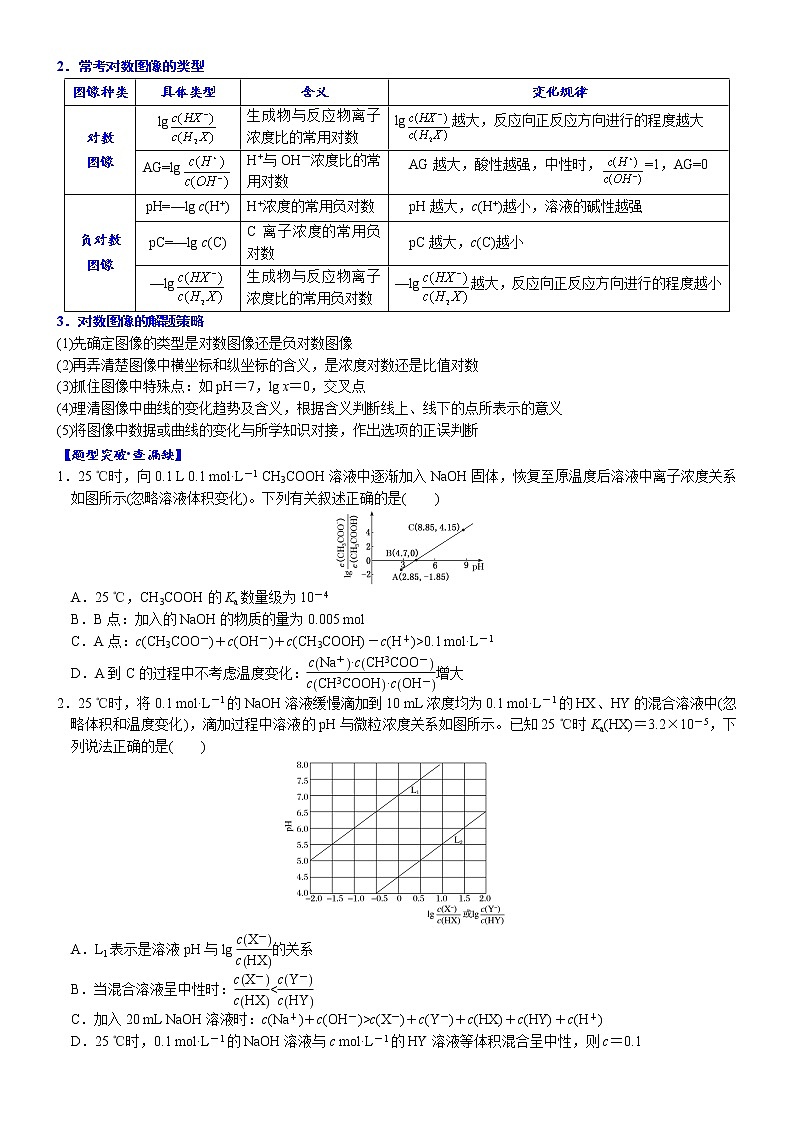
2.(2017·全国卷Ⅰ)常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( )
A.Ka2(H2X)的数量级为10-6
B.曲线N表示pH与lg的变化关系
C.NaHX溶液中c(H+)>c(OH-)
D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+)
【重温知识•固基础】
1.对数图像的含义:将溶液中某一微粒的浓度[如c(A)]或某些微粒浓度的比值[如]取常用对数,即lg c(A)或lg,与溶液中的pH或溶液的体积等关系作出的图像称为对数图像。图像中数据的含义为:
(1)若c(A)=1,则lg c(A)=0;若c(A)=c(B),则lg =0
(2)若c(A)>1,则lg c(A)取正值;且c(A)越大lg c(A)越大
若c(A)>c(B),则lg 取正值,且越大lg 越大
(3)若c(A)<1,则lg c(A)取负值,且c(A)越大lg c(A)越小
若c(A)
图像种类
具体类型
含义
变化规律
对数
图像
lg
生成物与反应物离子浓度比的常用对数
lg越大,反应向正反应方向进行的程度越大
AG=lg
H+与OH-浓度比的常用对数
AG越大,酸性越强,中性时,=1,AG=0
负对数
图像
pH=—lg c(H+)
H+浓度的常用负对数
pH越大,c(H+)越小,溶液的碱性越强
pC=—lg c(C)
C离子浓度的常用负对数
pC越大,c(C)越小
—lg
生成物与反应物离子浓度比的常用负对数
—lg越大,反应向正反应方向进行的程度越小
3.对数图像的解题策略
(1)先确定图像的类型是对数图像还是负对数图像
(2)再弄清楚图像中横坐标和纵坐标的含义,是浓度对数还是比值对数
(3)抓住图像中特殊点:如pH=7,lg x=0,交叉点
(4)理清图像中曲线的变化趋势及含义,根据含义判断线上、线下的点所表示的意义
(5)将图像中数据或曲线的变化与所学知识对接,作出选项的正误判断
【题型突破•查漏缺】
1.25 ℃时,向0.1 L 0.1 mol·L-1 CH3COOH溶液中逐渐加入NaOH固体,恢复至原温度后溶液中离子浓度关系如图所示(忽略溶液体积变化)。下列有关叙述正确的是( )
A.25 ℃,CH3COOH的Ka数量级为10-4
B.B点:加入的NaOH的物质的量为0.005 mol
C.A点:c(CH3COO-)+c(OH-)+c(CH3COOH)-c(H+)>0.1 mol·L-1
D.A到C的过程中不考虑温度变化:增大
2.25 ℃时,将0.1 mol·L-1的NaOH溶液缓慢滴加到10 mL浓度均为0.1 mol·L-1的HX、HY的混合溶液中(忽略体积和温度变化),滴加过程中溶液的pH与微粒浓度关系如图所示。已知25 ℃时Ka(HX)=3.2×10-5,下列说法正确的是( )
A.L1表示是溶液pH与lg 的关系
B.当混合溶液呈中性时:<
C.加入20 mL NaOH溶液时:c(Na+)+c(OH-)>c(X-)+c(Y-)+c(HX)+c(HY)+c(H+)
D.25 ℃时,0.1 mol·L-1的NaOH溶液与c mol·L-1的HY溶液等体积混合呈中性,则c=0.1
3.常温下,向H3PO3溶液中滴加NaOH溶液至过量,最终生成Na2HPO3,滴定曲线如图所示,其中x=或x=。下列说法错误的是( )
A.曲线 Ⅰ 对应x= B.M点横坐标是6.68
C.NaH2PO3溶液显碱性 D.c(Na+)=c(H2PO)+2c(HPO)时,溶液的pH=7
4.常温下,用NaOH溶液滴加到某酒石酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( )
A.L2表示pH与-lg的变化关系 B.NaHX溶液中c(H+)>c(OH-)
C.线L2上每点对应的溶液中水的电离程度都大于线L1 D.当c(Na+)-c(HX-)-c(X2-)=0时,pH<7
5.常温下将NaOH溶液滴加到磷酸(H3PO4)溶液中,混合溶液中的pH与部分离子浓度变化的关系如图所示。下列说法正确的是( )
A.若直线丙表示pH与-lg 的变化关系,应该在甲、乙之间
B.Ka2(H3PO4)=10-7.21,且NaH2PO4溶液中c(HPO)
D.Na2HPO4溶液中:c(OH-)+c(PO)=c(H+)+c(H2PO)+c(H3PO4)
6.25 ℃时,向1 L c(HA)+c(A-)=0.1 mol·L-1的溶液中滴加盐酸或NaOH溶液,溶液中的H+、OH-、A-及HA的浓度的对数值lg c(X)与pH的关系如图所示(不考虑溶液温度变化),下列说法正确的是( )
A.a表示lg c(A-)与pH的关系曲线
B.K(HA)的数量级为10-4
C.P点溶液中n(Na+)+n(H+)=0.1 mol
D.滴加盐酸或NaOH溶液的过程中c(HA)·c(OH-)的值增大
7.25 ℃时,用HCl调节Na3R溶液的pH,混合溶液的pH与离子浓度的关系如图所示。下列说法正确的是( )
A.L2表示pH与-lg 的关系曲线 B.H3R的电离常数[Ka3(H3R)]的数量级为10-8
C.NaH2R溶液中水电离出的c(H+)>10-7mol·L-1 D.混合溶液的pH=7时,存在c(H3R)
A.b点对应溶液中加入盐酸的体积小于20.00 mL
B.该滴定过程可选用甲基橙作指示剂
C.常温下,甲胺的电离常数为Kb,则pKb=-lg Kb=4.3
D.c点对应溶液可能存在关系:2c(H+)+c(CH3NH)=c(CH3NH2)+2c(OH-)+c(Cl-)
9.25 ℃时,向Na2CO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。已知:lg X=lg 或lg ,lg 2=0.3, lg 3=0.5。下列叙述正确的是( )
A.曲线m表示pH与lg 的变化关系
B.当溶液呈中性时,c(Na+)=c(HCO)+2c(CO)
C.M点的溶液中:c(Na+)>c(CO)>c(HCO)>c(OH-)>c(H+)
D.25 ℃时,CO+H2OHCO+OH-的平衡常数为2.0×10-4
10.如图为室温下某二元酸H2M溶液中H2M、HM-、M2-的浓度对数lg c随pH的变化图像。下列分析错误的是( )
A.该二元酸溶液浓度为0.010 mol·L-1 B.pH=1.89时,c(H2M)=c(HM-)>c(M2-)
C.pH=7.0时,lgc(M2-)-lgc(HM-)=0.77 D.在NaHM溶液中,水的电离受到抑制
11.常温下,0.1 mol·L-1的H2A溶液中各种微粒浓度的对数值(lg c)与pH的关系如图所示。下列说法不正确的是( )
A.H2A是二元弱酸
B.HA-H++A2-的电离平衡常数Ka=10-1.2
C.0.1 mol·L-1的H2A溶液中:c(H+)=c(HA-)+2c(A2-)+c(OH-)
D.pH=4.2时,c(HA-)=c(A2-)>c(H+)>c(H2A)>c(OH-)
12.常温下,向二元弱酸H2Y溶液中滴加KOH溶液,所得混合溶液的pH与离子浓度变化的关系如图所示。下列有关说法错误的是( )
A.曲线M表示pH与lgc(HY-)/c(H2Y)的变化关系
B.Ka2(H2Y)=10-4.3
C.d点溶液中:c(H+)-c(OH-)=2c(Y2-)+c(HY-)-c(K+)
D.交点e的溶液中:c(H2Y)=c(Y2-)>c(HY-)>c(H+)>c(OH-)
13.在NaCN溶液中存在水解平衡:CN-+H2OHCN+OH-,水解常数Kh(NaCN)=≈[c0(NaCN)是NaCN溶液的起始浓度]。25 ℃时,向1 mol·L-1的NaCN溶液中不断加水稀释,NaCN溶液浓度的对数值lgc0与2pOH[pOH=-lgc(OH-)]的关系如图所示,下列说法中错误的是( )
A.25 ℃时,Kh(NaCN)的值为10-4.7
B.升高温度,可使曲线上a点变到b点
C.25 ℃,向a点对应的溶液中加入固体NaCN,CN-的水解程度减小
D.c点对应溶液中的c(OH-)大于a点
【题型特训•练高分】
1.室温下,将0.10 mol·L-1 NaOH溶液滴加到0.10 mol·L-1 HA溶液中,溶液的pH与粒子浓度比值的对数关系如图所示。下列叙述正确的是( )
A.溶液中水的电离程度:N>P>Q B.P点溶液中:c(Na+)=c(OH-)+c(HA)-c(H+)
C.Q点溶液中:c(Na+)>c(A-)>c(HA) D.室温下,NaA的水解平衡常数Kh=10-4.75
2.25 ℃,向V mL 0.01 mol·L-1氨水中还滴加入同浓度的CH3COOH溶液(Ka=1.75×10-5),pH与pOH[pOH=-lg c(OH-)]的变化关系如图所示。下列说法错误的是( )
A.Q点溶液中,c(NH)=c(CH3COO-)>c(H+)=c(OH-) B.M、N点溶液中H2O的电离程度相同
C.若b=9,则M点溶液中lg =4+lg 1.75 D.N点溶液加水稀释,变大
3.常温下,用NaOH溶液滴定H2C2O4溶液,溶液中-lg和-lg c(HC2O)[或-lg和-lg c(C2O)]的关系如图所示,下列说法正确的是( )
A.水的电离程度:M点>N点
B.滴定过程中,当pH=5时,c(Na+)-3c(HC2O)>0
C.若c(HC2O)>c(C2O)>c(H2C2O4),则pH范围为3.5
4.25 ℃时,向0.1 mol·L-1HX溶液中逐渐加入NaOH固体,恢复至原温度后lg与pH的关系如图所示(忽略溶液体积变化),下列有关叙述不正确的是( )
A.HX的Ka的数量级为10-5 B.P点的溶液中:c(Na+)>c(X-)>c(OH-)>c(H+)
C.N点的溶液中:c(Na+)+c(H+)=c(HX)+c(OH-) D.M点的溶液中:c(Na+)+c(HX)+c(H+)=0.1 mol·L-1
5.常温下,将NaOH溶液滴加到某一元酸(HA)溶液中,测得混合溶液的pH与离子浓度变化关系如下图所示[已知:p=-lg]。下列叙述不正确的是( )
A.Ka(HA)的数量级为10-5
B.滴加NaOH溶液过程中,保持不变
C.m点所示溶液中:c(H+)=c(HA)+c(OH-)-c(Na+)
D.n点所示溶液中:c(Na+)=c(A-)+c(HA)
6.草酸(H2C2O4)是一种二元弱酸。常温下向H2C2O4溶液中滴加NaOH溶液,混合溶液中lg X[X表示或]与pH的变化关系如图所示。下列说法不正确的是( )
A.曲线Ⅰ表示lg与pH的变化关系
B.pH=1.22的溶液中:2c(C2O)+c(HC2O)>c(Na+)
C.1.22<pH<4.19的溶液中:c(HC2O)>c(C2O)>c(H2C2O4)
D.pH=4.19的溶液中:c(Na+)<3c(HC2O)
7.T ℃时,向浓度均为1 mol·L-1的两种弱酸HA、HB中不断加水稀释,并用pH传感器测定溶液pH。所得溶液pH的两倍(2pH)与溶液浓度的对数(lg c)的关系如图所示。下列叙述错误的是( )
已知:①HA的电离常数:Ka=≈;②pKa=-lg Ka。
A.酸性:HA>HB
B.a点对应的溶液中:c(HA)=0.1 mol·L-1,c(H+)=0.01 mol·L-1
C.T ℃时,弱酸HB的pKa≈5
D.弱酸的Ka随溶液浓度的降低而增大
8.H3RO4为一种三元弱酸。常温下,向1 L 0.1 mol·L-1H3RO4溶液中滴加0.1 mol·L-1NaOH溶液,混合溶液中lgX[表示lg、lg或lg]随溶液pH的变化如图所示。下列说法正确的是( )
A.曲线c代表lg与溶液pH的关系
B.常温下,H3RO4的Ka3的数量级为10-11
C.pH=11.40时,溶液中存在:c(Na+)=c(OH-)-c(H+)+c(H2RO)+5c(RO)
D.常温下,NaH2RO4能促进水的电离
9.向x mol·L-1的20 mL H2B溶液中滴入相同浓度的NaOH溶液,测得H2B、HB-、B2-的pH—pc(pc=-lg c)曲线如图所示。下列说法正确的是( )
A.a、b点所在曲线对应的粒子为B2- B.水电离出的氢离子浓度大小关系为c>b>a
C.c点,滴入NaOH溶液的体积为10 mL D.=10-2.6
10.类比pH,定义pC=-lg C,已知琥珀酸(CH2COOH)2(以H2A表示)为二元弱酸,25 ℃时用HCl气体或者KOH固体调节1 L 0.1 mol·L-1 H2A溶液的pH,混合溶液中的pH与pC(C代表H2A、HA-、A2-的浓度)的关系如图所示(不考虑溶液体积和温度的变化),下列说法正确的是( )
A.曲线Ⅰ、Ⅱ、Ⅲ分别代表的粒子为HA-、A2-、H2A
B.a、b、c三点水的电离程度大小为b>a>c
C.滴定过程中先增大再减小
D.c点溶液满足c(K+)<0.1+c(HA-)
11.已知:p[]=-lg[]。室温下,向0.10 mol/L HX溶液中滴加0.10 mol/LNaOH溶液,溶液pH随p[]变化关系如图所示。下列说法正确的是( )
A.溶液中水的电离程度:a>b>c B.c点溶液中:c(Na+)=10c(HX)
C.室温下NaX的水解常数为10-4.75 D.图中b点坐标为(0,4.75)
【电解质溶液的图像分析——对数曲线】答案
【研析真题•明方向】
1.C。解析:随着溶液碱性的增强,c(CH3COOH)减小,c(CH3COO-)增大,故MN线表示lgc(CH3COO-),NP线表示lgc(CH3COOH),MO线表示lgc(H+),OP线表示lgc(OH-)。O点时,c(H+)=c(OH-),N点时,c(CH3COOH)=c(CH3COO-),A项错误;N点时,lgc(CH3COOH)与lgc(CH3COO-)相等,故c(H+)=Ka,pH=-lgKa,B项错误;由CH3COOH的电离平衡常数推导可知Ka==c(H+)·,故c(CH3COOH)=mol·L-1,C项正确;溶液pH增大,碱性增强,CH3COO-的水解程度减小,D项错误。
2.D。解析:横坐标取0时,曲线M对应pH约为5.4,曲线N对应pH约为4.4,因为是NaOH滴定H2X溶液,所以在酸性较强的溶液中会存在c(HX-)=c(H2X),所以曲线N表示pH与lg的变化关系,B正确;=1时,即lg=0,pH≈5.4,c(H+)≈1×10-5.4 mol·L-1,Ka2=≈1×10-5.4,A正确;NaHX溶液中,c(HX-)>c(X2-),即<1,lg<0,此时溶液呈酸性,C正确;当溶液呈中性时,由曲线M可知lg>0,>1,即c(X2-)>c(HX-),D错误。
【题型突破•查漏缺】
1.D。解析:选D 25 ℃,根据A点坐标可知,当pH=2.85时,lg Ka+pH=-1.85,即Ka=10-4.7,CH3COOH的Ka数量级为10-5,A错误;B点时,醋酸和醋酸根浓度相等,原CH3COOH溶液0.1 L 0.1 mol·L-1,即B点时n(CH3COOH)+n(CH3COO-)=0.01 mol,根据电荷守恒可知,c(Na+)+c(H+)=c(CH3COO-)+c(OH-),n(Na+)=n(CH3COO-)+n(OH-)-n(H+)=0.005+n(OH-)-n(H+),环境pH<7,加入的NaOH的物质的量小于0.005 mol,B错误;A点时,根据物料守恒可知,c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1,pH<7,溶液显酸性,即c(CH3COO-)+c(OH-)+c(CH3COOH)-c(H+)<0.1 mol·L-1,C错误;根据醋酸根的水解方程式可知,醋酸根水解常数Kb=,A到C的过程中不考虑温度变化,水解常数不变,加入的氢氧化钠固体增大,钠离子浓度不断增大,增大,D正确。
2.C。解析:Ka(HX)=,lg =lg =lg Ka(HX)+pH,当lg =0时,则lg Ka(HX)+pH=0,溶液的pH=-lg(3.2×10-5)=5-lg 3.2≈4.5,则L2表示溶液pH与lg 的关系,故A错误;=、=,则混合溶液中、与电离常数成正比,Ka(HX)>Ka(HY),所以当混合溶液呈中性时:>,故B错误;加入20 mL NaOH溶液时,碱和两种酸的物质的量之和相等,酸碱恰好完全反应,溶液中溶质为等物质的量浓度的NaX、NaY,根据物料守恒得c(Na+)=c(X-)+c(Y-)+c(HX)+c(HY),X-、Y-水解导致溶液呈碱性,则c(OH-)>c(H+),所以存在c(Na+)+c(OH-)>c(X-)+c(Y-)+c(HX)+c(HY)+c(H+),故C正确;25 ℃时,0.1 mol·L-1的NaOH溶液与c mol·L-1的HY溶液等体积混合呈中性,根据图像中L1得到,当溶液pH为7时,=1,说明溶液中由一半的HY与NaOH反应,则起始时c=0.2 mol·L-1,D错误。
3.C。解析:取pH为0的点可以算出曲线Ⅰ对应的电离平衡常数为10-1.43,曲线Ⅱ对应的电离平衡常数为10-6.68,因为Ka1大于Ka2,所以Ka1=10-1.43,Ka2=10-6.68,该图像的线性关系为pKa=pH-lg x,由于弱酸的第一步电离程度大于第二步电离程度,因此曲线Ⅰ对应的x=,A正确;由于pKa=pH-lg x,曲线 Ⅱ 对应的x=,Ka2=10-6.68=,此时=1,所以c(H+)=10-6.68,则pH=6.68,所以M点横坐标为6.68,B正确;对于H3PO3,Ka1=10-1.43,Ka2=10-6.68,由于Kh2=,则Kh2=10-12.57<Ka2=10-6.68,所以H2PO的电离大于水解,NaH2PO3溶液显酸性,C错误;电荷守恒式为c(Na+)+c(H+)=c(H2PO)+2c(HPO)+c(OH-),当c(Na+)=c(H2PO)+2c(HPO)时,c(H+)=c(OH-),即常温下pH=7,D正确。
4.C。解析:由第一步电离程度大于第二步电离,且坐标原点对应的pH可知,L2表示pH与-lg的变化关系,故A正确;由c(HX-)=c(X2-)时溶液pH=4.34,可知NaHX溶液中HX-电离程度大于HX-水解程度,则NaHX溶液呈酸性,溶液中c(H+)>c(OH-),故B正确;酸、碱浓度越大,对水的抑制程度越大,则线L2上每点对应的溶液中水的电离程度不一定大于线L1,若NaOH过量时水的电离程度可能小于线L1,故C错误;若恰好反应生成NaHX时,由物料守恒可知c(Na+)=c(HX-)+c(X2-),结合选项B可知,c(Na+)-c(HX-)-c(X2-)=0时,pH<7,故D正确。
5.C。解析:Ka1=,Ka2=,Ka3=,由于Ka1>Ka2>Ka3,所以同一pH时,>>,则lg >lg >lg ,也就是-lg >-lg >-lg ,所以曲线甲表示-lg ,曲线乙表示-lg ,曲线丙应在曲线乙的右侧,A错误;Ka2=,据图可知当pH=8.21时,-lg =1,即c(H+)=10-8.21mol·L-1时=10,所以Ka2=
=10-8.21×10=10-7.21,NaH2PO4溶液中存在H2PO的电离和水解,其水解平衡常数Kh3=,据图可知当pH=4.15时,-lg =2,所以其水解平衡常数Kh3=10-11.85
10-4.68 mol·L-1,溶液的pH=4.68,C正确;溶液中存在质子守恒:c(OH-)+c(PO)=c(H+)+c(H2PO)+2c(H3PO4),D错误。
6.C。解析:根据图像分析,微粒浓度的对数越大离子浓度越大,随着pH的增大,溶液碱性增强,酸性减弱,则氢离子浓度逐渐减小,氢氧根离子浓度逐渐增大;c的浓度的对数值在减小,为c(H+)浓度变化曲线;d的浓度的对数值在增大,为lg c(OH-)变化曲线;pH小于4.75时,a的浓度的对数值不变,pH越大,a的浓度的对数值减小,应该是lg c(HA)的变化曲线;b的浓度的对数值随pH的增大而增大,b为lg c(A-)变化曲线。根据上述分析a表示lg c(HA)与pH的关系曲线,故A错误;K(HA)的表达式为K(HA)=,pH=4.75 时,c(HA)=c(A-),K(HA)==10-4.75≈1.78×10-5,数量级为10-5,故B错误;P点时,c(OH-)=c(HA),P点的电荷守恒式为c(H+)+c(Na+)=c(A-)+c(OH-),变式为c(H+)+c(Na+)=c(A-)+c(HA),根据题中信息,1 L c(HA)+c(A-)=0.1 mol·L-1的溶液中,n(HA)+n(A-)=0.1 mol·L-1×1 L=0.1 mol,则溶液中n(Na+)+n(H+)=0.1 mol,故C正确;滴加盐酸或NaOH溶液的过程中,K(HA)=,c(H+)=,K(HA)=,K(HA)、Kw只受温度影响,温度不变,平衡常数不变,滴加盐酸,c(A-)在减小,c(OH-)·c(HA)的值减小,故D错误。
7.D。解析:对函数-lg 为减函数,值越小说明分子越大,所以L1表示pH与-lg 的关系曲线,L2表示pH与-lg 的关系曲线,L3表示pH与-lg 的关系曲线,A项错误;L1中任取一点计算,pH=10时,-lg ≈-3,≈103,Ka3(H3R)=≈=10-13,B项错误;L2中-lg =0时,pH=7,即H2R-电离程度与HR2-水解程度相等,水电离的氢离子浓度为10-7 mol·L-1,C项错误;pH=7时,-lg ≈6,
-lg ≈-5,-lg =0,可得c(H3R)=0.1c(R3-),故c(H3R)
9.D。解析:Ka1(H2CO3)=,Ka2=(H2CO3)=,Ka1(H2CO3)>Ka2(H2CO3),c(H+)相等时,>,>lg ,故曲线n表示pH与lg 的变化关系,A不正确;溶液中c(Na+)+c(H+)=2c(CO)+c(HCO)+c(OH-)+c(Cl-),溶液呈中性时c(Na+)=2c(CO)+c(HCO)+c(Cl-),B不正确;M点时=10-1,则c(CO)
11.B。解析:溶液中存在H2A、H+、HA-、A2-,说明H2A是二元弱酸,A项正确;pH=4.2时,c(A2-)=c(HA-),HA-H++A2-的电离平衡常数Ka==c(H+)=10-4.2,B项错误;0.1 mol·L-1的H2A溶液中,根据电荷守恒有c(H+)=c(HA-)+2c(A2-)+c(OH-),C项正确;由图可知,pH=4.2时,c(HA-)=c(A2-)>c(H+)>c(H2A)>c(OH-),D项正确。
12.D。解析:A.随着pH的增大,H2Y的电离程度逐渐增大,溶液中c(HY-)/c(H2Y)逐渐增大,c(HY-)/c(Y2-)逐渐减小,lg c(HY-)/c(H2Y)逐渐增大,lg c(HY-)/c(Y2-)逐渐减小,因此曲线M表示pH与lg c(HY-)/c(H2Y)的变化关系,故A正确;B.pH=3时,lg c(HY-)/c(Y2-)=1.3,则Ka2(H2Y)=c(Y2-)·c(H+)/c(HY-)=10-3/101.3=10-4.3,故B正确;C.d点溶液中存在电荷守恒,c(H+)+c(K+)=2c(Y2-)+c(HY-)+c(OH-),因此c(H+)-c(OH-)=2c(Y2-)+c(HY-)-c(K+),故C正确;D.交点e的溶液中存在lgc[(HY-)/c(H2Y)]=lgc[(HY-)/c(Y2-)]>1.3,因此c(HY-)/c(Y2-)>101.3,即c(HY-)>c(Y2-),故D错误。
13.B。解析:2pOH=-2lgc(OH-),则c2(OH-)=10-2pOH。Kh(NaCN)=,由a点坐标可知,c0(NaCN)=0.1 mol·L-1,c2(OH-)=10-5.7,代入表达式可得Kh(NaCN)=10-4.7,A项正确;升高温度,促进CN-的水解,OH-浓度增大,则2pOH的值减小,B项错误;加入NaCN固体,CN-浓度增大,水解平衡正向移动,但CN-水解的程度减小,C项正确;pOH是OH-浓度的负对数,因c点的pOH小于a点,所以c点OH-的浓度大于a点,D项正确。
【题型特训•练高分】
1.B。解析:三点的pH都小于7,水的电离受到抑制,且pH越小,水的电离程度越小,故溶液中的水的电离程度为N<P<Q,A错误;P点lg=0,即c(A-)=c(HA),根据电荷守恒分析,c(Na+)+c(H+)=c(OH-)+c(A-),则有c(Na+)+c(H+)=c(OH-)+c(HA)或c(Na+)=c(OH-)+c(HA)-c(H+),B正确;Q点lg=1,pH小于7,c(H+)>c(OH-),则根据电荷守恒分析,c(Na+)+c(H+)=c(OH-)+c(A-),则有c(A-)>c(Na+),C错误;由N、Q点的坐标可以计算P点坐标(0,4.75),lg=0,根据电离平衡常数K=分析,K=10-4.75,则室温下,NaA的水解平衡常数Kh===10-9.25,D错误。
2.D。解析:Q点时pH=pOH,说明c(OH-)=c(H+),溶液呈中性,电荷守恒为c(NH)+c(H+)=c(CH3COO-)+c(OH-),则c(NH)=c(CH3COO-),可知c(NH)=c(CH3COO-)>c(H+)=c(OH-),故A正确;由于M点的OH-浓度等于N点的H+浓度,对水的电离程度抑制能力相同,所以两点溶液中水电离程度相同,故B正确;M点氨水过量,溶质为NH3·H2O和CH3COONH4,pH=9,则===1.75×104,则lg =4+lg 1.75,故C正确;N点溶液为醋酸和醋酸铵,加水稀释,促进铵根离子的水解,则n(NH)减小,n(NH3·H2O)增大,可知减小,故D错误。
3.C。解析:草酸是二元弱酸,在溶液中分步电离,第一步电离抑制第二步电离,电离常数Ka1=>Ka2=,由电离常数可知-lg =-lg ,
-lg =-lg ,由图可知,当c(H+)=c(H2C2O4)或c(H+)=c(HC2O)时可得Ka1=10-2、Ka2=10-5,则下端直线代表-lg ,上端直线代表-lg ,则M点为草酸的第一步电离,N点为草酸的第二步电离,水的电离程度:N点>M点,故A错误;当pH=5时,由Ka2==10-5可得c(HC2O)=c(C2O),溶液中的电荷守恒关系为c(Na+)+c(H+)=c(OH-)+c(HC2O)+2c(C2O),整合两式可得c(Na+)-3c(HC2O)=c(OH-)-c(H+)<0,故B错误;由c(HC2O)>c(C2O)>c(H2C2O4)可得>>1,0<<1,由电离常数可得>>1>>0,解不等式可知氢离子的范围为10-5 mol·L-1
5.D。解析:HAH++A-,Ka(HA)=,p=-lg=0时,Ka(HA)=c(H+)=10-4.76,Ka(HA)的数量级为10-5,A项正确;==,故滴加NaOH溶液过程中,保持不变,B项正确;由电荷守恒可知,m点所示溶液中:c(H+)+c(Na+)=c(A-)+c(OH-),由A分析可知,m点时c(A-)=c(HA),则c(H+)=c(HA)+c(OH-)-c(Na+),C项正确;n点溶液中根据电荷守恒有c(Na+)+c(H+)=c(OH-)+c(A-),n点溶液呈酸性,c(H+)>c(OH-),则c(Na+)<c(A-),故不可能有c(Na+)=c(A-)+c(HA),D项错误。
6.C。解析:草酸是二元弱酸,其Ka1=>Ka2=,当溶液的pH相同时,c(H+)相同,lgX:Ⅰ>Ⅱ,则曲线Ⅰ表示lg与pH的变化关系,曲线Ⅱ表示lg与pH的变化关系,故A正确;pH=1.22时,溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒:c(Na+)+c(H+)=c(HC2O)+2c(C2O)+c(OH-)可知,2c(C2O)+c(HC2O)>c(Na+),故B正确;lgX为增函数,pH=1.22时,曲线Ⅰ中lgX=lg=0,c(HC2O)=c(H2C2O4),曲线Ⅱ中,lgX=lg=-3,c(HC2O)=c(H2C2O4)=103c(C2O),c(H2C2O4)>c(C2O);pH=4.19时,曲线Ⅰ中,lg X=lg=3,c(HC2O)=103c(H2C2O4),曲线Ⅱ中,lgX=lg=0,c(C2O)=c(HC2O)=103c(H2C2O4),c(H2C2O4)
8.C。解析:lgX=0时,表示对应的两种离子浓度相等,由H3RO4的三级电离中,电离常数逐级减小,结合电离常数表达式,知曲线c代表lg与溶液pH的关系,A项错误;常温下,H3RO4的Ka3=1×10-11.40,数量级为10-12,B项错误;pH=11.40时,c(RO)=c(HRO),结合电荷守恒,c(Na+)+c(H+)=c(OH-)+c(H2RO)+2c(HRO)+3c(RO),整理得c(Na+)=c(OH-)-c(H+)+c(H2RO)+5c(RO),C项正确;H3RO4的第一步电离常数Ka1==10-2.25,第二步电离常数Ka2==10-6.77,H2RO的水解常数Kh==10-11.75<10-6.77,即H2RO的电离程度大于其水解程度,则H2RO抑制水的电离,D项错误。
9.D。解析:从图中可以看出,随着pH的增大,ac段离子浓度减少,为H2B,cb段离子浓度增大,为B2-,ab段离子浓度先增大后减少,为HB-。a、b点所在曲线对应的粒子为HB-,故A错误;c点时HB-浓度最大,既存在HB-的电离,也存在HB-的水解;b点时主要是水的电离,且pH比c点大,水的电离程度大,水电离出的氢离子的浓度大小关系为b>c>a,故B错误;c点时HB-浓度最大,说明H2B与NaOH刚好1∶1反应完全,因浓度相等,此时加入NaOH体积为20 mL,故C错误;H2B的一级电离常数为K1=,由a点数据可知c(HB-)=c(H2B),pH=1,即c(H+)=10-1 mol·L-1,K1=10-1,二级电离常数为K2=,同理由b点数据可得K2=10-3.6,=··==10-2.6,故D正确。
10.D。解析:随pH增大,c(H2A)逐渐减小,即曲线Ⅱ代表H2A,c(HA-)先增大后减小,即曲线Ⅰ代表HA-,c(A2-)逐渐增大,pC值逐渐减小,即曲线Ⅲ代表A2-,A项错误;H2A溶液中加NaOH,溶液碱性逐渐增强,恰好中和之前水的电离程度逐渐增大,故c>b>a,B项错误;Ka1=,Ka2=,=,滴定过程中温度不变,平衡常数不变,C项错误;根据电荷守恒有c(K+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),c点满足c(HA-)=c(A2-),物料守恒满足c(HA-)+c(A2-)+c(H2A)=0.1 mol·L-1,溶液呈酸性,则有c(K+)<c(HA-)+2c(A2-)=0.1-c(H2A)+c(A2-)=0.1+c(HA-)-c(H2A)<0.1+c(HA-),D项正确。
11.D。解析:根据图示可知,a、b、c均为酸性溶液,则溶质为HX和NaX,pH<7的溶液中,HX的电离程度大于X-的水解程度,可只考虑H+对水的电离的抑制,溶液pH越大氢离子浓度越小,水的电离程度越大,则溶液中水的电离程度:a
06 考向6 电解质溶液的图像分析——对数曲线(附答案解析)-备战2023年高考化学大二轮专题突破系列(全国通用): 这是一份06 考向6 电解质溶液的图像分析——对数曲线(附答案解析)-备战2023年高考化学大二轮专题突破系列(全国通用),共16页。
06 考向6 电解质溶液的图像分析——对数曲线(附答案解析)-备战2023年高考化学大二轮专题突破系列(全国通用): 这是一份06 考向6 电解质溶液的图像分析——对数曲线(附答案解析)-备战2023年高考化学大二轮专题突破系列(全国通用),共14页。
05 考向5 电解质溶液的图像分析——分布分数曲线(附答案解析)-备战2023年高考化学大二轮专题突破系列(全国通用): 这是一份05 考向5 电解质溶液的图像分析——分布分数曲线(附答案解析)-备战2023年高考化学大二轮专题突破系列(全国通用),共17页。












