






化学选择性必修1专题2 化学反应速率与化学平衡第一单元 化学反应速率获奖课件ppt
展开1.宏观辨识与微观探析:通过实验,从宏观上认识外界因素影响化学反应速率的规律,并能从活化分子的有效碰撞等微观的角度进行分析解释。
2.证据推理与模型认知:建立分析探究外界因素影响化学反应速率的思维模型,即“实验现象→影响规律→理论解释”,促进“证据推理”核心素养的发展。
一、浓度对化学反应速率的影响
二、压强对化学反应速率的影响
三、温度、催化剂对化学反应速率的影响
浓度对化学反应速率的影响
1.内因在相同条件下,不同的化学反应的反应速率首先是由反应物的组成、结构和性质等因素决定的。
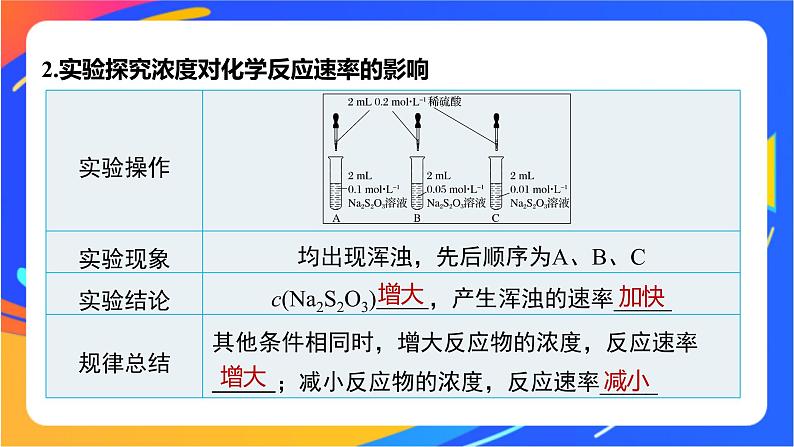
2.实验探究浓度对化学反应速率的影响
3.理论解释(1)碰撞理论——化学反应的微观条件①活化分子:化学反应中,能量较高、有可能发生 的分子。②活化能:活化分子的 与 的 之差。③用碰撞理论理解化学反应的过程
④有效碰撞与化学反应速率的关系有效碰撞的频率越高,则反应速率 。(2)基元反应①概念为了简化化学反应研究的模型,我们重点考查最简单的化学反应,即反应物分子经过 就转化为 分子的反应,称为基元反应。②基元反应的活化能与反应速率的关系每个基元反应都有对应的 ,反应的活化能越大,活化分子所占比例 ,有效碰撞的比例也就 ,故化学反应速率 。
(3)浓度对化学反应速率的影响的微观解释反应物浓度增大→单位体积内活化分子数目 →单位时间内有效碰撞几率 →反应速率 ;反之,反应速率减慢。
(1)锌和硫酸反应时,硫酸的浓度越大,产生H2的速率越大( )(2)活化分子间的碰撞一定能发生化学反应( )(3)所有的化学反应都是经历几步基元反应完成的( )(4)增加固体反应物的质量,化学反应速率增大( )(5)增大反应物的浓度,虽然活化分子百分比未变,但单位体积内分子总数增加,使单位体积内活化分子总数增加,化学反应速率加快( )
1.所有的化学反应都是几个基元反应的总反应,对吗?举例说明。
提示 不对。有的化学反应一步就能完成,它既是基元反应又是总反应,如CO+NO2===CO2+NO就是基元反应。
2.有同学认为活化分子总数多的,反应速率快;有效碰撞次数多的,反应速率快。你同意他的观点吗?并说明理由。
提示 不同意,应该是单位体积内活化分子总数多的反应速率快;单位时间内有效碰撞次数多的反应速率快。
1.下列说法正确的是A.活化分子具有的能量是活化能B.活化分子的总数越多,反应速率越大C.某一反应的活化分子的百分数是个定值D.单位时间内有效碰撞次数越多,反应速率越大
单位体积内活化分子总数越多,有效碰撞几率越大,反应速率越大,B错误;只有在一定条件下,活化分子在反应物中所占百分数才是定值,C错误。
2.已知反应:Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O。下列各组反应是在相同温度下发生的,则最快产生浑浊的是
反应物浓度越大,反应速率越快,则越快产生浑浊,D项中Na2S2O3和H2SO4的浓度最大,则反应速率最快,最先出现浑浊。
3.相同温度条件下,将下列4种不同浓度的NaHCO3溶液,分别加入到4个盛有20 mL 0.06 ml·L-1盐酸的烧杯中,并加水稀释至50 mL,NaHCO3溶液与盐酸反应产生CO2的速率由大到小的顺序是_______________。①20 mL,0.03 ml·L-1②20 mL,0.02 ml·L-1③10 mL,0.04 ml·L-1④10 mL,0.02 ml·L-1
混合后氢离子浓度相同,四种溶液中c( )的大小决定产生CO2的速率大小。混合后 的浓度分别为①0.012 ml·L-1、②0.008 ml·L-1、③0.008 ml·L-1、④0.004 ml·L-1。
浓度对化学反应速率的影响注意事项(1)对于固体或纯液体,其浓度可视为常数,其质量改变不影响化学反应速率。(2)固体物质的反应速率与接触面积有关,颗粒越细,表面积越大,反应速率就越快。(3)对于离子反应,只有实际参加反应的各离子浓度发生变化,才会引起化学反应速率的改变。
压强对化学反应速率的影响
1.研究对象——气体模型的理解对于气体来说,在一定温度下,一定质量的气体所占的体积与压强成反比。如图所示:对于有气体参加的反应,在密闭容器中保持温度不变时,增大压强,气体体积 ,反应物浓度 ,化学反应速率 。
2.微观解释增大压强→气体体积减小→反应物浓度增大→单位体积内活化分子数 →单位时间内有效碰撞几率 →反应速率 ;反之,反应速率 。
对于反应N2(g)+3H2(g) 2NH3(g)(1)恒温恒容条件下,向反应体系中充入氮气,反应速率_______,原因是________________________________________________________。
容积不变,充入氮气,反应物氮气的浓度增大,反应速率增大
(2)恒温恒容条件下,向反应体系中充入氦气,容器内总压强_______,反应速率_____,原因是容积不变,充入氦气,___________________________________________。
反应物氮气、氢气的浓度
(3)恒温恒压条件下,向反应体系中充入氦气,反应速率_______,原因是压强不变,充入氦气,容积_____,反应物_____________________________________。
氮气、氢气的浓度减小,
(4)恒温条件下,增大容器体积,正反应速率减小,逆反应速率______。
1.(2022·河北承德高二检测)在一定条件下的密闭容器中存在下列四个化学反应,增大容器的体积对化学反应速率没有影响的是A.2SO2(g)+O2(g) 2SO3(g)B.CO(g)+H2O(g) CO2(g)+H2(g)C.CO2(g)+H2O(l) H2CO3(aq)D.Fe3+(aq)+3SCN-(aq) Fe(SCN)3(aq)
增大容器的体积对于没有气体参加或生成的反应的反应速率无影响,D项正确。
2.(2021·南京检测)在一密闭容器中充入1 ml H2和1 ml I2,压强为p Pa,并在一定温度下使其发生反应:H2(g)+I2(g) 2HI(g) ΔH<0,改变下列条件能加快化学反应速率的是A.保持容器容积不变,向其加入1 ml N2(N2不参加反应)B.保持容器容积不变,向其中加入1 ml H2C.保持容器内气体压强不变,向其中加入1 ml N2(N2不参加反应)D.保持容器内气体压强不变,向其中加入1 ml H2(g)和1 ml I2(g)
保持容器容积不变,向其中加入1 ml N2,参加反应的物质的浓度不变,则反应速率不变,故A不符合题意;保持容器容积不变,向其中加入1 ml H2,反应物浓度增大,反应速率增大,故B符合题意;保持容器内气体压强不变,向其中加入1 ml N2,体积增大,反应物的浓度减小,则反应速率减小,故C不符合题意;保持容器内气体压强不变,向其中加入1 ml H2(g)和1 ml I2(g),因体积增大为2倍,物质的量增大为2倍,则浓度不变,反应速率不变,故D不符合题意。
压强是否影响化学反应速率,取决于是否影响反应物的浓度(1)恒容下充入稀有气体,气体压强增大,但反应物浓度不变,故反应速率不变。(2)恒压下充入稀有气体,气体压强不变,但体积增大,反应物浓度减小,反应速率减小。
温度、催化剂对化学反应速率的影响
1.温度对化学反应速率的影响(1)实验探究
(2)影响规律:其他条件相同时,升高温度,化学反应速率 ;降低温度,化学反应速率 。经验规律,一般温度每升高10 K,反应速率可增加 倍。(3)微观解释
反之,反应速率 。
2.催化剂对化学反应速率的影响(1)实验探究
(2)影响规律:当其他条件不变时,使用催化剂,化学反应速率 。
3.用过渡态理论解释催化剂使化学反应速率增大
(1)过渡态理论简介:反应物转化为生成物的过程中要经过能量较高的 。如图所示:Ea是 ,Ea′ 是逆反应的活化能。
(2)过渡态理论对催化剂影响化学反应速率的解释使用催化剂→改变了反应的路径(如图),反应的活化能 →活化分子的百分数_____→反应速率 。
4.其他因素对化学反应速率的影响如反应物间的接触面积、光照、电磁波、超声波等,也会对化学反应的速率产生影响。
(1)升高温度,C+CO2 2CO(吸热反应)反应速率加快,而N2+3H22NH3(放热反应)反应速率会减慢( )(2)升高温度,会使分子的平均能量升高,活化分子所占百分数增大,从而使反应速率加快( )(3)催化剂可以降低反应的活化能,也可以改变反应的ΔH( )(4)一种催化剂可以催化所有的反应( )
某校化学活动社团做了如下探究实验:利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究外界条件改变对化学反应速率的影响。实验数据如表所示:
(1)写出相应反应的离子方程式。
(2)上述实验中主要探究哪些外界条件对化学反应速率的影响?B实验中V1的值为多少?
提示 A、B实验主要探究浓度对化学反应速率的影响,B、C实验主要探究温度对化学反应速率的影响。变量控制法探究实验中要求变量要唯一,故要求总体积相同,所以V1应为5。
(3)实验中发现开始一段时间反应速率较慢,溶液褪色不明显,但不久突然褪色,反应速率明显加快,该同学认为是放热导致溶液温度升高所致。重做此实验,测定溶液不同时间的温度,结果如表:
结合表中数据,解释反应速率明显加快的原因。
提示 反应中生成了Mn2+,可以催化该反应,随着Mn2+浓度增大,化学反应速率加快。
1.硫代硫酸钠溶液与稀硫酸反应的化学方程式为Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O,下列各组实验中最先出现浑浊的是
2.(2022·山西吕梁高二质检)亚氯酸盐(如NaClO2)可作漂白剂,在常温、不见光条件下可保存一年,在酸性条件下发生反应:5 +4H+===4ClO2↑+Cl-+2H2O。开始时,反应非常慢,一段时间后,反应速率变快。对于该反应速率变快的原因,下列猜测最合理的是A.ClO-起催化作用 B.H+起催化作用C.Cl-起催化作用 D.ClO2的逸出
反应开始时就有ClO-和H+,但是反应却非常慢,故既不是ClO-起催化作用也不是H+起催化作用,A、B项错误;随着反应的进行,氯离子浓度逐渐增大,反应速率加快,故可能是氯离子起催化作用,C项正确;逸出ClO2不会出现反应速率突然加快的现象,D项错误。
3.(2022·天津耀华中学高二月考)某反应过程能量变化如图所示,下列说法不正确的是A.反应过程b有催化剂参与B.该反应为放热反应C.加入催化剂,可改变该反应的活化能D.有催化剂的条件下,反应的活化能等于E1+E2
据图可知b中活化能降低,所以b中使用了催化剂,故A正确;反应物总能量高于生成物总能量,该反应为放热反应,故B正确;
催化剂可改变反应的活化能,故C正确;E1、E2分别代表反应过程中各步反应的活化能,整个反应的活化能为能量较高的E1,故D错误。
(1)温度对反应速率的影响规律:对吸热反应、放热反应都适用,且不受反应物状态的限制,升温时,化学反应速率增大;降温时,化学反应速率减小。(2)催化剂对可逆反应的正、逆反应的速率影响相同。(3)催化剂有选择性,不同的化学反应的催化剂不相同,催化剂具有一定的活化温度。
题组一 外界因素对化学反应速率的影响1.(2022·山东日照一中高二月考)100 mL 2 ml·L-1的盐酸与过量的锌片反应时,为减慢反应速率,又不影响生成氢气的总量,可采用的方法是A.加入等体积、等浓度的硝酸钾溶液B.加入适量的醋酸钠固体C.加入适量的NaOH固体D.加入几滴氯化铜溶液
加入等体积、等浓度的硝酸钾溶液,由于硝酸根离子在酸性条件下具有强氧化性,反应生成NO气体,消耗H+,导致生成H2的总量减少,故A错误;加入适量醋酸钠固体,生成醋酸,因醋酸为弱酸,氢离子浓度减小,反应速率减慢,但酸的物质的量不变,生成氢气的总量不变,故B正确;加入适量的NaOH固体,NaOH与盐酸反应,溶液中氢离子的物质的量减少,生成氢气的总量减少,故C错误;加入几滴氯化铜溶液,锌置换出铜,形成锌铜原电池,反应速率加快,故D错误。
2.(2022·海南儋州一中高二质检)对恒温恒容密闭容器中的可逆反应:A(s)+3B(g) 2C(g) ΔH<0,下列叙述正确的是A.升高温度,v逆增大,v正减小B.增大压强,v正增大,v逆减小C.增加A的物质的量,v正增大,v逆减小D.使用催化剂,降低反应活化能,v正、v逆同时增大,且增大的倍数相同
升高温度,正、逆反应速率都增大,故A错误;增大压强,正、逆反应速率都增大,故B错误;A为固体,增加A的物质的量,A的浓度不变,v正、v逆都不变,故C错误;使用催化剂,可同时同等程度地改变正、逆反应速率,所以使用催化剂,v正、v逆同时增大,而且增大的倍数相同,故D正确。
3.对于反应:N2(g)+O2(g) 2NO(g),在密闭容器中进行,下列条件能加快反应速率的是A.增大体积使压强减小B.体积不变,充入N2使压强增大C.体积不变,充入氦气使压强增大D.使总压强不变,充入氖气
增大体积引起浓度减小,反应速率减慢;体积不变充入N2,N2的浓度增大,反应速率加快;体积不变,充入氦气,各反应物的浓度并没有改变,反应速率不变;总压不变,充入氖气,体积增大,反应物浓度减小,反应速率减慢。
题组二 有效碰撞理论与活化能4.下列说法错误的是①当碰撞的分子具有足够高的能量和适当的取向时,才能发生化学反应②发生有效碰撞的分子一定是活化分子③活化分子间的碰撞一定是有效碰撞④活化分子间每次碰撞都发生化学反应⑤能发生有效碰撞的分子必须具有相当高的能量A.①④ B.③④ C.④⑤ D.②⑤
活化分子间的碰撞有适当的取向时,才能发生有效碰撞;活化分子间只有发生有效碰撞时,才能发生化学反应。
5.下列说法不正确的是A.增大反应物浓度,活化分子百分数增大,有效碰撞次数增多B.增大压强,单位体积内气体的活化分子数增多,有效碰撞次数增多C.升高温度,活化分子百分数增加,分子运动加快,有效碰撞次数增多D.催化剂能降低反应的活化能,提高活化分子百分数,有效碰撞次数增多
A项,增大反应物浓度,活化分子数目增多,但活化分子百分数不变。
6.(2021·广州高二月考)已知分解1 ml H2O2放出热量98 kJ,在含少量I-的溶液中,H2O2分解的机理为H2O2+I-===H2O+IO-(慢)、H2O2+IO-===H2O+O2+I-(快)。下列有关该反应的说法不正确的是A.总反应中v(H2O2)∶v(O2)=2∶1B.H2O2的分解速率与I-的浓度有关C.该反应的催化剂是I-,而不是IO-D.由于催化剂的加入降低了反应的活化能,使该反应的活化能低于 98 kJ·ml-1
总反应为2H2O2===2H2O+O2↑,速率之比等于化学计量数之比,则总反应中v(H2O2)∶v(O2)=2∶1,A正确;IO-为中间产物,该反应的催化剂是I-,而不是IO-,C正确;催化剂可降低反应的活化能,但其活化能的大小不能确定,D错误。
题组三 化学反应速率影响因素的综合考查7.(2022·郑州一中高二质检)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示:
根据表中的递变规律,推测O3分别在条件①40 ℃、pH=3.0,②10 ℃、pH=5.0,③30 ℃、pH=7.0下的分解速率的大小关系为A.①<②<③ B.③<②<①C.②<①<③ D.③<①<②
通过分析表中数据可知,O3的浓度减少一半所需的时间(t)随pH的增大、温度的升高而减少。根据50 ℃、pH=3.0时,O3的浓度减少一半所需的时间为31 min,30 ℃、pH=3.0时,O3的浓度减少一半所需的时间为158 min,可知40 ℃、pH=3.0时,O3的浓度减少一半所需的时间大于31 min且小于158 min;根据20 ℃、pH=5.0时,O3的浓度减少一半所需的时间为169 min,可知10 ℃、pH=5.0时,O3的浓度减少一半所需的时间大于169 min;根据30 ℃、pH=6.0时,O3的浓度减少一半所需的时间为15 min,可知30 ℃、pH=7.0时,O3的浓度减少一半所需的时间小于15 min,故O3的分解速率依次增大的顺序为②①③,C项正确。
8.某学习小组研究大小相同的去膜镁条(足量)分别与40 mL 0.1 ml·L-1的醋酸溶液(M)和盐酸(N)反应,相同条件下测得生成的气体体积与反应时间的关系如表所示:
下列说法错误的是A.生成气体的体积从0~5 mL的过程,Mg分别与M、N反应的速率不同 的原因是M、N中c(H+)不同B.若反应速率可用单位时间内生成气体的体积来表示,则5~10 mL内, M与Mg反应的平均反应速率为 mL·s-1C.15~20 mL内,M与Mg反应的速率增大,可能是温度升高所致D.25~45 mL内,N与Mg反应的速率始终大于M与Mg反应的速率
等浓度的醋酸溶液和盐酸,盐酸的氢离子浓度比醋酸溶液的大,则生成气体的体积从0~5 mL的过程中,Mg分别与M、N反应的速率不同的原因是c(H+)不同,A项正确;
由单位时间内生成气体的体积来表示反应速率,则5~10 mL内,M与Mg反应的平均反应速率为 mL·s-1,B项正确;
金属与酸的反应放热,则15~20 mL内,M与Mg反应的速率增大,可能是温度升高所致,C项正确;
25~45 mL内,生成气体需要的时间未知,则不能确定N与Mg反应的速率是否始终大于M与Mg反应的速率,D项错误。
题组四 化学反应速率的图像分析9.碳酸钙与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示,下列结论错误的是A.反应开始2 min内平均反应速率最大B.反应速率先增大后减小C.反应开始4 min内温度对反应速率的影响比浓度大D.反应在2~4 min内以CO2的物质的量变化表示的反应速率为v(CO2)= 0.1 ml·min-1
图中的曲线表明,在0~2 min内产生了0.1 ml CO2,以CO2的物质的量变化表示的反应速率v1=0.05 ml·min-1;2~4 min内产生了0.2 ml CO2,v2=0.1 ml·min-1; 4~6 min内产生了0.05 ml
CO2,v3=0.025 ml·min-1,产生CO2的速率先快后慢,故2~4 min内平均反应速率最大,4~6 min内平均反应速率最小,A项错误、D项正确;反应速率先增大后减小,B项正确;反应速率先增大是由于反应放热,使溶液温度升高,导致反应速率增大,4 min后反应速率减小则是由浓度减小引起的,C项正确。
10.用如图所示的实验装置分别进行镁条与X(25 mL 0.2 ml·L-1盐酸)、Y(50 mL 0.1 ml·L-1盐酸)的实验,每隔半分钟分别测定反应放出气体的体积(均已换算为标准状况下的气体体积)。下列选项中正确表示实验X及Y的结果的是
由镁和HCl反应的化学方程式知,两组实验中镁均过量,n(H+)相等,故二者最终产生等量的氢气,排除选项C和D;
根据其他条件相同时,反应物浓度越大,化学反应速率越大可知,实验X产生氢气的速率大,体现在图像上即实验X对应的曲线的斜率比实验Y的大,结合以上两点可知,选项A符合题意。
11.把在空气中久置的铝片5.0 g投入盛有500 mL 0.5 ml·L-1 H2SO4溶液的烧杯中,该铝片与H2SO4反应产生氢气的速率与反应时间的关系可用如图所示的曲线来表示,回答下列问题:
(1)曲线O→a段,不产生氢气的原因是______________________________________________;有关反应的化学方程式为_____________________ _________________。
久置的铝片表面有氧化铝薄膜,
Al2O3+3H2SO4===
Al2(SO4)3+3H2O
在空气中久置的铝片表面有氧化铝薄膜,因此,H2SO4先和氧化铝反应,不产生氢气。
(2)曲线a→b段,产生氢气的速率增大的主要原因是________________________________________________。
该反应是放热反应,体系温度升高,化学反应速率增大
a→b段,虽然H2SO4溶液的浓度减小,但该反应是放热反应,体系温度升高,温度起主导作用,故化学反应速率增大。
(3)曲线上b点之后,产生氢气的速率逐渐减小的主要原因是____________________________________________________________。
随着反应的进行,H2SO4溶液的浓度减小,化学
曲线上b点之后,H2SO4溶液的浓度减小,成为影响化学反应速率的主要因素,因此化学反应速率逐渐减小。
12.某课外兴趣小组对H2O2的分解速率做了如下实验探究。(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10 mL H2O2制取150 mL O2所需的时间
①该小组在设计方案时,考虑了浓度、a:_______、b:_______等因素对过氧化氢分解速率的影响。
②从上述影响H2O2分解速率的因素a和b中任选一个,说明该因素对该反应速率的影响:________________________________________________________________________________________________________。
其他条件相同,升高反应温度,H2O2分解速率增大
(或其他条件相同,使用合适的催化剂,H2O2分解速率增大)
从本题提供的表格中的数据和条件进行分析可知,在该小组设计方案时,考虑到了浓度、温度和催化剂对化学反应速率的影响。分析(Ⅰ)、(Ⅱ)组实验可以得知,在其他条件相同时,升高反应温度,H2O2分解速率增大;分析(Ⅱ)、(Ⅲ)组实验可以得知,在其他条件相同时,使用合适的催化剂,H2O2分解速率增大。
(2)将质量相同但颗粒大小不同的MnO2分别加入到5 mL 5%的过氧化氢溶液中,并用带火星的木条测试。测定结果如下:
①写出H2O2发生反应的化学方程式:_______________________。
②实验结果说明催化剂作用的大小与_____________________________________有关。
催化剂的颗粒大小(或催化剂的表
13.(2022·湖北荆州中学、宜昌一中等七校高二联考)某化学小组欲测定酸性条件下KClO3溶液与NaHSO3溶液反应的化学反应速率,所用的试剂为10 mL 0.1 ml·L-1KClO3溶液和10 mL 0.3 ml·L-1NaHSO3溶液,所得c(Cl-)随时间变化的曲线如图所示:
(1)根据实验数据可知,该反应在0~4 min内的平均反应速率v(Cl-)=__________ml·L-1·min-1。
根据实验数据可知,该反应在0~4 min内生成氯离子的浓度是0.010 ml·L-1,所以平均反应速率v(Cl-)= =2.5×10-3 ml·L-1·min-1。
(2)反应过程中,该反应的化学反应速率变化趋势为先增大后减小。ⅰ.探究化学反应速率增大的影响因素,完成表格内容:
方案Ⅰ是假设该反应放热,使溶液温度升高,反应速率加快,因此需要测量反应过程中溶液温度的变化,则方案Ⅰ中的实验操作为插入温度计;方案Ⅰ、Ⅱ相比较,探究反应产物Cl-对反应是否有催化作用,所以方案Ⅱ中应加入Cl-,可加入KCl或NaCl固体。
问题与思考:①方案Ⅲ烧杯①中加入1 mL水的作用是______________________________________________________。
空白实验,消除由于反应物
浓度的变化给实验带来的影响
②在证明方案Ⅰ假设不成立的情况下,从变量控制角度思考,方案Ⅲ实验操作设计不严谨,改进措施为_____________________________________________________。
将1 mL水改为1 mL 0.2 ml·L-1KCl
溶液(或NaCl溶液)
方案Ⅲ两烧杯中,除酸性不同外,c(Cl-)也不同,为防止Cl-干扰,故改进措施为将1 mL水改为1 mL 0.2 ml·L-1KCl溶液或NaCl溶液。
③除方案Ⅰ、Ⅱ、Ⅲ外,请再提出一个可能使化学反应速率增大的假设:_____________________________________________________________。
生成物 对反应有催化作用(或生成了 ,加快了化学反应速率)
由于反应中还有硫酸根离子生成,则除方案Ⅰ、Ⅱ、Ⅲ中的假设外,还可以提出的假设是生成的硫酸根离子加快了化学反应速率。
ⅱ.反应后期,化学反应速率降低的主要原因是________________________________。
反应后期由于反应物浓度减小,化学反应速率降低。
高中化学苏教版 (2019)选择性必修1第一单元 化学反应速率公开课课件ppt: 这是一份高中化学苏教版 (2019)选择性必修1第一单元 化学反应速率公开课课件ppt,共16页。PPT课件主要包含了学习目标,内因主要因素,注意以下两种情况,产生气泡速率较慢,产生气泡速率较快,产生气泡速率很慢,△HE-E等内容,欢迎下载使用。
高中第一单元 化学反应速率课文内容ppt课件: 这是一份高中第一单元 化学反应速率课文内容ppt课件,共60页。PPT课件主要包含了课时对点练等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修1第一单元 化学反应速率教课课件ppt: 这是一份高中化学苏教版 (2019)选择性必修1第一单元 化学反应速率教课课件ppt,共60页。PPT课件主要包含了课时对点练,进行快慢,正误判断,应用体验,化学反应速率的测定,释放出来的气体的体积,体系的压强,颜色深浅,有色物质浓度,归纳总结等内容,欢迎下载使用。













