
上海市金山区2022-2023学年高一上学期期末学业质量监测化学试题(Word版含答案)
展开上海市金山区2022-2023学年高一上学期期末学业质量监测
化学试卷
(考试时间60分钟,试卷满分100分)
相对原子质量:H─1 He─4 O─16 Cl─35.5 Cu─64
综合题一(本题共20分)
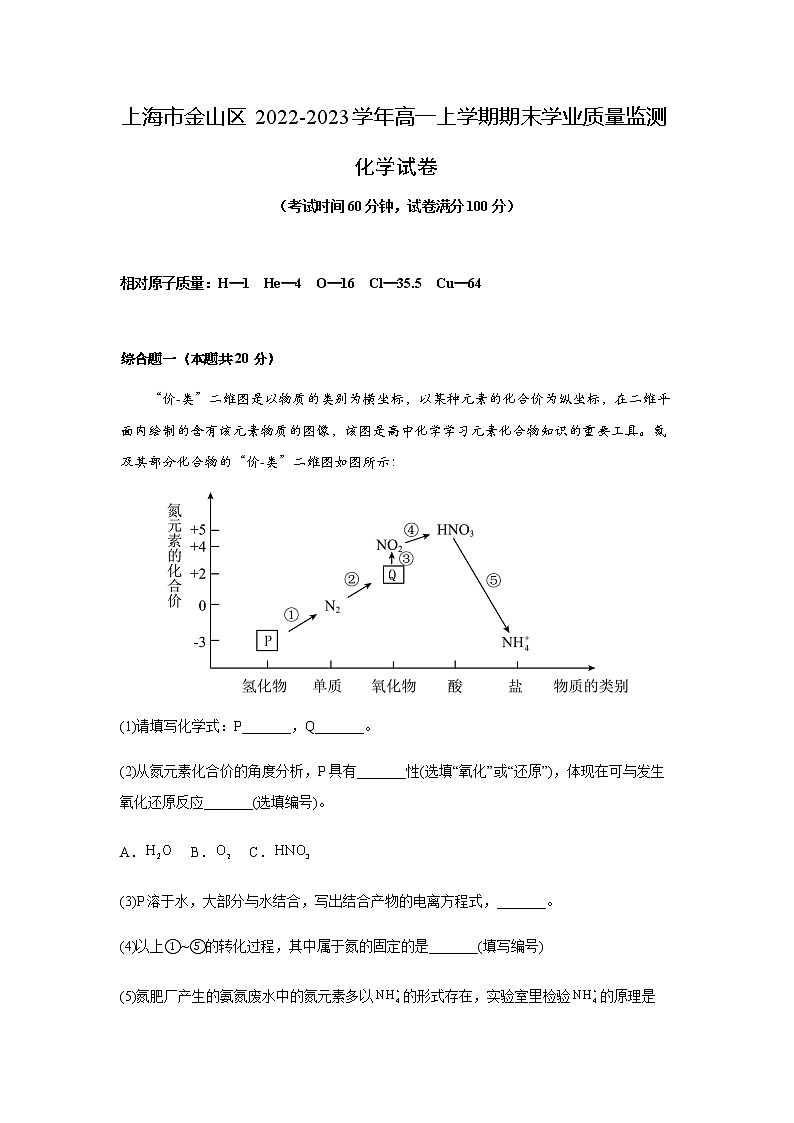
“价-类”二维图是以物质的类别为横坐标,以某种元素的化合价为纵坐标,在二维平面内绘制的含有该元素物质的图像,该图是高中化学学习元素化合物知识的重要工具。氮及其部分化合物的“价-类”二维图如图所示:
(1)请填写化学式:P_______,Q_______。
(2)从氮元素化合价的角度分析,P具有_______性(选填“氧化”或“还原”),体现在可与发生氧化还原反应_______(选填编号)。
A. B. C.
(3)P溶于水,大部分与水结合,写出结合产物的电离方程式,_______。
(4)以上①~⑤的转化过程,其中属于氮的固定的是_______(填写编号)
(5)氮肥厂产生的氨氮废水中的氮元素多以的形式存在,实验室里检验的原理是(用离子方程式表达)_______,如观察到_______现象,说明样品中含有。
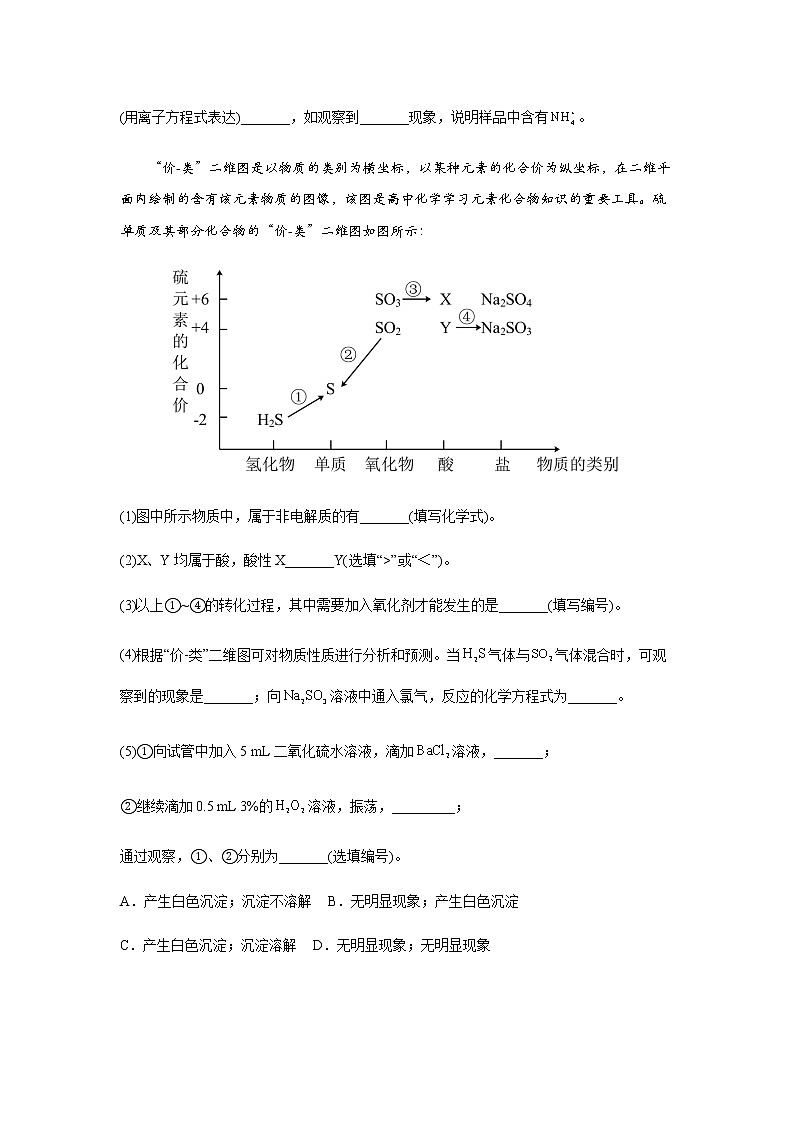
“价-类”二维图是以物质的类别为横坐标,以某种元素的化合价为纵坐标,在二维平面内绘制的含有该元素物质的图像,该图是高中化学学习元素化合物知识的重要工具。硫单质及其部分化合物的“价-类”二维图如图所示:
(1)图中所示物质中,属于非电解质的有_______(填写化学式)。
(2)X、Y均属于酸,酸性X_______Y(选填“>”或“<”)。
(3)以上①~④的转化过程,其中需要加入氧化剂才能发生的是_______(填写编号)。
(4)根据“价-类”二维图可对物质性质进行分析和预测。当气体与气体混合时,可观察到的现象是_______;向溶液中通入氯气,反应的化学方程式为_______。
(5)①向试管中加入5 mL二氧化硫水溶液,滴加溶液,_______;
②继续滴加0.5 mL 3%的溶液,振荡,_________;
通过观察,①、②分别为_______(选填编号)。
A.产生白色沉淀;沉淀不溶解 B.无明显现象;产生白色沉淀
C.产生白色沉淀;沉淀溶解 D.无明显现象;无明显现象
综合题二
Ⅰ. 我国青海省的茶卡盐湖不仅风景优美,也是西北著名的盐湖之一,夏天,人们将湖水引入湖滩上晒出食盐。冬天,湖面上漂浮着大量的纯碱晶体(),人们可以直接从湖中捞碱。氯化钠和纯碱晶体的溶解度情况如下表所示:
温度溶解度/s 物质 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ |
NaCl | 35.7 | 35.8 | 35.9 | 36.1 | 36.4 |
7.3 | 13.6 | 24.9 | 52.9 | 70.8 |
(1)“冬天捞碱”的原理相当于实验室中的降温结晶法,“夏天晒盐”的原理相当于实验室中的_______法。
(2)为检验纯碱样品中是否含有NaCl,应使用的试剂是_______。A.溶液 B.稀盐酸、溶液
C.稀、溶液 D.稀、溶液
Ⅱ.为测定纯碱样品(含NaCl杂质)的质量分数,某同学先将样品配成溶液,通过实验测定溶液浓度,最后求出样品中纯碱晶体的质量分数。
(3)实验过程中使用到下列仪器,其中使用前必须检查是否漏水的有_______。
A. B. C. D.
(4)①第一步:配制100 mL样品溶液。
该同学配制溶液的部分过程如下,请写出中间步骤B的具体内容。_______
A.将蒸馏水缓慢注入容量瓶,直到液面接近刻度线l~2cm处。
B……
C.将容量瓶盖好,颠倒摇匀。
将溶液转移至容量瓶时用到了玻璃棒,其作用是_______。
②第二步:测定溶液浓度。
该同学量取样品溶液20.00 mL,与0.160 mol·L-1稀盐酸反应至完全转化为,消耗盐酸18.00 mL,写出该反应的离子方程式_______,通过实验,测出溶液的物质的量浓度为_______mol·L-1。
③第三步:求算样品中纯碱晶体的质量分数。
根据实验数据,欲求算纯碱晶体()的质量分数,还需要通过称量得到的物理量是_______。
④通过计算,该同学得出的实验结果偏高,可能的原因是_______。
A.未用蒸馏水洗涤烧杯内壁
B.容量瓶中原有少量水
C.摇匀后发现液面低于刻度线,补加少量水
D.定容时俯视液面
综合题三
实验小组将电导率传感器插入20.00 mL 0.1 mol·L-1 溶液中,向溶液中匀速滴入等浓度的溶液,电导率与溶液体积图像如图所示。(已知溶液导电性越强,电导率值越大)
(1)按物质分类,属于_______(选填“强电解质”或“弱电解质”)。
(2)其它条件相同的情况下,溶液的导电性由_______决定。
A.自由移动的离子浓度
B.自由移动的离子个数
C.自由移动离子的物质的量
(3)用离子方程式解释图中a→b段曲线变化的原因。_______
(4)对b、c两处溶液的进行比较,b_______c(选填“>”或“=”或“<”),说明原因_______。
(5)用等浓度的溶液替换溶液,则电导率最低点与图中b点的位置关系为_______。
A.在b上方 B.与b重合 C.在b下方 D.无法确定
(6)向0.1 mol·L-1氨水中,匀速滴入等浓度的醋酸溶液,下列图像正确的是_______。
A. B.
C. D.
(7)化学概念在逻辑上存在如图几种关系,下列说法一定正确的是_______。
A.包含关系:能导电的物质与电解质
B.包含关系:非电解质与化合物
C.并列关系:导电性强的物质与强电解质
D.交叉关系:强电解质与弱电解质
综合题四
海洋是地球的“聚宝盆”,蕴藏着丰富的化学资源,开发和利用海水资源是科学研究的一项重要任务。某化学学习小组对海水资源综合利用的设计流程如下图所示:
(1)初步提纯后的粗盐中含有、、等杂质,精制时所用的试剂有:a.盐酸 b.溶液 c.NaOH溶液 d.溶液。下列试剂添加顺序合理的是_______
A.bcda B.cdba C.dbac D.bdac
(2)实验室模拟氯碱工业进行步骤①,反应条件为_______。反应过程中向_______定向移动(选填编号), _______附近溶液先变红(选填编号)。
A.阴极,阴极 B.阳极,阳极 C.阴极,阳极 D.阳极,阴极
(3)丁溶液具有杀菌消毒的作用,请写出步骤②的化学方程式_______。
(4)下列图中白球代表丙原子、黑球代表氮原子,方框代表容器,容器中有一个可以上下滑动的隔板(隔板质量不计)。其中能表示等质量的丙气体与氮气的是_______。
A. B. C. D.
(5)盛放液溴的试剂瓶中要加入一定量的水,其目的是_______。
A.制得溴水 B.比较水和液溴的密度
C.防止液溴挥发 D.防止液溴变质
(6)若用来提取,步骤③所用的氧化剂的来源较合理的是_______。
A.从外地购买 B.在当地建厂生产 C.利用本流程的产物
(7)加碘盐中的“碘”指的是_______。
A.元素 B.原子 C.分子 D.单质
(8)实验室里进行步骤④,该操作过程若将四氯化碳注入含碘的水溶液,溶液分层,四氯化碳在_______(选填“上”或“下”)层,原因是_______。该步骤的实验原理是依据_______(选填编号),将混合物中的组分分开。
A.分散质粒子直径大小 B.溶质在两种溶剂中的溶解能力不同
C.溶剂沸点的差别 D.物质的聚集状态不同
(9)向NaBr和NaI的混合溶液中通入足量,然后加热将溶液蒸干并灼烧,最后残留的物质是_______。
A.NaCl B.NaCl、 C.NaCl、 D.NaCl、、
综合题五
氯及其重要化合物在生产生活中应用广泛,学习氯及其化合物的性质和变化,预测现象、解释问题、归纳规律,有利于了解物质性质及其变化规律。
某校化学兴趣小组设计下图装置制备纯净的氯气,并探究氯气及其化合物的性质。(装置中的夹持装置和加热装置均已略去)
(1)写出图中盛放浓盐酸的仪器名称_______,回形玻璃管的作用是_______。
(2)装置②的作用是除去氯气中的_______。
A. B.HCl C. D.
(3)装置④中导管_______(选填“x”或“y”)伸至靠近集气瓶底部。
(4)将装有干燥有色布条的玻璃管置于_______(选填编号),有色布条不褪色。
A.①、②之间 B.②、③之间 C.④、⑤之间
装置⑤的作用是_______。
(5)实验结束后,将燃着的铁丝伸入充满氯气的集气瓶,写出反应的化学方程式_______。取反应后的固体溶于水配成饱和溶液,分多次加入煮沸的蒸馏水,溶液呈_______色。将蘸有该溶液的棉线置于湿润的滤纸上,用导线连接湿润滤纸的两端,并与电源的正、负极相连(如下图所示),开启电源,预测实验现象_______,这种现象称为_______。
有一种“地康法”制取氯气的反应原理如图所示:
(1)反应Ⅰ属于_______。
A.置换反应 B.复分解反应 C.氧化还原反应
(2)反应Ⅱ在450℃时发生,写出反应Ⅱ的化学方程式,并标出电子转移的方向和数目_______,当生成标况下33.6升氯气时,消耗的还原剂为_______g。
(3)“地康法”曾经广泛用于制备氯气,但在经济效益上较电解法制氯气大为逊色,后来逐渐被电解法制氯气所取代,请分析可能的原因(写出一条即可)。_______。
8.是目前国际上公认的新一代高效、广谱、安全的杀菌。我国最近成功研制出制取的新方法,其反应的微观过程如图所示:
其中 表示Cl原子 表示Na原子 表示O原子
(1)试写出该反应的化学方程式_______,氧化剂是_______。
(2)将通入酸性淀性粉KI溶液,溶液变成蓝色,转化为氯离子,该反应是氧化还原反应,其中氧化产物是_______,试写出该反应的离子方程式(无需配平)。_______。
(3)通过以上信息,推测、NaClO2、三种物质氧化性强弱的顺序为_______。
化学参考答案
1、NH3,NO(各1 分)
2、还原性,B(各1 分)
3、NH3∙H2O⇌ NH4++OH-(2 分)
4、②(1 分)
5、NH4++OH-=NH3↑+H2O(条件“加热”),产生的气体能使湿润的红色石蕊试纸变蓝(或产
生的气体遇浓盐酸产生白烟)(各2 分)
6、SO2、SO3(各1 分)
7、>(1 分)
8、①(1 分)
9、产生黄色浑浊(器壁出现水珠)(1 分)。Na2SO3+Cl2+H2O=Na2SO4+2HCl(2 分)
10、B(2 分)
11、蒸发结晶(1 分)
12、C(2 分)
13、A(1 分)
14、改用胶头滴管滴加蒸馏水至溶液凹液面最低处与刻度线相切(2 分) 引流(1 分)
15、CO32-+2H+=H2O+CO2↑(2 分) 0.072(2 分)
16、样品质量(2 分)
17、D(2 分)
18、强电解质(1 分)
19、A(2 分)
20、SO42-+Ba2+=BaSO4↓(2 分)
21、>(2 分),H+的物质的量不变,随着氯化钡溶液的加入,溶液体积不断增大,[H+]逐渐
减小。(2 分)
22、C(2 分)
23、B(2 分)
24、B(2 分)
25、A(2 分)
26、通直流电(通电)(2 分),D(1 分)
27、Cl2+2NaOH=NaCl+NaClO+H2O(2 分)
28、D(2 分)
29、C(2 分)
30、C(1 分)
31、A(2 分)
32、下(1 分),四氯化碳密度大于水(1 分)。B(2 分)
33、A(2 分)
34、分液漏斗(1 分),平衡分液漏斗与圆底烧瓶内的压强,使浓盐酸顺利流出。(2 分)
35、B(1 分)
36、X(1 分)
37、C(1 分),吸收尾气(多余的氯气)(1 分)
38、2Fe+3Cl2=2FeCl3(条件“点燃”,2 分) 红褐色(1 分) 棉线与滤纸接触处的黄色
向b 方向移动(2 分) 电泳(2 分)
39、B(2 分)
40、2CuCl2+O2=2CuO+2Cl2 (条件“450℃”,电子转移的方向和数目略,3 分)202.5(2 分)
地康法原料HCl 比电解法原料NaCl 成本高(2 分)
42、Cl2+2NaClO2=2ClO2+NaCl(2 分) Cl2(1 分)
43、I2(1 分) ClO2+H++I-=I2+Cl-+H2O(2 分)
44、Cl2>ClO2>I2(1 分)
【说明】
简答题的得分点见红色字体
广东省深圳市龙华区2022-2023学年高一上学期期末学业质量监测化学试题(Word版含答案): 这是一份广东省深圳市龙华区2022-2023学年高一上学期期末学业质量监测化学试题(Word版含答案),共11页。试卷主要包含了本卷所需相对原子质量等内容,欢迎下载使用。
湖南省娄底市新化县2022-2023学年高一上学期期末质量监测化学试题(Word版含答案): 这是一份湖南省娄底市新化县2022-2023学年高一上学期期末质量监测化学试题(Word版含答案),共10页。试卷主要包含了5 Mn 55, 下列叙述中,不正确的是等内容,欢迎下载使用。
辽宁省葫芦岛市2022-2023学年高二上学期期末学业质量监测化学试题(Word版含答案): 这是一份辽宁省葫芦岛市2022-2023学年高二上学期期末学业质量监测化学试题(Word版含答案),文件包含辽宁省葫芦岛市2022-2023学年高二上学期期末学业质量监测化学试题docx、高二化学答案docx等2份试卷配套教学资源,其中试卷共9页, 欢迎下载使用。












