

2021-2022学年湖北省宜昌市第一中学高一(下)阶段性测试化学试卷(6月)(含答案解析)
展开2021-2022学年湖北省宜昌市第一中学高一(下)阶段性测试化学试卷(6月)
1. 中华优秀传统文化涉及了很多化学知识。下列有关说法错误的是( )
A. 《神农本草经》中“石胆……能化铁为铜、成金银”描述的是湿法炼铜
B. 刘长卿诗云“水声冰下咽,砂路雪中平”,固态冰转化为液态水需要吸热
C. “火树银花合,星桥铁锁开”中涉及化学能转化为热能和光能
D. 《本草纲目拾遗》中对强水的记载:“性最猛烈,能蚀五金”强水为电解质
2. 2020年6月5日,新冠病毒蛋白结构模型资源库的面世可以帮助科学家更好地了解新冠病毒,促进新冠肺炎药物和疫苗的研发工作,但是新冠病毒个人预防措施不能松懈。下列说法错误的是( )
A. 每天最好用肥皂洗手,肥皂是由高分子化合物油脂在碱性条件水解得到的
B. 出门要带口罩,口罩原料无纺布成分是聚对苯二甲酸乙二醇酯,属于合成纤维
C. 可以用的酒精对手机、键盘和皮肤消毒,原理是酒精可以使蛋白质变性
D. 葡萄酒中通常添加少量的,既可以杀菌,又可以防止营养成分被氧化
3. 已知维生素C的结构简式如图,下列有关维生素C的说法不正确的是( )
A. 和乙醇互为同系物 B. 含有两种含氧官能团
C. 分子式为 D. 既能与金属钠反应又能与溴水反应
4. 已知化学反应的能量变化如图所示,判断下列叙述中正确的是( )
A. 该反应有可能是放热反应
B. 和反应生成吸收的热量为
C. 该反应中反应物的总能量高于生成物的总能量
D. 断裂和键,放出a kJ能量
5. 氮及其化合物的“价-类”二维图如下所示。
下列说法不正确的是( )
A. 从物质类别角度分析,P和Z都属于酸性氧化物
B. 将转化为Q的过程属于氮的固定
C. 可用氧化钙固体和浓氨水不加热来制取X
D. 与的Y溶液恰好完全反应,生成NO、混合气体标准状况,则Y溶液的体积为15mL
6. 下列离子方程式书写正确的是( )
A. 过量的铁粉与稀硝酸反应:
B. 实验室用氢氧化钙与氯化铵制备氨气:
C. 向溶液中加入过量氨水:
D. 将通入溶液产生黄色沉淀:
7. W、X、Y和Z在周期表中的相对位置如图所示,其中元素Z位于第四周期,W、X、Y原子的最外层电子数之和为18。下列说法正确的是( )
| W |
|
|
|
| X | Y |
Z |
|
|
|
A. 氧化物对应水化物酸性:
B. W的最高价氧化物对应水化物与W的简单氢化物反应生成的化合物中含有离子键、共价键
C. 将HY通入溶液中产生气体,说明非金属性Y比X强
D. 推测Z的单质是半导体材料,Z与Y不能形成化合物
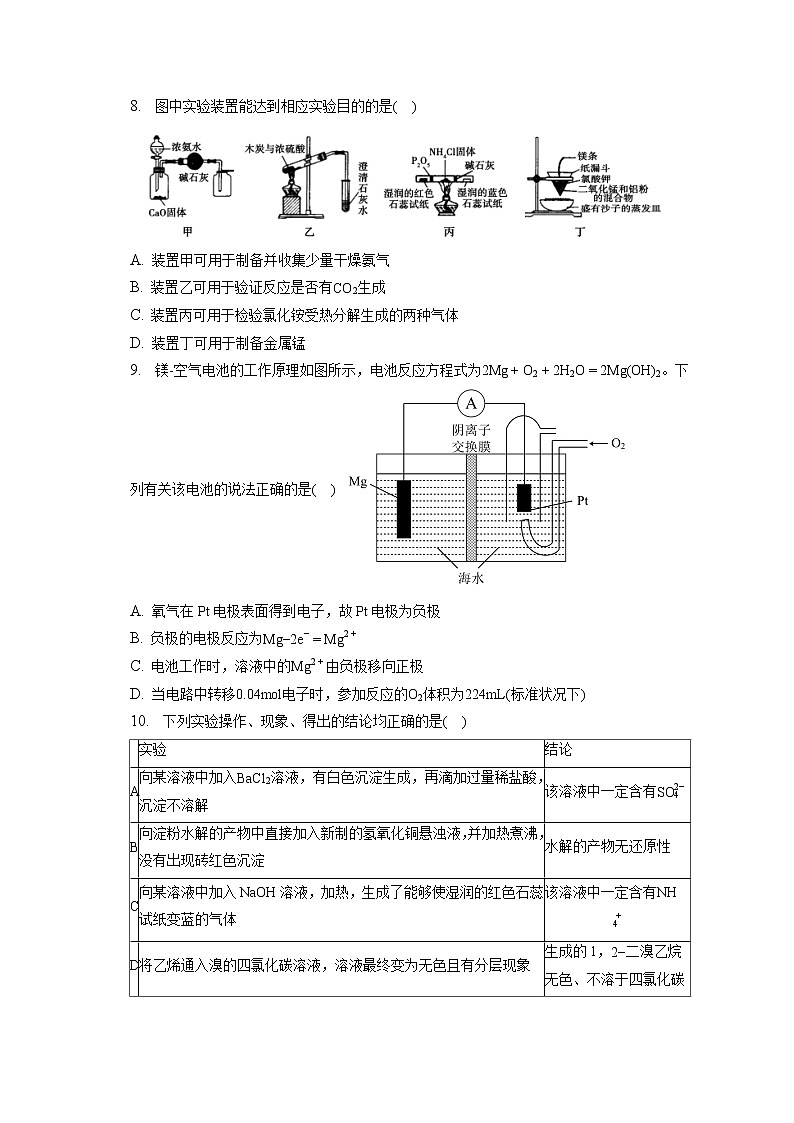
8. 图中实验装置能达到相应实验目的的是( )
A. 装置甲可用于制备并收集少量干燥氨气
B. 装置乙可用于验证反应是否有生成
C. 装置丙可用于检验氯化铵受热分解生成的两种气体
D. 装置丁可用于制备金属锰
9. 镁-空气电池的工作原理如图所示,电池反应方程式为。下列有关该电池的说法正确的是( )
A. 氧气在Pt电极表面得到电子,故Pt电极为负极
B. 负极的电极反应为
C. 电池工作时,溶液中的由负极移向正极
D. 当电路中转移电子时,参加反应的体积为标准状况下
10. 下列实验操作、现象、得出的结论均正确的是( )
| 实验 | 结论 |
A | 向某溶液中加入溶液,有白色沉淀生成,再滴加过量稀盐酸,沉淀不溶解 | 该溶液中一定含有 |
B | 向淀粉水解的产物中直接加入新制的氢氧化铜悬浊液,并加热煮沸,没有出现砖红色沉淀 | 水解的产物无还原性 |
C | 向某溶液中加入NaOH溶液,加热,生成了能够使湿润的红色石蕊试纸变蓝的气体 | 该溶液中一定含有 |
D | 将乙烯通入溴的四氯化碳溶液,溶液最终变为无色且有分层现象 | 生成的1,二溴乙烷无色、不溶于四氯化碳 |
A. A B. B C. C D. D
11. 海水开发利用的部分过程如图所示。下列有关说法不正确的是( )
A. 海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等
B. 将氯气通入苦卤中发生反应的离子方程式为
C. 在工业上一般采用电解溶液的方法得到金属镁单质
D. 海水晒盐是利用了蒸发结晶的原理,属于物理变化
12. 恒温时向2 L密闭容器中通入一定量的气体X和Y,发生反应:⇌,Y的物质的量随时间t变化的曲线如图所示。下列说法正确的是( )
A. 正反应速率a点比b点小
B. 时该反应停止反应
C. 时,
D. 当密闭容器中的压强不再变化,该可逆反应达到了化学平衡状态
13. 下列各组离子在指定溶液中一定能大量共存的是( )
A. 无色透明溶液:、、、
B. 能使石蕊溶液变红的溶液:、、、
C. 的溶液:、、、
D. 能与铝反应产生的溶液:、、、
14. 一瓶无色气体,可能含有HCl、、、HBr、、中的一种或几种,将其通入氯水中,得无色透明溶液,将该溶液分成两份,一份加盐酸酸化的溶液,析出白色沉淀;另一份加硝酸酸化的硝酸银溶液,也有白色沉淀生成。下面结论正确的是( )
①原气体中肯定有②原气体中可能有③原气体中肯定无、HBr、 ④不能肯定是否含有HCl ⑤原气体中肯定不含⑥原气体中肯定含HCl
A. ①③④ B. ①④⑤ C. ①③⑥ D. ①③④⑤⑥
15. 某温度下,将等物质的量的气体A、B混合于2L的密闭容器中,发生如下反应:,经后测得C的浓度为,B的物质的量分数为,以D表示的反应速率,下列说法正确的是( )
A. 时,A的反应速率为
B. 时,B的物质的量浓度为
C. 化学方程式中,
D. 反应前后容器内气体的压强之比为1﹕
16. 写出下列反应的离子方程式:
自然界中Cr主要以价和价形式存在。中的Cr能引起细胞的突变,可以用亚硫酸钠在酸性条件下将还原。写出反应的离子方程式:_______。
常温下,氰化钠能与过氧化氢溶液反应,生成一种酸式盐和一种能使湿润的红色石蕊试纸变蓝色的气体,大大降低其毒性。写出该反应的离子方程式:_______。
连二亚硫酸钠常作木浆造纸的漂白剂。向甲酸钠与的混合溶液中通入气体,可得到连二亚硫酸钠及一种可用作灭火剂的气体,相应的化学反应的离子方程式为_______,碱性条件下连二亚硫酸钠溶液与溶液反应可得到单质银,相应的离子方程式为_______。
煤燃烧排放的烟气含有和,形成酸雨,污染大气,采用溶液作为吸收剂可同时对烟气进行脱硫、脱硝。在鼓泡反应器中通入含有和NO的烟气,写出溶液脱硝主要转化为过程中主要反应的离子方程式:_______。
17. 无水三氯化铁是有机合成的催化剂,为棕黄色固体,易潮解产生白雾,左右时升华。实验室可用氯气与铁反应制备无水三氯化铁,图为甲组学生设计的制备装置。回答下列问题:
仪器a的名称是___________;装置B的作用是___________,C中盛装试剂是___________。
装置A中发生反应的离子方程式为___________。
装置D与E之间用较粗的导气管连接,原因是___________;点燃装置D处酒精灯时应先将空气排尽,原因是___________。
装置F的作用是___________。
与甲组设计对比,乙组同学去掉了装置其它操作不变。实验时无论怎样改变铁粉的用量,装置D中都有少量的黑色固体残留。乙组同学猜测该黑色固体可能是___________,其依据是用化学方程式表示___________。
18. FeOOH为一种不溶于水的黄色固体,在染料工业中有重要的作用。某工厂以:废料含少量、FeO等为原料制备FeOOH,流程如图所示:
回答下列问题:
为提高“酸浸”的速率,可采取的措施有___________、___________任填两种。
“废渣”的主要成分为___________填化学式。
“酸浸”不宜将稀换成稀的原因是___________。
“试剂X”宜选择的是___________选填序号。
A.双氧水 铁粉 氯水
向“滤液2”中加入乙醇即可析出晶体,乙醇的作用是___________。从“滤液2”中获得晶体的另一种方法是:蒸发浓缩、___________、过滤、洗涤。
由转化为FeOOH的离子方程式是___________。
“滤液4”中,溶质的主要成分为___________填化学式。
19. 已知A是石油化工发展水平的重要标志,常在汽油中加入适量B作为汽车燃料,可以节约石油资源,并减少汽车尾气对空气的污染。根据下面的转化关系回答下列问题:
已知溴苯是重要的医药中间体。反应①的反应类型为___________,制得的溴苯中通常含有少量的苯,提纯溴苯的实验操作是___________。
的结构简式为___________,C中含有官能团的名称为___________、___________。
葡萄糖转化为B的化学方程式为___________。
鉴别苯和丙烯酸乙酯,可选用的试剂是___________。
已知丙烯酸乙酯具有刺鼻的辛辣气味,可用作制造涂料黏合剂、纺织助剂等。某实验小组用以下装置制备丙烯酸乙酯:
①球形干燥管c除起冷凝作用外,它的另一重要作用是___________。
②待收集到一定量产物后停止加热,取下试管b并振荡、静置,可观察到___________填实验现象。
③分离试管b中的液体混合物,采用的方法为___________。
答案和解析
1.【答案】D
【解析】A.“石胆……能化铁为铜、成金银”中涉及的反应为铁与硫酸铜溶液发生置换反应生成铜,该反应是湿法炼铜的反应原理,故A正确;
B.固态冰转化为液态水需要吸收热量,克服水分子间的氢键和分子间作用力,故B正确;
C.“火树银花合”中涉及了物质的燃烧反应,物质燃烧时化学能转化为热能和光能,故C正确;
D.“性最猛烈,能蚀五金”的强水为硝酸溶液,溶液是混合物,既不是电解质也不是非电解质,故D错误;
故选:D。
2.【答案】A
【解析】A.油脂是高级脂肪酸酯,不属于高分子化合物,A错误;
B.聚对苯二甲酸乙二醇酯又名聚酯纤维,是目前世界上产量最高的合成纤维,B正确;
C.的酒精可以使蛋白质变性,因此可以用的酒精对手机、键盘和皮肤消毒,C正确;
D.既可以杀菌,又可以防止营养成分被氧化,故用于葡萄酒中,故D正确;
答案选A。
3.【答案】A
【解析】A.同系物是结构相似,在分子组成上相差一个或若干个原子团的化合物,维生素C和乙醇结构不相似,且不是差了若干个原子团,故两者不互为同系物,A错误;
B.维生素C中含有羟基和酯基两种含氧官能团,B正确;
C.根据结构可知,维生素C的分子式为,C正确;
D.维生素含有羟基,可以和金属钠反应生成氢气,含有碳碳双键,能与溴水发生加成反应,D正确;
故选:A。
4.【答案】B
【解析】A.由图可知,生成物的总能量大于反应物的总能量,该反应为吸热反应,A项错误;
B.该反应为吸热反应,和反应生成吸收的热量为,B项正确;
C.由图可知,生成物的总能量高于反应物的总能量,C项错误;
D.断裂化学键吸收能量,根据图示可知断裂和键,吸收a kJ能量,D项错误;
答案选B。
5.【答案】A
【解析】
【分析】
由图可知,X为N的氢化物,Q为N的价氧化物NO,Z为N的价氧化物,P为N的价氧化物,Y为N的价含氧酸,W为N的价碱。
【解答】
A.为酸性氧化物,和水反应生成和NO,不是酸性氧化物,故A错误;
B.氮的固定指的是游离态的氮转化为化合态氮的过程,则将转化为NO的过程属于氮的固定,故B正确;
C.X为氨气,可用氧化钙固体溶解放热,使浓氨水产生氨气,该反应不加热也能实现,故C正确;
D.的物质的量为,生成NO、混合气体在标况下的物质的量为,设NO的物质的量是xmol,的物质的量是ymol,;,解得,,由原子守恒可知气体,,故D正确;
故选:A。
6.【答案】C
【解析】A.过量的铁粉与稀硝酸反应生成亚铁离子、NO和水,正确离子方程式为:,A项错误;
B.实验室用氢氧化钙与氯化铵制备氨气,采用固固加热型,不能书写离子反应方程式,B项错误;
C.向溶液中加入过量的氨水生成氢氧化铝沉淀和氯化铵:,C项正确;
D.将通入溶液产生黄色沉淀,其中为弱电解质,正确离子方程式为:,D项错误;
答案选C。
7.【答案】B
【解析】
【分析】
设W原子的最外层电子数为a,由周期表中的相对位置可知,X、Y原子的最外层电子数分别为、,由W、X、Y原子的最外层电子数之和为18可得:,解得,则W为N元素、X为S元素、Y为Cl元素、Z为Ge元素。
【解答】
A.硝酸是氮元素的氧化物对应水化物,在溶液中完全电离,属于强酸,亚硫酸是硫元素的氧化物对应水化物,在溶液中部分电离,属于弱酸,则硝酸的酸性强于亚硫酸,故A错误;
B.硝酸与氨气反应生成硝酸铵,硝酸铵是含有离子键和共价键的离子化合物,故B正确;
C.元素的非金属性强弱与氢化物的稳定性有关,与氢化物的酸性无关,则盐酸的酸性强于氢硫酸不能说明氯元素的非金属性强于硫元素,故C错误;
D.锗位于金属与非金属分界线附近,单质是良好半导体材料,但锗能与氯气反应生成四氯化锗,故D错误;
故选:B。
8.【答案】D
【解析】A.氨气密度比空气小,故应该用向下排空气法收集氨气,A项错误;
B.二氧化硫和二氧化碳均能使澄清石灰水变浑浊,故无法验证是否有二氧化碳生成,B项错误;
C.左侧的五氧化二磷是为了让酸性气体从左侧流出,右侧碱石灰是为了让碱性气体从右侧流出,故装置中检验气体酸碱性的石蕊试纸放反了,C项错误;
D.与铝热反应相似,装置丁可用于制备金属锰,D项正确;
答案选D。
9.【答案】D
【解析】A.氧气在Pt电极表面得到电子,发生还原反应,所以通入氧气的电极为正极,选项A错误;
B.负极镁失电子变成镁离子,与正极移过来的氢氧根离子结合生成氢氧化镁,所以电极反应式为:,选项B错误;
C.原电池中阴离子向负极移动,所以溶液中的由正极移向负极,和均不能通过阴离子交换膜,选项C错误;
D.根据电池反应,当电路中转移电子时,参加反应的体积为标准状况下,选项D正确。
答案选D。
10.【答案】C
【解析】A.原溶液中可能有,产生氯化银沉淀,故A错误;
B.向淀粉水解的产物中加入新制的氢氧化铜悬浊液前,要先加NaOH溶液将用作催化剂的硫酸中和,至溶液呈碱性,否则,硫酸会和新制的氢氧化铜悬浊液反应,故B错误;
C.向某溶液中加入氢氧化钠溶液,加热产生的气体能使湿润的红色石蕊试纸变蓝说明生成的气体为氨气,溶液中含有铵根离子,故C正确;
D.将乙烯通入溴的四氯化碳溶液,乙烯和发生加成反应生成1,二溴乙烷,1,二溴乙烷无色,可溶于四氯化碳,故D错误;
故选:C。
11.【答案】C
【解析】A.海水淡化方法主要有:蒸馏法、反渗透法、电渗透法、离子交换法等,A正确;
B.向苦卤中通入置换出溴单质,分离得到溴,通入是为了提取溴,离子方程式为 ,B正确;
C.在工业上一般采用电解熔融的方法得到金属镁,C错误;
D.海水晒盐是根据NaCl的溶解度受温度的影响变化较小,通过蒸发溶剂而使溶质结晶析出,在该过程中没有产生新的物质,因此发生的变化属于物理变化,D正确;
故合理选项是C。
12.【答案】C
【解析】A.反应开始加入一定量的气体X和Y,则反应从正反应方向进行,随着反应的进行,正反应速率越来越小,到平衡时达到最小值,则根据图示可知a点的正反应速率大于b点的正反应速率,A错误;
B.可逆反应从b点开始达到平衡,化学平衡为动态平衡,此时反应仍然在进行,正反应速率等于逆反应速率,反应继续进行,B错误;
C.从图像中可以看出,从反应开始到平衡,参加反应的Y的物质的量为,根据物质反应转化关系可知:生成的Z的物质的量为,由于容器的容积是2 L,因此 时,,C正确;
D.该反应是一个反应前后气体物质的量不变的反应,体系的压强始终不变,因此不能根据压强不变判断反应是否达到平衡状态,D错误;
故合理选项是C。
13.【答案】B
【解析】A.高锰酸根为紫色,A错误;
B.能使石蕊溶液变红的溶液为酸性溶液,四种离子可共存,B正确;
C.次氯酸钠溶液具有强氧化性,能把硫离子和氯离子氧化,C错误;
D.能与铝反应产生的溶液可能为酸性或碱性溶液,碳酸氢根在酸性或碱性溶液中均不能存在,D错误;
故选:B。
14.【答案】A
【解析】
【分析】
因HCl、、、HBr、、六种气体中,为红棕色,其它气体均为无色,所以可据此判断是否存在。当通入氯水,溶液无色透明,说明该气体中不含和HBr,因黄色沉淀、溴水橙黄色,均有明显的现象。当将反应后的溶液分成两份,一份加盐酸酸化的溶液,析出白色沉淀,说明溶液中有硫酸根,是由被氯水氧化所致;另一份加硝酸酸化的硝酸银溶液,也有白色沉淀生成,可能是氯水氧化后生成的氯离子所致,据此判断。
【解答】
气体为无色,说明没有;通入氯水中,得无色透明溶液,说明没有和HBr;向反应后的溶液中加入盐酸酸化的氯化钡溶液,析出白色沉淀,说明有,但由于这份溶液提前加入过氯水,所以虽能使硝酸酸化的硝酸银溶液产生白色沉淀,但无法确定HCl是否存在。因没有明显的实验现象证明的存在,故不能确定是否存在。答案选A。
【点睛】本题综合考查了HCl、、、HBr、、六种物质的物理性质及特征性反应。需要特别注意的是前一步反应所产生的物质对后面实验现象的影响。例如,在本题中因在第二步实验中通入了氯水,引入了氧化性试剂和氯离子,虽能与硝酸酸化的硝酸银溶液产生白色沉淀,但是无法确定HCl是否存在。
15.【答案】B
【解析】
【分析】
设等物质的量A、B均为a mol,由题干信息结合三段式分析如下:,,故,,解得:,据此分析解题。
【解答】
A.根据反应速率之比等于化学计量系数之比,故时,A的反应速率等于D的反应速率的一半,则为,不是,故A错误;
B.由分析可知,时,B的物质的量为,浓度为,故B正确;
C.由分析可知,化学方程式中,故C错误;
D.根据同温同体积下,气体的压强之比等于其物质的量之比,,故反应前后气体的物质的量不变,故反应前后容器内气体的压强之比为1:1,故D错误;
本题答案B。
16.【答案】
;
【解析】亚硫酸钠在酸性条件下将还原为三价铬离子,自身被氧化为硫酸根,离子方程式为:;
氰化钠与过氧化氢溶液反应生成一种酸式盐和一种能使湿润的红色石蕊试纸变蓝色的气体,该气体为氨气,酸式盐为碳酸氢钠,离子方程式为:;
可用作灭火剂的气体为,根据原子守恒可知还有水生成,发生反应的离子方程式为:,碱性条件下连二亚硫酸钠溶液与溶液反应可得到单质银,连二亚硫酸根被氧化为硫酸根,相应的离子方程式为:;
脱硝反应中NO转化为硝酸根,氧化剂被还原得到氯离子,故离子方程式为:。
17.【答案】分液漏斗;除去氯气中的HCl;浓硫酸
由于蒸气冷凝变成固体时容易发生堵塞玻璃导管现象,所以用较粗的导气管;防止Fe粉与装置中空气里含有的氧气发生反应
吸收尾气中的未反应的,防止污染空气,同时防止空气中的水蒸气进入装置E中
;
【解析】
【分析】
利用二氧化锰和浓盐酸反应制取氯气,氯气中含有氯化氢和水蒸气,对氯气和铁反应有影响,因此先用饱和食盐水除去氯化氢,再用浓硫酸除去水蒸气,氯气和铁反应生成氯化铁,最后用碱石灰进行尾气处理,防止氯气进入空气中污染空气。据此解答。
【解答】
仪器a的名称是分液漏斗;装置B的作用是除去氯化氢气体,C中盛装试剂是浓硫酸。
装置A中发生反应的离子方程式为。
装置D与E之间用较粗的导气管连接,原因是由于蒸气冷凝变成固体时容易发生堵塞玻璃导管现象,所以用较粗的导气管;点燃装置D处酒精灯时应先将空气排尽,原因是防止Fe粉与装置中空气里含有的氧气发生反应。
装置F的作用是吸收尾气中的未反应的,防止污染空气,同时防止空气中的水蒸气进入装置E中。
与甲组设计对比,乙组同学去掉了装置其它操作不变。铁和水蒸气反应生成四氧化三铁,方程式为:。
18.【答案】粉碎;升温适当增加硫酸浓度等
稀硝酸具强氧化性,易与反应生成污染性气体或降低产率
降低溶解度;冷却结晶
【解析】固液反应时,接触面积越大反应越充分、化学反应速率越快,温度越高化学反应速率越快。则为加快化学反应速率、为提高“酸浸”的速率,可采取的措施有粉碎、升温、适当增加硫酸浓度等任填两种。
二氧化硅不溶于硫酸,则酸溶、过滤所得“废渣”的主要成分为。
“酸浸”过程使氧化铁、氧化亚铁转变为铁离子、亚铁离子,不宜将稀换成稀的原因是稀硝酸具强氧化性,易与反应生成污染性气体或降低产率。
“试剂X”用于将铁离子还原为亚铁离子,则:
A.双氧水具有强氧化性,能将亚铁离子氧化为铁离子,不满足;
B.铁粉具有还原性,能将铁离子还原为亚铁离子,且不引入杂质,满足;
C.氯水具有强氧化性,能将亚铁离子氧化为铁离子,不满足;
则宜选择的是B。
“滤液2”为硫酸亚铁溶液,“滤液2”中加入乙醇即可析出晶体,则乙醇的作用是降低溶解度。是一种结晶水合物,从“滤液2”中获得晶体的另一种方法是:蒸发浓缩、冷却结晶、过滤、洗涤。
由流程知,由转化为FeOOH的反应是氧化还原反应,碱性条件下,氧气将亚铁离子氧化,则离子方程式是。
绿矾在空气中与NaOH溶液可发生 ,过滤后,所得“滤液4”中溶质的主要成分为。
19.【答案】取代反应;蒸馏
;碳碳双键;羧基
酸性高锰酸钾溶液等
①防止倒吸 ②液体分为两层,上层为无色油状液体,且闻到果味香 ③分液
【解析】
【分析】
A是石油化工发展水平的重要标志,所以A为乙烯;常在汽油中加入适量B作为汽车燃料,B为乙醇;苯与液溴、铁作催化剂发生取代反应生成溴苯;乙烯水化制备乙醇,属于加成反应,纤维素或淀粉发酵后得到葡萄糖,葡萄糖在酶的作用下产生酒精;丙烯发生催化氧化生成C;C与乙醇发生反应生成丙烯酸乙酯,据其结构分析可知,C为羧酸,结构简式为:,据以上分析解答。
【解答】
苯与液溴、铁作催化剂发生取代反应生成溴苯,反应①的反应类型为取代反应;制得的溴苯中通常含有少量的苯,苯与溴苯互溶,但是沸点不同,可以采用蒸馏的方法提纯溴苯;
为乙烯,结构简式为,C为羧酸,结构简式为:,C中含有官能团的名称为碳碳双键和羧基;
葡萄糖转化为乙醇的化学方程式为;
丙烯酸乙酯中含有碳碳双键,苯不含碳碳双键,因此可以用酸性高锰酸钾溶液来检验,丙烯酸乙酯能够使酸性高锰酸钾溶液褪色而苯不能,因此可选用的试剂是酸性高锰酸钾溶液等;
①丙烯酸乙酯中混有乙醇和丙烯酸,二者易溶于水,丙烯酸能够与碳酸钠反应,易产生倒吸,使用球形干燥管,球形部分空间大,液面上升时可缓冲,所以球形干燥管c除起冷凝作用外,它的另一重要作用是防止倒吸;
②丙烯酸乙酯的密度小于水的密度,且在饱和碳酸钠溶液中溶解度较小;丙烯酸乙酯中混有乙醇和丙烯酸,通过碳酸钠溶液后,杂质被吸收,充分振荡静置后,液体分为两层,上层为无色油状液体,且闻到果味香;
③丙烯酸乙酯在饱和碳酸钠溶液中溶解度较小,不溶于饱和碳酸钠溶液,充分振荡静置后分层,分离试管b中的液体混合物,采用的方法为分液。
2021-2022学年湖北省宜昌一中、荆州中学、龙泉中学三校高二(下)阶段性检测化学试卷(3月)(含答案解析): 这是一份2021-2022学年湖北省宜昌一中、荆州中学、龙泉中学三校高二(下)阶段性检测化学试卷(3月)(含答案解析),共16页。试卷主要包含了 下列化学用语表示正确的是, 下列说法不正确的是等内容,欢迎下载使用。
2021-2022学年湖北省宜昌市夷陵中学2021-2022学年高二(下)诊断性检测(二)化学试卷(含答案解析): 这是一份2021-2022学年湖北省宜昌市夷陵中学2021-2022学年高二(下)诊断性检测(二)化学试卷(含答案解析),共18页。试卷主要包含了 下列有关说法错误的是, 下列说法不正确的是,3kJ⋅ml−1等内容,欢迎下载使用。
2021-2022学年湖北省襄阳市襄州第一高级中学高一(下)月考化学试卷(2月份)(含答案解析): 这是一份2021-2022学年湖北省襄阳市襄州第一高级中学高一(下)月考化学试卷(2月份)(含答案解析),共18页。试卷主要包含了5ml电子, 下列离子能够大量共存的有等内容,欢迎下载使用。













