
广东省深圳市2020届-2022届高考化学三年模拟(二模)试题汇编-非选择题1
展开广东省深圳市2020届-2022届高考化学三年模拟(二模)试题汇编-非选择题1
一、原理综合题
1.(2020·广东深圳·统考二模)以CH4、CO2为原料合成乙酸,是综合开发温室气体资源的新方向。
I.CH4.CO2催化重整间接制乙酸
CH4、CO2催化重整制合成气,再利用合成气制乙酸,涉及的反应如下:
反应l:CH4(g)+CO2(g) ⇌2H2(g)+2CO(g)△H
反应2:2H2(g)+CO(g) ⇌CH3OH(g)△H=-90.9kJ·mol-1
反应3:CH3OH(g)+CO(g) ⇌CH3COOH(g)△H=-118.2kJ·mol-1
(1)已知:CH4(g)+CO2(g) ⇌ CH3COOH(g)△H=+37.9kJ·mol-1则“反应l”的△H=_________
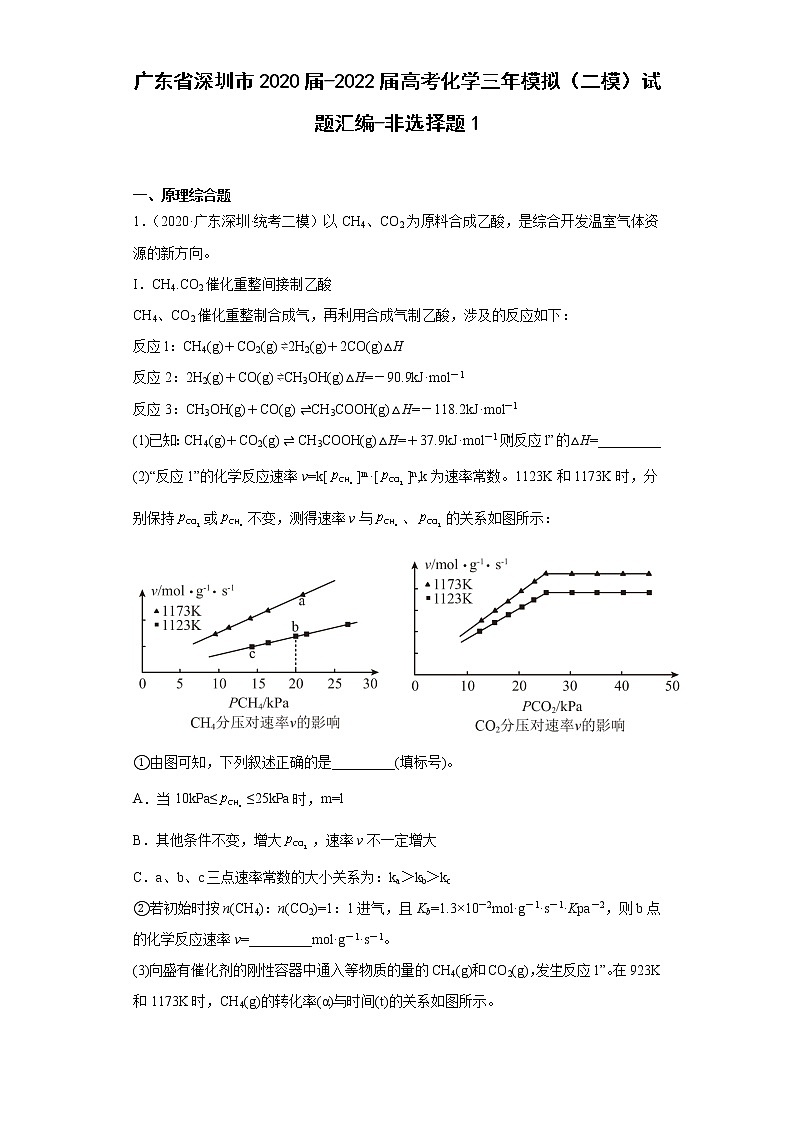
(2)“反应1”的化学反应速率v=k[]m·[]n,k为速率常数。1123K和1173K时,分别保持或不变,测得速率v与、的关系如图所示:
①由图可知,下列叙述正确的是_________(填标号)。
A.当10kPa≤≤25kPa时,m=l
B.其他条件不变,增大,速率v不一定增大
C.a、b、c三点速率常数的大小关系为:ka>kb>kc
②若初始时按n(CH4):n(CO2)=1:1进气,且Kb=1.3×10-2mol·g-1·s-1·Kpa-2,则b点的化学反应速率v=_________mol·g-1·s-1。
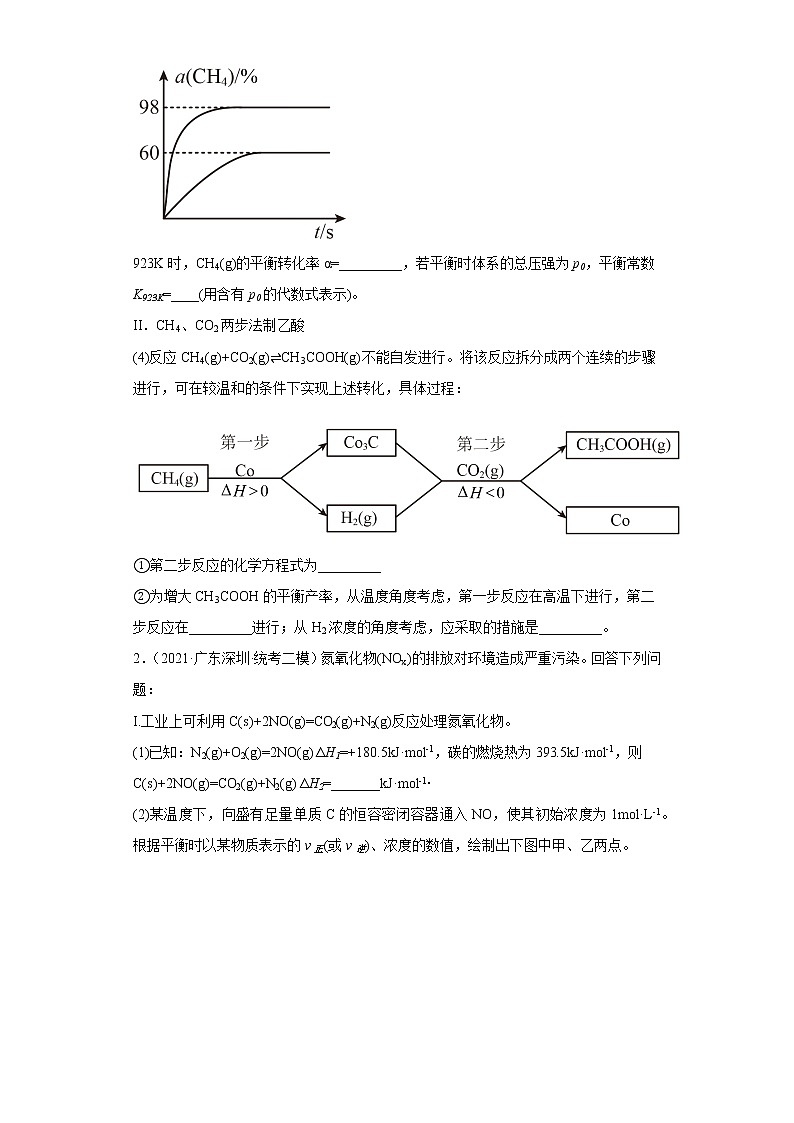
(3)向盛有催化剂的刚性容器中通入等物质的量的CH4(g)和CO2(g),发生“反应1”。在923K和1173K时,CH4(g)的转化率(α)与时间(t)的关系如图所示。
923K时,CH4(g)的平衡转化率α=_________,若平衡时体系的总压强为p0,平衡常数K923K=____(用含有p0的代数式表示)。
II.CH4、CO2两步法制乙酸
(4)反应CH4(g)+CO2(g)⇌CH3COOH(g)不能自发进行。将该反应拆分成两个连续的步骤进行,可在较温和的条件下实现上述转化,具体过程:
①第二步反应的化学方程式为_________
②为增大CH3COOH的平衡产率,从温度角度考虑,第一步反应在高温下进行,第二步反应在_________进行;从H2浓度的角度考虑,应采取的措施是_________。
2.(2021·广东深圳·统考二模)氮氧化物(NOx)的排放对环境造成严重污染。回答下列问题:
I.工业上可利用C(s)+2NO(g)=CO2(g)+N2(g)反应处理氮氧化物。
(1)已知:N2(g)+O2(g)=2NO(g) ΔH1=+180.5kJ·mol-1,碳的燃烧热为393.5kJ·mol-1,则C(s)+2NO(g)=CO2(g)+N2(g) ΔH2=_______kJ·mol-1。
(2)某温度下,向盛有足量单质C的恒容密闭容器通入NO,使其初始浓度为1mol·L-1。根据平衡时以某物质表示的v正(或v逆)、浓度的数值,绘制出下图中甲、乙两点。
①乙点对应的物质是___(填化学式);该反应的平衡常数为____。
②将温度降低至某一温度时,反应重新达到平衡,此时体系的压强为p=105Pa,NO的体积分数为30%,则N2的分压为p(N2)=____Pa(分压=总压×物质的量分数);则图中甲点可能移动至____点位置(填字母标号)。
II.原煤经热解、冷却得到的煤焦可用于NO的脱除。热解温度为500℃、900℃得到的煤焦分别用S-500、S-900表示,相关信息如下表:
煤焦
元素分析(%)
比表面积(cm2∙g-1)
C
H
S-500
80.79
2.76
105.69
S-900
84.26
0.82
8.98
将NO浓度恒定的废气以固定流速通过如下反应器。不同温度下,进行多组平行实验,测定相同时间内NO的出口浓度,可得NO的脱除率与温度的关系如下图所示。[已知:NO的脱除主要含吸附和化学还原(ΔH<0)两个过程。]
(3)已知煤焦表面存在的官能团有利于NO的吸附,其数量与煤焦中氢碳质量比的值密切相关。由图可知,相同温度下,S-500对NO的脱除率比S-900的高,结合表格数据分析其可能原因是___、___。
(4)350℃后,随着温度升高,NO的脱除率增大的原因是____。
3.(2022·广东深圳·统考二模)CO、CO2加氢有利于缓解化石能源消耗,实现“碳中和”.该体系主要涉及以下反应:
反应I:CO(g)+2H2(g)CH3OH(g) ΔH1<0
反应II:2CO(g)+4H2(g)C2H5OH(g)+H2O(g) ΔH2<0
反应III:2CO2(g)+6H2(g)C2H5OH(g)+3H2O(g) ΔH3<0
反应IV:CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH4<0
反应V:2CH3OH(g)C2H5OH(g)+H2O(g) ΔH5
回答下列问题:
(1)上述反应中,ΔH5=____(写出一个代数式即可)。
(2)密闭容器中,上述反应体系在一定条件下建立平衡后,下列描述正确的有____(填标号)。
A.加入催化剂,可提高CO2的平衡转化率
B.降低温度,反应Ⅱ的正反应速率增大,逆反应速率减小
C.增大CO的浓度,反应Ⅲ、IV的平衡均向左移动
D.恒温恒容充入氩气,反应Ⅰ、Ⅱ的平衡不移动
(3)恒容下,n(CO)=n(CO2)=1mol,并按照不同氢碳比[]投料,发生上述反应。图甲表示不同氢碳比时,[CO+CO2]的总平衡转化率随温度变化的关系;图乙表示氢碳比=3时,平衡后体系中C2H5OH、CH3OH的选择性随温度变化的关系。
已知:CH3OH的选择性=×100%;C2H5OH的选择性=×100%
①图甲中x____3(填“大于”“小于”或“等于”),其原因是____。
②Q点对应的体系中n(CH3OH)=___mol;此时,H2转化了4mol,则反应2CH3OH(g)C2H5OH(g)+H2O(g)的平衡常数Kp=____(Kp为以分压表示的平衡常数,分压=总压×物质的量分数,结果保留两位有效数字)。
(4)常温常压下,以Ag为催化剂,在酸性水溶液中将CO2电催化还原为CO的反应历程如图所示:
①据图,CO和CO2相比,____(填化学式)更稳定。
②吸附在催化剂表面上的物种用*标注,图中第一步反应为CO2+e-+H+=*COOH,则第二步反应为____。
二、工业流程题
4.(2020·广东深圳·统考二模)Pd/A12O3是常见的汽车尾气催化剂。一种从废Pd/A12O3纳米催化剂(主要成分及含量:Pd0.3%,γ-A12O392.8%,其他杂质6.9%)中回收金属Pd的工艺如图:
已知:γ-Al2O3能与酸反应,α-A12O3不与酸反应。
回答下列问题:
(1)“预处理”时,γ-A12O3经焙烧转化为α-A12O3,该操作的主要目的是___。
(2)“酸浸”时,Pd转化为PdCl,其离子方程式为___。
(3)“滤液①”和“滤液②”中都含有的主要溶质有___(填化学式)。
(4)“粗Pd”溶解时,可用稀HNO3替代NaClO3,但缺点是___。两者相比,___(填化学式)的氧化效率更高(氧化效率以单位质量得到的电子数表示)。
(5)“沉淀”时,[Pd(NH3)4]2+转化为[Pd(NH3)2]Cl2沉淀,其化学方程式为___。
(6)酸性条件下,BrO3-能在负载Pd/A12O3纳米催化剂的电极表面快速转化为Br-。
①发生上述转化反应的电极应接电源的___极(填“正”或“负”);
②研究表明,电流密度越大,电催化效率越高;但当电流密度过大时,该电极会发生副反应生成___(填化学式)。
5.(2021·广东深圳·统考二模)近年来,我国的钢铁产量居世界首位。炼铁时产生大量瓦斯泥,若不合理利用,会对环境造成不利影响。一种以瓦斯泥(主要含ZnO、Bi2O3、Bi2S3、Bi、Fe2O3,还含少量PbO、FeO、CuO;锌、铋两元素的质量分数分别为8.92%、0.75%)为原料提取锌、铋的工艺流程如下图所示:
回答下列问题:
(1)“浸取”时,为避免“瓦斯泥”在反应器的底部沉淀、结块,可采取的措施为_______。
(2)“过程I”中发生反应的离子方程式为_______。
(3)“过程II”产生的气体___________(填化学式)可在流程的_______步骤中循环使用。
(4)“酸盐浸提”时,为使铋充分浸出,加入适量NaCl作助溶剂。单质铋在Fe3+的氧化作用下被溶解。
①含铋物质发生反应的化学方程式为:
i.Bi2O3+3H2SO4+6NaCl=2BiCl3+3Na2SO4+3H2O
ii.Bi2S3+3Fe2(SO4)3+6NaCl=2BiCl3+3Na2SO4+6FeSO4+3S
iii._______。
②“滤渣2”的主要成分除S外还有____________。
(5)已知:此工艺中,Bi3+水解得到BiOCl沉淀的适宜pH范围为1.6~2.0;溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子
Fe2+
Fe3+
Zn2+
开始沉淀时pH
7.0
1.9
6.2
完全沉淀时pH
9.0
3.2
8.0
①结合上述信息分析,“水解”时加入适量Zn粉的目的是_______。
②“水解”后的“系列操作”为_______。
(6)处理3.6t“瓦斯泥”,得到26.05kg“BiOCl产品”,其中BiOCl质量分数为90%,则铋的回收率为_______。(结果精确到1%)。
6.(2022·广东深圳·统考二模)高磷镍铁是生产钙镁磷肥的副产品。以高磷镍铁(主要含Ni、Fe、P,还含有少量Fe、Cu、Zn的磷化物)为原料生产硫酸镍晶体(NiSO4•6H2O)的工艺流程如图:
已知:电解时,选用2mol·L-1硫酸溶液为电解液。
回答下列问题:
(1)先将高磷镍铁制成电极板,“电解”时,该电极板作____极;阴极产物主要为____,此外,溶液中的Cu2+有部分在阴极放电。
(2)“除铁磷”时,溶液中Fe2+先被氧化为Fe3+,该过程发生反应的离子方程式为____;再加入Na2CO3调pH=2,并将溶液加热至50℃,形成铁、磷共沉淀。
(3)“滤渣2”的主要成分为ZnS和____(填化学式)。
(4)“沉镍”时,为确保镍沉淀完全,理论上应调节溶液pH≥____(已知:25℃时,Ksp[Ni(OH)2]=2×10-15;lg2=0.3;当溶液中离子浓度≤1.0×10-5mol·L-1时,可认为该离子沉淀完全)。
(5)“母液”中的溶质主要有____、____(填化学式)。
(6)硫代硫酸镍(NiS2O3)在冶金工业中有广泛应用。向上述流程制得的NiSO4溶液中加入BaS2O3固体,充分反应后,过滤得到NiS2O3溶液;再向该溶液加入无水乙醇,析出NiS2O3晶体(已知:25℃时,Ksp(BaSO4)=1.0×10-10、Ksp(BaS2O3)=1.6×10-5)。
①生成NiS2O3的化学方程式为____;该反应可以进行得较完全,结合相关数据说明理由:____。
②加入无水乙醇有利于NiS2O3晶体析出,其原因是____。
三、有机推断题
7.(2020·广东深圳·统考二模)他米巴罗汀是一种对白血病、阿尔茨海默症等疾病具有较好治疗效果的药物,其一种合成路线:
回答下列问题:
(1)A的结构简式是_________,C中含氧官能团的名称是_________
(2)①和③的反应类型分别是_________
(3)下列说法正确的是_________(填标号)。
a.A为苯的同系物b.B的一氯代物有5种
c.1molC最多可与2molNaOH反应d.弱碱性条件有利于反应⑤进行
(4)草酰氯与乙二胺()反应可得到一种六元环状化合物,该反应的化学方程式为_________
(5)化合物W与C互为同分异构体,且满足下列条件:①属于芳香族化合物且能与NaHCO3反应:②能发生银镜反应;③酸性条件下可发生水解反应,其产物能之一与FeCl3发生显色反应,则W共有_________种,其中一种核磁共振氢谱为1:2:2:2:1,其结构简式为__________。
(6)参照上述合成路线,设计由苯和1,3-丁二烯合成的路线(其它无机试剂任选)。__________
8.(2021·广东深圳·统考二模)化合物H是一种新型抗癌药物的中间体,其一种合成路线如下:
回答下列问题:
(1)A的名称为_____,F所含官能团的名称为_____。
(2)④的反应类型为____,G的结构简式为____。
(3)反应③的化学方程式为____。
(4)反应⑤可能产生与E互为同分异构体的副产物,其结构简式为____。
(5)芳香化合物M是H的同分异构体。已知M的苯环上只有3个取代基且分子结构中不含-OH,M的核磁共振氢谱仅有四组峰,则M的结构简式为____。(任写一种)。
(6)参照上述合成路线,设计由合成的路线(乙醇、乙酸及无机试剂任选)_____。
9.(2022·广东深圳·统考二模)乙肝新药的中间体化合物J的一种合成路线如图:
已知:RCOOH
回答下列问题:
(1)A的化学名称为____。
(2)D中含氧官能团的名称为____。
(3)反应②中还有HBr生成,则M的结构简式为____。
(4)写出反应③的化学方程式____。
(5)由G生成J的过程中,设计反应④和反应⑤的目的是____。
(6)化合物Q是A的同系物,相对分子质量比A的多14;化合物Q的同分异构体中,同时满足下列条件的共有___种(不考虑立体异构)。
条件:①与FeCl3溶液发生显色反应;②能发生银镜反应;③苯环上取代基数目小于4。
其中,核磁共振氢谱有五组峰,且峰面积之比为2∶2∶1∶1∶1的结构简式为____。
(7)根据上述信息,以 和 为原料,设计合成 的路线(无机试剂任选)____。
参考答案:
1. +247.0kJ·mol−1 AB 5.2 60% p02或1.265625 p02 CO2+Co3C+2H2⇌CH3COOH+3Co 低温 第一步减小氢气的浓度(或压强),第二步增大氢气的浓度(或压强)
【分析】I.利用该盖斯定律进行计算,将反应1、反应2、反应3相加可以得到总反应,可以求出“反应l”的△H的数值;从图象信息分析m的值,k的值和速率的变化;
II.根据图示可以写出化学反应方程式。从化学平衡移动的方向分析浓度,温度对平衡的影响。
【详解】I.(1)反应l:CH4(g)+CO2(g)⇌2H2(g)+2CO(g)△H1
反应2:2H2(g)+CO(g) ⇌CH3OH(g)△H2=-90.9kJ·mol-1
反应3:CH3OH(g)+CO(g) ⇌CH3COOH(g)△H3=-118.2kJ·mol-1
总反应:CH4(g)+CO2(g) ⇌CH3COOH(g)△H=+37.9kJ·mol-1,根据盖斯定律,反应l+反应2+反应3可得总反应,△H1+△H2+△H3=△H,则△H1=△H-△H2-△H3=+37.9kJ·mol-1-(-90.9kJ·mol-1)-(-118.2kJ·mol-1)=+247.0kJ·mol−1;
(1)①A.当10kPa≤≤25kPa时,由左图的速率随甲烷的分压变化图可知,图象为一条直线,故斜率为1,则m=l,故A正确;
B.由右图的速率随甲烷的分压变化图可知,其他条件不变,增大,在的值为25 Kpa时,速率值不再发生变化,故速率v不一定增大,故B正确;
C.由图象可知,va>vb>vc, a和b的相等、根据公式,v=k[]m·[]n,由于va>vb ,ka>kb,三个点中c点值最小,故无法得出c点速率常数最小关系,故C错误;
答案选AB;
②若初始时按n(CH4):n(CO2)=1:1进气,则b点的化学反应速率v= k[]m·[]n,已知Kb=1.3×10-2mol·g-1·s-1·Kpa-2,CH4(g)+CO2(g)⇌2H2(g)+2CO(g),由图象可知,当10kPa≤≤25kPa时,m=l,n=1, vb= kb[20]·[20] =1.3×10-2mol·g-1·s-1·Kpa-2×400=5.2 mol·g-1·s-1;
(3) 反应l:CH4(g)+CO2(g)⇌2H2(g)+2CO(g)△H>0,正反应放热,升高温度,反应正向移动,CH4(g)的转化率增大,则平衡时CH4(g)的转化率为98%的曲线为1173K时的平衡曲线,60%的为温度923K时的平衡曲线,由曲线可知,923K时,CH4(g)的平衡转化率α=60%,若平衡时体系的总压强为p0,设CH4和CO2的初始投入物质的量为1mol,923K平衡时时,CH4(g)的平衡转化率α=60%,列“三段式”:
平衡常数K923K==p02或1.265625 p02;
II.(4)①根据图示,第二步反应的化学方程式为CO2+Co3C+2H2⇌CH3COOH+3Co;
②根据图示可知,第二步反应为放热反应,增大CH3COOH的平衡产率,即反应向正向移动,降低温度反应向放热的方向进行,从温度角度考虑,第二步反应在低温下进行;从H2浓度的角度考虑,反应一中氢气为生成物,使反应正向进行,则应该减小氢气的浓度(或压强),对于反应二,氢气为反应物,可增大氢气的浓度(或压强),促使平衡正向移动,使CH3COOH的平衡产率增大。
【点睛】关于速率常数的理解是难点,需要学生结合图象,分析清晰每一条曲线的意义,会用速率常数的公式进行计算。
2. -574 NO Q 热解温度高,煤焦H/C比值小,表面官能团减少 S-900的比表面积小,吸附能力弱 温度升高,反应速率增大
【详解】(1)已知:
N2(g)+O2(g)=2NO(g) ΔH1=+180.5kJ·mol-1,碳的燃烧热为393.5kJ·mol-1,
ΔH=-393.5kJ·mol-1
将下式-上式可得目标方程式,则,可知ΔH2=-574kJ·mol-1。故答案为:-574;
(2)①达到平衡时NO表示的正反应速率应为N2表示的逆反应速率的两倍,则乙点对应的物质为NO;则平衡时,c(NO)=0.4mol/L,该反应的平衡常数。故答案为:NO,;
②将温度降低至某一温度时,反应重新达到平衡,NO的体积分数为30%,可知N2的体积分数为,则此时N2的分压。该反应为放热反应,降低温度平衡会朝着正反应方向移动,c(NO)减小,c(N2)增大,且降温度会使得反应速率减慢,可知图中甲点可能移动至Q点位置。故答案为:,Q;
(3)煤焦表面存在的官能团有利于NO的吸附,其数量与煤焦中氢碳质量比的值密切相关。由图可知,相同温度下,S-500对NO的脱除率比S-900的高,结合表格数据以及图示分析,可能的原因是:热解温度高,煤焦H/C比值小,表面官能团减少、S-900的比表面积小,吸附能力弱。故答案为:热解温度高,煤焦H/C比值小,表面官能团减少;S-900的比表面积小,吸附能力弱
(4)350℃后,随着温度升高,反应速率增大,NO的脱除率增大。
故答案为:温度升高,反应速率增大。
3.(1)ΔH2-2ΔH1或ΔH3-2ΔH4
(2)CD
(3) 大于 相同温度下,氢碳比越大(或增加氢气的物质的量),该体系加氢反应的平衡向右进行,CO和CO2的平衡转化率均增大,故x>3 0.8 0.75
(4) CO2 *COOH+H++e-=H2O+*CO
【详解】(1)根据盖斯定律,Ⅱ-Ⅰ×2可得V,Ⅲ-2×Ⅳ也可得V,所以ΔH5=ΔH2-2ΔH1或ΔH3-2ΔH4;
(2)A.催化剂可以加快反应速率,但不能改变平衡转化率,A错误;
B.降低温度,正逆反应速率均减小,B错误;
C.增大CO的浓度,反应Ⅰ、Ⅱ平衡正向移动,CH3OH(g)、C2H5OH(g)的浓度增大,反应Ⅲ、IV的平衡均向左移动,C正确;
D.氩气不参与反应,恒温恒容充入氩气,反应Ⅰ、Ⅱ中的反应物和生成物的浓度均不改变,平衡不移动,D正确;
综上所述答案为CD;
(3)①相同温度下,氢碳比越大(或增加氢气的物质的量),该体系加氢反应的平衡向右进行,CO和CO2的平衡转化率均增大,故x>3;
②Q点[CO+CO2]的总平衡转化率为80%,乙醇和甲醇的选择性均为50%,所以n(CH3OH)=(1mol+1mol)×80%×50%=0.8mol;n(C2H5OH)=(1mol+1mol)×80%×50%×=0.4mol,设H2O(g)的物质的量为x mol,H2转化了4mol,则根据H元素守恒有4×0.8mol+6×0.4mol+2x mol=4mol×2,解得x=1.2mol,该反应前后气体系数之和相等,所以可以用物质的量代替分压计算平衡常数Kp,则平衡常数Kp==0.75;
(4)①据图可知CO2的能量低于CO,所以CO2更稳定;
②据图可知第二步反应中*COOH结合H++e-转化为H2O和*CO,化学方程式为*COOH+H++e-=H2O+*CO。
4. 利于Pd与Al2O3的分离(或“大大减少了酸用量”,或“避免酸浸时氧化铝和酸发生反应”) 3Pd++6H++11Cl-=3+3H2O AlCl3 对环境产生较大污染(或耗酸量大、或腐蚀性强、或氧化效率低) NaClO3 [Pd(NH3)4]Cl2+2HCl=[Pd(NH3)2]Cl2↓+2NH4Cl 负 H2
【分析】废Pd/Al2O3纳米催化剂进行焙烧,使大量的γ-Al2O3经焙烧转化为α-A12O3,处理后,加入足量盐酸和NaClO3进行酸浸和氧化处理,Pd转化为,γ-Al2O3转化为Al3+后过滤,发生的离子反应为:3Pd++6H++11Cl-=3+3H2O,Al2O3+6H+=2Al3++3H2O,α-A12O3不与酸反应,对酸浸后的溶液过滤,α-A12O3以滤渣的形式除去,得到含有、Al3+的滤液,向滤液中加入过量的Al单质,将置换为Pb单质,在进行过滤,得到主要含有Al3+、Cl-的滤液①,得到的固体主要含有Pb和过量的Al单质,再加入盐酸将过量的单质Al除去,再次过滤,得到主要含有Al3+、Cl-、H+的滤液②和粗Pd,向粗Pd中再次加入盐酸和NaClO3,将Pd溶解转化为,向得到的溶液中加入氨水,将转化为,再加入盐酸,使转化为[Pd(NH3)2]Cl2沉淀,过滤后,对[Pd(NH3)2]Cl2进行焙烧生成高纯度的Pd单质,据此解答。
【详解】(1)由于α-A12O3不与酸反应,“预处理”时,γ-Al2O3经焙烧转化为α-A12O3,该操作的主要目的是将大量的Al2O3在酸浸时以沉淀的形式除去,有利于Pd与Al2O3的分离,故答案为:有利于Pd与Al2O3的分离;
(2)根据分析,“酸浸”时,Pd转化,其离子方程式为3Pd++6H++11Cl-=3+3H2O;
(3)根据分析“滤液①”主要含有Al3+、Cl-,“滤液②”中主要含有Al3+、Cl-、H+,二者都含有的主要溶质有AlCl3,故答案为:AlCl3;
(4)“粗Pd”溶解时,可用稀HNO3替代NaClO3,但缺点是使用硝酸作氧化剂会生成氮氧化物,对环境产生较大污染(或耗酸量大、或腐蚀性强、或氧化效率低);63g硝酸为1mol做氧化剂转化为二氧化氮,转移1mol电子,即1g硝酸参与反应得到的电子,106.5gNaClO3为1mol,做氧化剂转化为,转移6mol电子,即1gNaClO3参与反应得到电子,两者相比,NaClO3的氧化效率更高,故答案为:对环境产生较大污染(或耗酸量大、或腐蚀性强、或氧化效率低);NaClO3;
(5)“沉淀”时,转化为[Pd(NH3)2]Cl2沉淀,其化学方程式为[Pd(NH3)4]Cl2+2HCl=[Pd(NH3)2]Cl2↓+2NH4Cl;
(6)①BrO3-能在负载Pd/Al2O3纳米催化剂的电极表面快速转化为Br-,溴元素的化合价降低,得电子,发生还原反应,负载Pd/Al2O3纳米催化剂的电极作阴极,电解池的阴极与电源的负极相连,故答案为:负;
②电流密度越大,电催化效率越高;酸性条件下,但当电流密度过大时,进入到阴极的电子过多,多余的电子来不及被得到转化为Br-,电解质溶液中的氢离子会结合多余的电子,则出现电极副反应:2H++2e-=H2↑,故答案为:H2。
5. 采用较强烈的搅拌转速 Cu(NH3)+Zn=Zn(NH3)+Cu NH3 “浸取” 2Bi+3Fe2(SO4)3+6NaCl=2BiCl3+3Na2SO4+6FeSO4 PbSO4 将Fe3+还原为Fe2+,避免在Bi3+水解时,Fe3+同时水解,导致产物不纯 过滤、洗涤、干燥 70%
【分析】瓦斯泥(主要含ZnO、Bi2O3、Bi2S3、Bi、Fe2O3,还含少量PbO、FeO、CuO;锌、铋两元素的质量分数分别为8.92%、0.75%),浸取之后过滤得到Cu(NH3)、Zn(NH3)、,滤渣1中的PbO和硫酸反应后,得到的滤渣2中会含有PbSO4,“水解”时加入适量的Zn粉可以将Fe3+还原为Fe2+,避免在Bi3+水解时,Fe3+同时水解,导致产物不纯,“水解”后,将得到的产品过滤、洗涤并干燥即可得到产品,以此解答。
【详解】(1)“浸取”时,为避免“瓦斯泥”在反应器的底部沉淀、结块,可采用较强烈的搅拌转速,故答案为:采用较强烈的搅拌转速;
(2)“过程Ⅰ”中Cu(NH3)和Zn反应生成Zn(NH3)和Cu,反应的离子方程式为Cu(NH3)+Zn=Zn(NH3)+Cu,故答案为:Cu(NH3)+Zn=Zn(NH3)+Cu;
(3)根据元素守恒可知,“过程Ⅱ”中会产生NH3,结合流程图可知,NH3可在流程中的“浸取”步骤中循环使用,故答案为:NH3;“浸取”;
(4)①根据题意,单质铋在Fe3+的氧化作用下被溶解,结合已知的化学方程式可知,剩下的一个化学方程式为Bi和Fe3+的反应,该反应的化学方程式为2Bi+3Fe2(SO4)3+6NaCl=2BiCl3+3Na2SO4+6FeSO4,故答案为:2Bi+3Fe2(SO4)3+6NaCl=2BiCl3+3Na2SO4+6FeSO4;
②滤渣1中的PbO和硫酸反应后,得到的滤渣2中会含有PbSO4,故答案为:PbSO4;
(5)①结合表中信息可知,“水解”时加入适量的Zn粉可以将Fe3+还原为Fe2+,避免在Bi3+水解时,Fe3+同时水解,导致产物不纯,故答案为:将Fe3+还原为Fe2+,避免在Bi3+水解时,Fe3+同时水解,导致产物不纯;
②“水解”后,将得到的产品过滤、洗涤并干燥即可得到产品,故答案为:过滤、洗涤、干燥;
(6)处理3.6t“瓦斯泥”,得到26.05kg的“BiOCl产品”,其中BiOCl质量分数为90%,则铋的回收率为70%,故答案为:70%。
6.(1) 阳 H2
(2)2Fe2++ClO-+2H+=2Fe3++Cl-+H2O
(3)CuS
(4)9.15
(5) NaCl Na2SO4
(6) BaS2O3+NiSO4=NiS2O3+BaSO4 该反应的K==1.6×105,K大于105,反应进行得较完全; 降低NiS2O3的溶解度
【分析】先将高磷镍铁制成电极板,进行电解,Ni、Fe、Zn、Cu转化为阳离子进入溶液,之后加入NaClO将Fe2+氧化为Fe3+,然后加入Na2CO3调pH=2,并将溶液加热至50℃,形成铁、磷共沉淀;过滤后加入H2S除去Cu2+和Zn2+;过滤后向滤液中加入NaOH得到Ni(OH)2沉淀,过滤、水洗沉淀后,加入硫酸溶解,得到硫酸镍溶液,经系列处理得到NiSO4·6H2O。
(1)
电解的主要目的应是将金属元素转化为相应的金属阳离子,所以高磷镍铁应为阳极,被氧化;阴极主要为氢离子放电,所以主要产物为H2;
(2)
“除铁磷”时,ClO-将Fe2+氧化为Fe3+,根据电子守恒、元素守恒可得离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O;
(3)
“除铁磷”后主要杂质还有Cu2+、Zn2+,所以加入H2S除杂时得到的“滤渣2”的主要成分为ZnS和CuS;
(4)
当溶液中c(Ni2+)=1.0×10-5mol·L-1时,c(OH-)==mol/L=×10-5mol/L,所以c(H+)=×10-9mol/L,此时pH=-lg c(H+)=9.15,所以理论上应调节溶液pH≥9.15;
(5)
ClO-会被还原为Cl-,电解时选用2mol·L-1硫酸溶液为电解液,所以溶液中阴离子还有SO,而阳离子只剩加入的Na+,所以“母液”中的溶质主要有NaCl、Na2SO4;
(6)
①根据题意,NiSO4溶液可以使BaS2O3沉淀转化为BaSO4沉淀,同时得到NiS2O3,化学方程式为BaS2O3+NiSO4=NiS2O3+BaSO4;该反应的平衡常数K====1.6×105,K大于105,反应进行得较完全;
②无水乙醇可以降低NiS2O3的溶解度,利于晶体析出。
7. 羧基、酯基 取代反应、还原反应 cd +H2N-CH2-CH2-NH2→+2HCl 13 CH2=CHCH=CH2Cl-CH2CH=CHCH2ClCl-CH2CH2CH2Cl
【分析】
(1)~(3):由流程知,反应②为苯环上的硝化反应,反应③则为还原反应,反应过程中硝基转化为氨基,则B为:,A为,反应①则是与之间生成,C分子式为C9H8O4,不饱和度为6,参照上述合成路线的反应④,用逆合成分析法推知,C为,据此填空;
(4)参照上述合成路线的反应⑥,类推即可;
(5)限定条件的同分异构体的种类判断,可从分子式为C9H8O4,不饱和度为6切入,找出满足条件的官能团判断;
(6)参照题目提供的合成线路,结合逆分析法,找出流程;
【详解】
(1)由分析知A为,C为,则C中含氧官能团的名称是羧基、酯基;
答案为:;羧基、酯基;
(2)反应①是与之间发生反应得到,苯环上相邻2个氢原子被取代,同时得到氯化氢,故是取代反应,反应③过程中硝基转化为氨基,去氧得氢,则③为还原反应;
答案为:取代反应、还原反应;
(3)a.A为,苯环所连并不是烷基,故不是苯的同系物,a错误;
b.B为,分子内有7种氢原子,故一氯代物有7种,b错误;
c.C为,1molC最多可与2molNaOH反应,c正确;
d.反应⑤是取代反应,除了得到有机产物外,还有HCl生成,故弱碱性条件有利于反应⑤进行,d正确;
答案为:cd;
(4)草酰氯与乙二胺()反应由反应⑥类推即可,发生取代反应,可得到一种六元环状化合物和HCl,该反应的化学方程式为+H2N-CH2-CH2-NH2→+2HCl;
答案为:+H2N-CH2-CH2-NH2→+2HCl;
(5)化合物W与C互为同分异构体,分子式为C9H8O4,不饱和度为6,且从满足下列条件可知其含的基团或官能团:由“①属于芳香族化合物且能与NaHCO3反应”知含羧基:由“②能发生银镜反应”知含-CHO;由“③酸性条件下可发生水解反应,其产物能之一与FeCl3发生显色反应”知含酚酯基,由于是6个不饱和度,故其必定含甲酸酚酯基、羧基,则W的结构存在以下二种情况:一是可看作苯环上的1个氢原子被取代所得,共3种同分异构体,即苯环上2个取代基位于邻、间、对位3种情况,另一种是苯环上有3个取代基,分别是、-COOH和-CH3,结构的苯环上再引入-CH3有2种、结构的苯环上再引入-CH3有4种、结构的苯环上再引入-CH3有4种、则满足条件的同分异构体共有13种,其中一种核磁共振氢谱为1:2:2:2:1,其结构简式为;
答案为:13种;;
(6)参照上述合成路线的反应①,用逆合成分析法,要得到,需和ClCH2CH2CH2Cl在AlCl3条件下反应,Cl-CH2CH2CH2Cl则可以由CH2=CHCH=CH2与氯气先进行1,4-加成得ClCH2CH=CHCH2Cl、后ClCH2CH=CHCH2Cl与氢气加成所得,由苯和1,3-丁二烯合成的路线为:CH2=CHCH=CH2ClCH2CH=CHCH2ClClCH2CH2CH2Cl;
答案为:CH2=CHCH=CH2ClCH2CH=CHCH2ClClCH2CH2CH2Cl。
8. 环己醇 碳氯键、醚键 消去反应 +NaOH+NaBr+H2O 、、 、
【分析】结合反应条件和各物质的分子式分析,B和Br2发生取代反应生成,可以推知B为,A发生氧化反应生成B,可知A为,发生消去反应生成C,可知C为,D发生消去反应生成 CH2=C(CH3)CH3,E和ClCH2OCH3发生取代反应生成G,结合H的结构式可知G为,以此解答。
【详解】(1)由上述分析可知,A的名称为环己醇,F所含官能团的名称为碳氯键、醚键。
(2)由分析可知,④的反应类型为消去反应,G的结构简式为。
(3)反应③中发生消去反应生成C,化学方程式为 +NaOH+NaBr+H2O,故答案为:+NaOH+NaBr+H2O;
(4)反应⑤可能产生与E互为同分异构体的副产物,结合反应⑤的反应物以及E的结构简式可知,该副产物的结构可能为。
(5)芳香化合物M是H的同分异构体。已知M的苯环上只有3个取代基且分子结构中不含,M的核磁共振氢谱仅有四组峰,符合上述条件的M的结构可能是、 、 、。
(6)目标产物可由得到,可由在NaOH的醇溶液中发生消去反应得到,可由与反应得到,合成路线可表示为 。
9.(1)对溴苯甲酸或4-溴苯甲酸
(2)硝基、酯基
(3)
(4) +H2O
(5)保护羧基
(6) 23
(7)
【分析】在浓硫酸催化下与浓硝酸发生硝化反应生成B,结合B的分子式及后边产物D的结构可推出B为,在浓硫酸催化下与甲醇发生酯化反应生成C为,与化合物M反应生成D,根据D的结构简式及C的分子式的差别推出M为,发生取代反应生成D和溴化氢;E在一定条件下反应生成F,根据F的分子式可推知E发生水解生成甲醇和F,F为。
【详解】(1)A为,化学名称为对溴苯甲酸或4-溴苯甲酸;
(2)D为,含氧官能团的名称为硝基、酯基;
(3)反应②中还有HBr生成,则M的结构简式为;
(4)反应③是在催化剂作用下发生分子内脱水成肽反应生成和水,反应的化学方程式为 +H2O;
(5)由G生成J的过程中,设计反应④和反应⑤先将羧基转化为酯基,再将酯基转化为羧基,故其目的是保护羧基;
(6)化合物Q是A()的同系物,相对分子质量比A的多14,则多一个CH2;化合物Q的同分异构体中,同时满足条件:①与FeCl3溶液发生显色反应,则含有酚羟基;②能发生银镜反应,则含有醛基;③苯环上取代基数目小于4,若除酚羟基外还有一个取代基,则可以为-CH(Br)CHO,与酚羟基的位置有邻、间、对位共3种;若还有两个取代基,则有溴原子、-CH2CHO或-CH2Br和-CHO,跟酚羟基一起定一动二,分别有10种,故共有23种同分异构体;其中,核磁共振氢谱有五组峰,且峰面积之比为2∶2∶1∶1∶1的结构简式为;
(7)以发生硝化反应生成硝基苯,硝基苯还原得到苯胺,苯胺与反应生成,合成的路线如下: 。
广东省深圳市2021届-2023届高考化学三年模拟(二模)按题型分类汇编-非选择题: 这是一份广东省深圳市2021届-2023届高考化学三年模拟(二模)按题型分类汇编-非选择题,共37页。试卷主要包含了多选题,实验题,工业流程题,原理综合题,结构与性质,有机推断题等内容,欢迎下载使用。
广东省深圳市2020届-2022届高考化学三年模拟(二模)试题汇编-选择题: 这是一份广东省深圳市2020届-2022届高考化学三年模拟(二模)试题汇编-选择题,共28页。试卷主要包含了单选题,多选题等内容,欢迎下载使用。
广东省深圳市2020届-2022届高考化学三年模拟(二模)试题汇编-非选择题2: 这是一份广东省深圳市2020届-2022届高考化学三年模拟(二模)试题汇编-非选择题2,共14页。试卷主要包含了实验题,结构与性质等内容,欢迎下载使用。












