广东省深圳市2021届-2023届高考化学三年模拟(二模)按题型分类汇编-非选择题
展开广东省深圳市 2021届-2023届高考化学三年模拟(二模)按题型分类汇编-非选择题
一、多选题
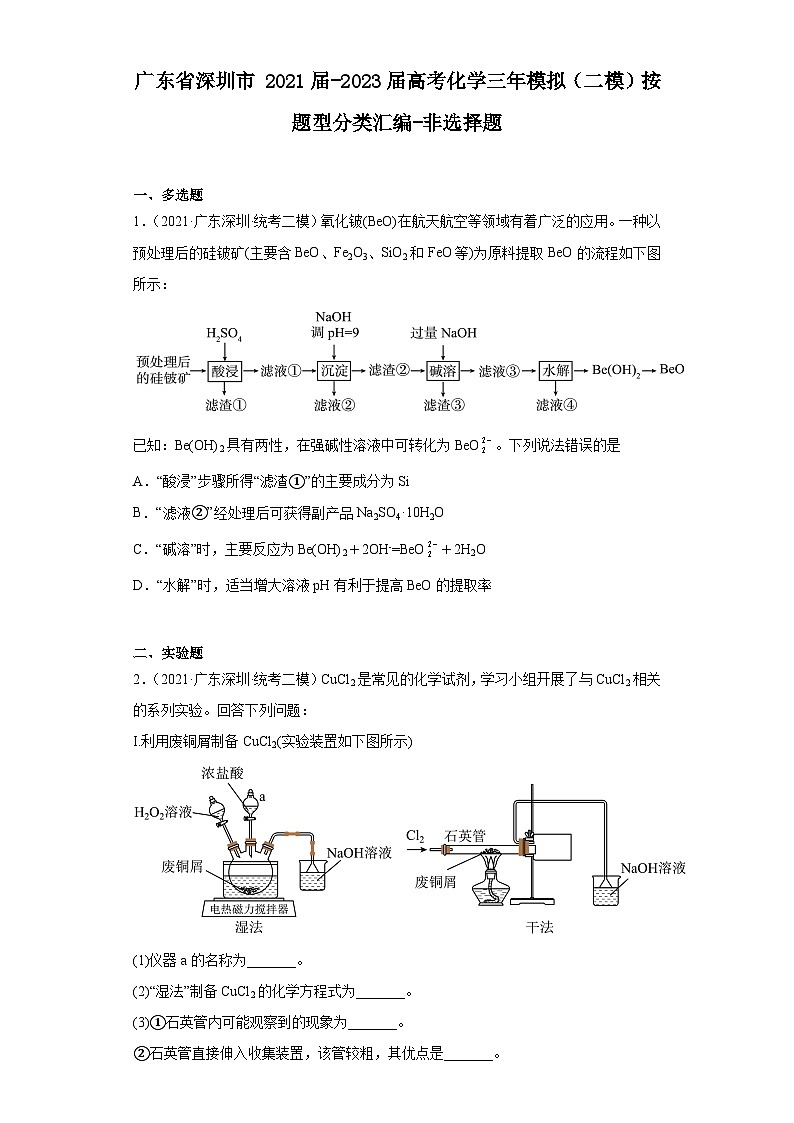
1.(2021·广东深圳·统考二模)氧化铍(BeO)在航天航空等领域有着广泛的应用。一种以预处理后的硅铍矿(主要含BeO、Fe2O3、SiO2和FeO等)为原料提取BeO的流程如下图所示:
已知:Be(OH)2具有两性,在强碱性溶液中可转化为BeO。下列说法错误的是
A.“酸浸”步骤所得“滤渣①”的主要成分为Si
B.“滤液②”经处理后可获得副产品Na2SO4·10H2O
C.“碱溶”时,主要反应为Be(OH)2+2OH-=BeO+2H2O
D.“水解”时,适当增大溶液pH有利于提高BeO的提取率
二、实验题
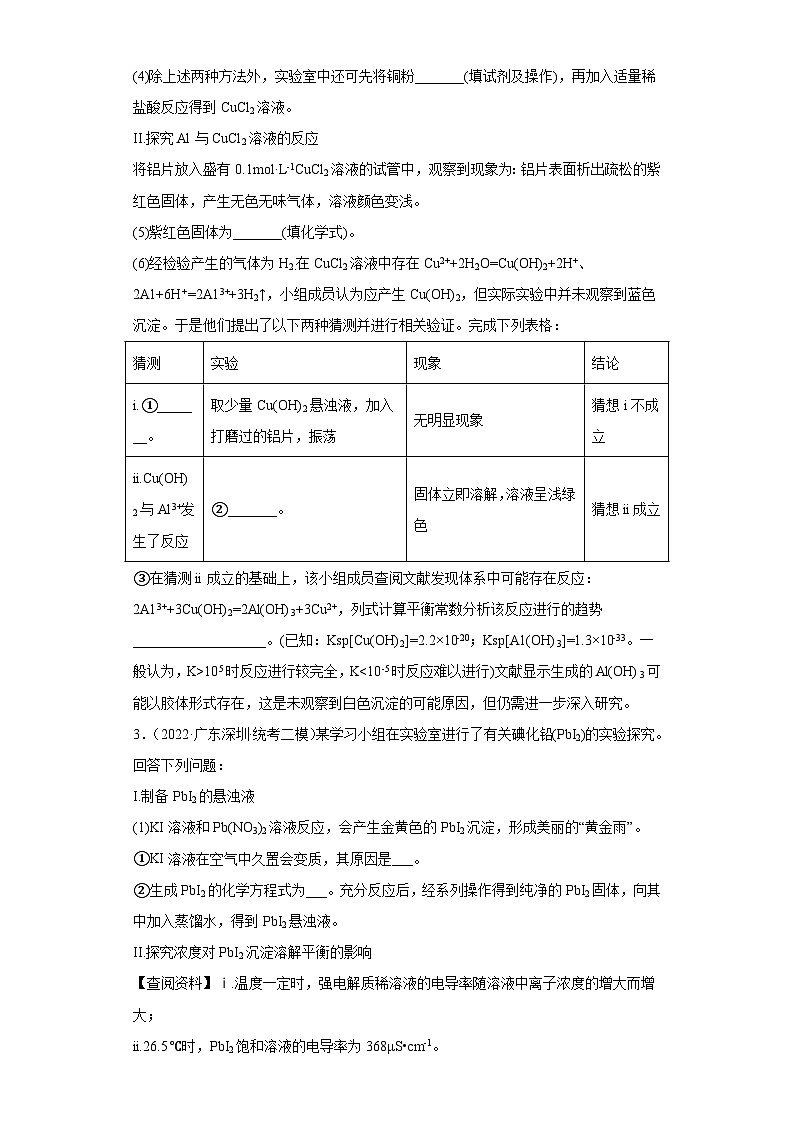
2.(2021·广东深圳·统考二模)CuCl2是常见的化学试剂,学习小组开展了与CuCl2相关的系列实验。回答下列问题:
I.利用废铜屑制备CuCl2(实验装置如下图所示)
(1)仪器a的名称为_______。
(2)“湿法”制备CuCl2的化学方程式为_______。
(3)①石英管内可能观察到的现象为_______。
②石英管直接伸入收集装置,该管较粗,其优点是_______。
(4)除上述两种方法外,实验室中还可先将铜粉_______(填试剂及操作),再加入适量稀盐酸反应得到CuCl2溶液。
II.探究Al与CuCl2溶液的反应
将铝片放入盛有0.1mol·L-1CuCl2溶液的试管中,观察到现象为:铝片表面析出疏松的紫红色固体,产生无色无味气体,溶液颜色变浅。
(5)紫红色固体为_______(填化学式)。
(6)经检验产生的气体为H2.在CuCl2溶液中存在Cu2++2H2O=Cu(OH)2+2H+、2A1+6H+=2A13++3H2↑,小组成员认为应产生Cu(OH)2,但实际实验中并未观察到蓝色沉淀。于是他们提出了以下两种猜测并进行相关验证。完成下列表格:
猜测
实验
现象
结论
i.①_______。
取少量Cu(OH)2悬浊液,加入打磨过的铝片,振荡
无明显现象
猜想i不成立
ii.Cu(OH)2与Al3+发生了反应
②_______。
固体立即溶解,溶液呈浅绿色
猜想ii成立
③在猜测ii成立的基础上,该小组成员查阅文献发现体系中可能存在反应:2A13++3Cu(OH)2=2Al(OH)3+3Cu2+,列式计算平衡常数分析该反应进行的趋势___________________。(已知:Ksp[Cu(OH)2]=2.2×10-20;Ksp[A1(OH)3]=1.3×10-33。一般认为,K>105时反应进行较完全,K<10-5时反应难以进行)文献显示生成的Al(OH)3可能以胶体形式存在,这是未观察到白色沉淀的可能原因,但仍需进一步深入研究。
3.(2022·广东深圳·统考二模)某学习小组在实验室进行了有关碘化铅(PbI2)的实验探究。回答下列问题:
I.制备PbI2的悬浊液
(1)KI溶液和Pb(NO3)2溶液反应,会产生金黄色的PbI2沉淀,形成美丽的“黄金雨”。
①KI溶液在空气中久置会变质,其原因是___。
②生成PbI2的化学方程式为___。充分反应后,经系列操作得到纯净的PbI2固体,向其中加入蒸馏水,得到PbI2悬浊液。
II.探究浓度对PbI2沉淀溶解平衡的影响
【查阅资料】ⅰ.温度一定时,强电解质稀溶液的电导率随溶液中离子浓度的增大而增大;
ii.26.5℃时,PbI2饱和溶液的电导率为368μS•cm-1。
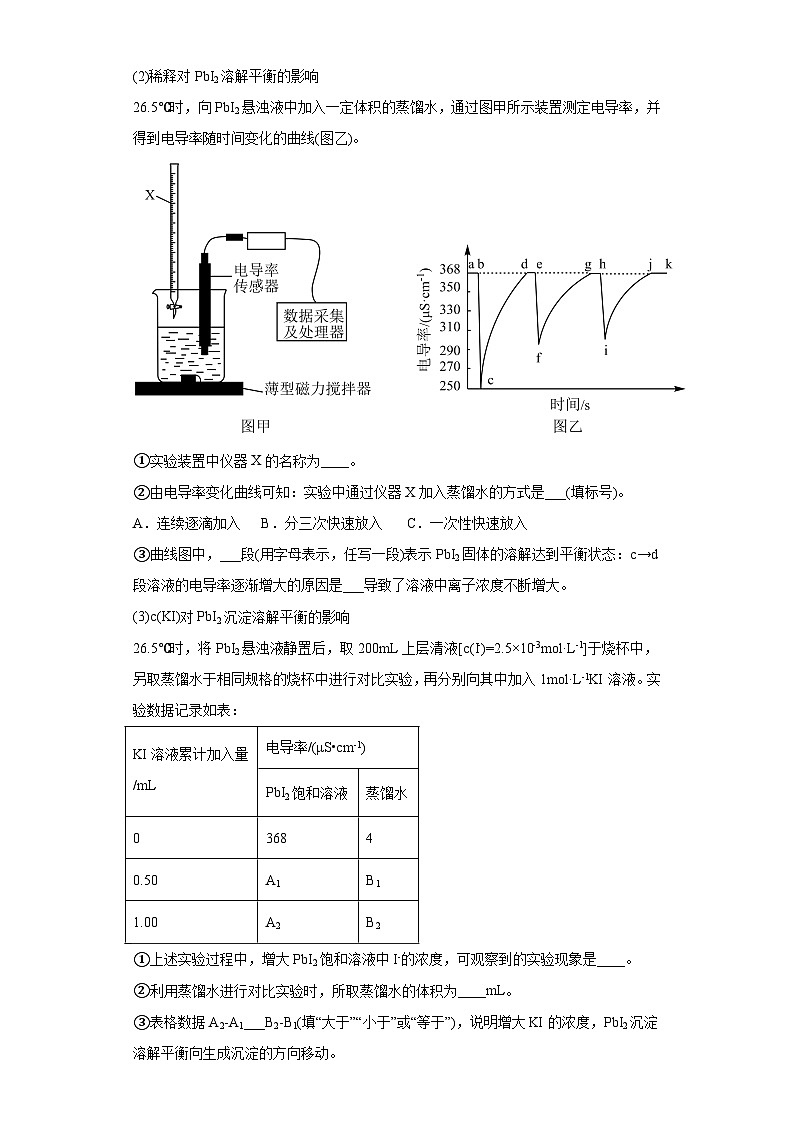
(2)稀释对PbI2溶解平衡的影响
26.5℃时,向PbI2悬浊液中加入一定体积的蒸馏水,通过图甲所示装置测定电导率,并得到电导率随时间变化的曲线(图乙)。
①实验装置中仪器X的名称为____。
②由电导率变化曲线可知:实验中通过仪器X加入蒸馏水的方式是___(填标号)。
A.连续逐滴加入 B.分三次快速放入 C.一次性快速放入
③曲线图中,___段(用字母表示,任写一段)表示PbI2固体的溶解达到平衡状态:c→d段溶液的电导率逐渐增大的原因是___导致了溶液中离子浓度不断增大。
(3)c(KI)对PbI2沉淀溶解平衡的影响
26.5℃时,将PbI2悬浊液静置后,取200mL上层清液[c(I-)=2.5×10-3mol·L-1]于烧杯中,另取蒸馏水于相同规格的烧杯中进行对比实验,再分别向其中加入1mol·L-1KI溶液。实验数据记录如表:
KI溶液累计加入量/mL
电导率/(μS•cm-1)
PbI2饱和溶液
蒸馏水
0
368
4
0.50
A1
B1
1.00
A2
B2
①上述实验过程中,增大PbI2饱和溶液中I-的浓度,可观察到的实验现象是____。
②利用蒸馏水进行对比实验时,所取蒸馏水的体积为____mL。
③表格数据A2-A1___B2-B1(填“大于”“小于”或“等于”),说明增大KI的浓度,PbI2沉淀溶解平衡向生成沉淀的方向移动。
4.(2023·广东深圳·统考二模)某学习小组按下图所示流程,在实验室模拟处理含苯酚的工业废水,并进行相关实验探究。
回答下列问题:
(1)“操作Ⅰ”所使用的玻璃仪器有烧杯和_______(填仪器名称),流程中可循环使用的物质是_______(填名称)。
(2)“水层2”中主要溶质为_______(填化学式)。
(3)将所得苯酚配制成一定浓度的苯酚溶液,探究铁盐种类和pH对苯酚与Fe3+显色反应的影响。
查阅资料
ⅰ.为紫色;
ⅱ.对苯酚与的显色反应无影响;
ⅲ.对特定波长光的吸收程度(用吸光度A表示)与的浓度在一定范围内成正比。
提出猜想:
猜想1:对苯酚与的显色反应有影响
猜想2:对苯酚与的显色反应有影响。
猜想3:对苯酚与的显色反应有影响。
进行实验:
常温下,用盐酸调节pH配制得到pH分别为a和b的溶液(),用硫酸调节pH配制得到pH分别为a和b的溶液。取苯酚溶液于试管中,按实验1~4分别再加入含的试剂,显色后用紫外-可见分光光度计测定该溶液的吸光度(本实验条件下,pH改变对水解程度的影响可忽略)。
序号
含的试剂
吸光度
溶液
溶液
1
/
2
/
3
/
4
/
结果讨论 实验结果为。
①根据实验结果,小组同学认为此结果不足以证明猜想3成立的理由是_______。
②为进一步验证猜想,小组同学设计了实验5和6,补充下表中相关内容。(限选试剂:溶液、溶液、固体、固体)
序号
含的试剂
再加入的试剂
吸光度
溶液
溶液
5
/
固体
6
/
_______
③根据实验1~6的结果,小组同学得出猜想1不成立,猜想2成立,且对苯酚与的显色反应起抑制作用,得出此结论的依据是_______。
④根据实验1~6的结果,小组同学得出猜想3成立,且对与苯酚的显色反应有抑制作用,从化学平衡角度解释其原因是_______。
(4)小组同学利用滴定法测定所得“水层2”中苯酚的含量:向样品溶液中加入过量溴水,将苯酚全部转化为化合物M;再加入过量溶液,充分反应后,用标准溶液滴定。
已知:ⅰ.
ⅱ.
①加入溶液前需加热除去多余的,否则会使测定结果_______(填“偏高”或“偏低”)。
②若消耗标准溶液的体积为,则样品中苯酚的浓度为_______(用含、、的代数式表示)。
三、工业流程题
5.(2021·广东深圳·统考二模)近年来,我国的钢铁产量居世界首位。炼铁时产生大量瓦斯泥,若不合理利用,会对环境造成不利影响。一种以瓦斯泥(主要含ZnO、Bi2O3、Bi2S3、Bi、Fe2O3,还含少量PbO、FeO、CuO;锌、铋两元素的质量分数分别为8.92%、0.75%)为原料提取锌、铋的工艺流程如下图所示:
回答下列问题:
(1)“浸取”时,为避免“瓦斯泥”在反应器的底部沉淀、结块,可采取的措施为_______。
(2)“过程I”中发生反应的离子方程式为_______。
(3)“过程II”产生的气体___________(填化学式)可在流程的_______步骤中循环使用。
(4)“酸盐浸提”时,为使铋充分浸出,加入适量NaCl作助溶剂。单质铋在Fe3+的氧化作用下被溶解。
①含铋物质发生反应的化学方程式为:
i.Bi2O3+3H2SO4+6NaCl=2BiCl3+3Na2SO4+3H2O
ii.Bi2S3+3Fe2(SO4)3+6NaCl=2BiCl3+3Na2SO4+6FeSO4+3S
iii._______。
②“滤渣2”的主要成分除S外还有____________。
(5)已知:此工艺中,Bi3+水解得到BiOCl沉淀的适宜pH范围为1.6~2.0;溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子
Fe2+
Fe3+
Zn2+
开始沉淀时pH
7.0
1.9
6.2
完全沉淀时pH
9.0
3.2
8.0
①结合上述信息分析,“水解”时加入适量Zn粉的目的是_______。
②“水解”后的“系列操作”为_______。
(6)处理3.6t“瓦斯泥”,得到26.05kg“BiOCl产品”,其中BiOCl质量分数为90%,则铋的回收率为_______。(结果精确到1%)。
6.(2022·广东深圳·统考二模)高磷镍铁是生产钙镁磷肥的副产品。以高磷镍铁(主要含Ni、Fe、P,还含有少量Fe、Cu、Zn的磷化物)为原料生产硫酸镍晶体(NiSO4•6H2O)的工艺流程如图:
已知:电解时,选用2mol·L-1硫酸溶液为电解液。
回答下列问题:
(1)先将高磷镍铁制成电极板,“电解”时,该电极板作____极;阴极产物主要为____,此外,溶液中的Cu2+有部分在阴极放电。
(2)“除铁磷”时,溶液中Fe2+先被氧化为Fe3+,该过程发生反应的离子方程式为____;再加入Na2CO3调pH=2,并将溶液加热至50℃,形成铁、磷共沉淀。
(3)“滤渣2”的主要成分为ZnS和____(填化学式)。
(4)“沉镍”时,为确保镍沉淀完全,理论上应调节溶液pH≥____(已知:25℃时,Ksp[Ni(OH)2]=2×10-15;lg2=0.3;当溶液中离子浓度≤1.0×10-5mol·L-1时,可认为该离子沉淀完全)。
(5)“母液”中的溶质主要有____、____(填化学式)。
(6)硫代硫酸镍(NiS2O3)在冶金工业中有广泛应用。向上述流程制得的NiSO4溶液中加入BaS2O3固体,充分反应后,过滤得到NiS2O3溶液;再向该溶液加入无水乙醇,析出NiS2O3晶体(已知:25℃时,Ksp(BaSO4)=1.0×10-10、Ksp(BaS2O3)=1.6×10-5)。
①生成NiS2O3的化学方程式为____;该反应可以进行得较完全,结合相关数据说明理由:____。
②加入无水乙醇有利于NiS2O3晶体析出,其原因是____。
7.(2023·广东深圳·统考二模)金属铑(Rh)是一种高效催化剂,在有机合成中发挥重要作用。一种以高铜铑精矿(主要含Rh,还含有少量的Cu、Fe等杂质)为原料提取的工艺如下:
已知:阳离子交换过程可表示为
回答下列问题:
(1)基态Cu原子的价电子排布式为_______。
(2)“氯化溶解”后,Rh元素以的形式存在,其中Rh元素的化合价为_______。
(3)“定向脱铜”时,铜与铑的沉淀率随pH变化如下图所示,该过程需将溶液pH调至2,结合图像说明原因_______。
(4)“阳离子交换”过程中,溶液中被阳离子交换树脂吸附的金属阳离子主要有_______。
(5)“水解”过程中,发生反应的离子方程式为_______。
(6)铑锰催化剂可催化反应:。下列有关该反应的说法正确的是_______(填标号)。
A.存在极性共价键的断裂与形成
B.所有分子均为非极性分子
C.含碳化合物中心原子杂化轨道类型有与
D.的VSEPR模型为V形
E.催化剂可降低该反应的焓变,从而增大反应速率
(7)铑掺杂形成的催化剂,在光催化还原反应中有很高的催化效率。的晶胞结构如图所示。
①其中位于晶胞的体心,则所处的位置为晶胞的_______(填“顶角”或“棱心”);每个周围紧邻的共有_______个。
②当有1%的被替代后,晶体中会失去部分产生缺陷,此时平均每个晶胞所含数目为_______(保留三位小数)。
四、原理综合题
8.(2021·广东深圳·统考二模)氮氧化物(NOx)的排放对环境造成严重污染。回答下列问题:
I.工业上可利用C(s)+2NO(g)=CO2(g)+N2(g)反应处理氮氧化物。
(1)已知:N2(g)+O2(g)=2NO(g) ΔH1=+180.5kJ·mol-1,碳的燃烧热为393.5kJ·mol-1,则C(s)+2NO(g)=CO2(g)+N2(g) ΔH2=_______kJ·mol-1。
(2)某温度下,向盛有足量单质C的恒容密闭容器通入NO,使其初始浓度为1mol·L-1。根据平衡时以某物质表示的v正(或v逆)、浓度的数值,绘制出下图中甲、乙两点。
①乙点对应的物质是___(填化学式);该反应的平衡常数为____。
②将温度降低至某一温度时,反应重新达到平衡,此时体系的压强为p=105Pa,NO的体积分数为30%,则N2的分压为p(N2)=____Pa(分压=总压×物质的量分数);则图中甲点可能移动至____点位置(填字母标号)。
II.原煤经热解、冷却得到的煤焦可用于NO的脱除。热解温度为500℃、900℃得到的煤焦分别用S-500、S-900表示,相关信息如下表:
煤焦
元素分析(%)
比表面积(cm2∙g-1)
C
H
S-500
80.79
2.76
105.69
S-900
84.26
0.82
8.98
将NO浓度恒定的废气以固定流速通过如下反应器。不同温度下,进行多组平行实验,测定相同时间内NO的出口浓度,可得NO的脱除率与温度的关系如下图所示。[已知:NO的脱除主要含吸附和化学还原(ΔH<0)两个过程。]
(3)已知煤焦表面存在的官能团有利于NO的吸附,其数量与煤焦中氢碳质量比的值密切相关。由图可知,相同温度下,S-500对NO的脱除率比S-900的高,结合表格数据分析其可能原因是___、___。
(4)350℃后,随着温度升高,NO的脱除率增大的原因是____。
9.(2022·广东深圳·统考二模)CO、CO2加氢有利于缓解化石能源消耗,实现“碳中和”.该体系主要涉及以下反应:
反应I:CO(g)+2H2(g)CH3OH(g) ΔH1<0
反应II:2CO(g)+4H2(g)C2H5OH(g)+H2O(g) ΔH2<0
反应III:2CO2(g)+6H2(g)C2H5OH(g)+3H2O(g) ΔH3<0
反应IV:CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH4<0
反应V:2CH3OH(g)C2H5OH(g)+H2O(g) ΔH5
回答下列问题:
(1)上述反应中,ΔH5=____(写出一个代数式即可)。
(2)密闭容器中,上述反应体系在一定条件下建立平衡后,下列描述正确的有____(填标号)。
A.加入催化剂,可提高CO2的平衡转化率
B.降低温度,反应Ⅱ的正反应速率增大,逆反应速率减小
C.增大CO的浓度,反应Ⅲ、IV的平衡均向左移动
D.恒温恒容充入氩气,反应Ⅰ、Ⅱ的平衡不移动
(3)恒容下,n(CO)=n(CO2)=1mol,并按照不同氢碳比[]投料,发生上述反应。图甲表示不同氢碳比时,[CO+CO2]的总平衡转化率随温度变化的关系;图乙表示氢碳比=3时,平衡后体系中C2H5OH、CH3OH的选择性随温度变化的关系。
已知:CH3OH的选择性=×100%;C2H5OH的选择性=×100%
①图甲中x____3(填“大于”“小于”或“等于”),其原因是____。
②Q点对应的体系中n(CH3OH)=___mol;此时,H2转化了4mol,则反应2CH3OH(g)C2H5OH(g)+H2O(g)的平衡常数Kp=____(Kp为以分压表示的平衡常数,分压=总压×物质的量分数,结果保留两位有效数字)。
(4)常温常压下,以Ag为催化剂,在酸性水溶液中将CO2电催化还原为CO的反应历程如图所示:
①据图,CO和CO2相比,____(填化学式)更稳定。
②吸附在催化剂表面上的物种用*标注,图中第一步反应为CO2+e-+H+=*COOH,则第二步反应为____。
10.(2023·广东深圳·统考二模)“氧化法”和“光催化氧化法”常用于烟气脱硫、脱硝,对环境保护意义重大。回答下列问题:
Ⅰ.氧化法
(1)用氧化烟气中的时,体系中存在以下反应:
a)
b)
c)
根据盖斯定律,_______。
(2)在密闭容器中充入和,发生以下反应:
d)
e)
不同压强(p)下,的平衡转化率随反应温度(T)的变化关系如下图所示:
①由图可知,_______0(填“大于”或“小于”下同),_______。
②下列有关该反应体系的说法正确的是_______(填标号)。
A.恒压下,混合气体的密度保持不变时,说明反应体系已达到平衡
B.任意时刻,存在
C.恒容下,升高温度,该体系中气体颜色变浅
D.恒容下,增大的浓度,反应d、e的正反应速率均增大
③某温度下,平衡时的物质的量分数为,且与的物质的量分数相等,此时_______mol。
Ⅱ.光催化氧化法
光照条件下,催化剂表面产生电子()和空穴()。电子与作用生成离子自由基(),空穴与水电离出的作用生成羟基自由基(),和分别与反应生成。变化过程如下图所示:
(3)一定范围内,NO脱除速率随烟气湿度的增大而增大,结合催化剂的作用机理,分析可能的原因_______。
(4)已知该过程中生成的可继续与发生反应:;该反应可分两步进行,请补充反应ⅰ:
ⅰ._______;
ⅱ.。
(5)理论上“光催化氧化法”中,消耗的与生成的的物质的量之比为_______。
五、结构与性质
11.(2021·广东深圳·统考二模)硒是人体内不可缺少的微量元素,且硒及其化合物在生产、生活中有着广泛的应用。回答下列问题:
(1)基态Se原子的核外价电子排布图为_____。
(2)“依布硒”是一种有机硒化物,具有良好的抗炎活性,其结构简式如图所示。“依布硒”中Se原子的杂化类型为_______,元素Se、O、N的第一电离能由大到小的顺序为____。
(3)硒的某种氧化物为链状聚合结构(如下图所示),该氧化物的化学式为____。
(4)SeO的立体构型为__,与SeO互为等电子体的分子有____(填化学式,任写一种)。
(5)室温时,SeF6是一种气体,与SF6具有相似的结构,则熔、沸点大小:SeF6___SF6(填“>”或“<”或“=”)。
(6)二硒键和二硫键是重要的光响应动态共价键,其光响应原理可用下图表示。已知光的波长与其能量成反比,则图中实现光响应的波长:λ1____λ2(填“>”或“<”或“=”),其原因是____。
(7)我国科学家在真空条件下煅烧钴箔和硒粉,合成了具有优异电催化性能的硒化钴,其晶胞结构如下图所示。该硒化钴的化学式为___,晶体密度为____g·cm-3(用含a和c的式子表示,阿伏加德罗常数的值为NA)。
12.(2022·广东深圳·统考二模)硅及其化合物在生产生活中有广泛应用。根据所学知识,回答下列问题:
(1)三甲基卤硅烷【(CH3)3SiX,X为Cl、Br、I】是重要的化工原料。
①氯元素基态原子的价电子排布式为___;按照核外电子排布对元素周期表分区,溴元素位于___区;基态硅原子中有____种运动状态不同的电子。
②Br、I的第一电离能的大小关系:I1(Br)____I1(I)(填“大于”“小于”或“等于”)。
③常温下,(CH3)3SiI中Si—I键比(CH3)3SiCl中Si—Cl键易断裂的原因是____。
(2)(CH3)3SiCl可作为下列有机合成反应的催化剂。
①1个有机物A分子中采取sp2杂化的碳原子有____个。
②有机物B的沸点低于对羟基苯甲醛()的沸点,其原因是____。
③CH3CN中σ键与π键的个数比为____。
(3)一种钛硅碳新型材料可用作高铁车体与供电网的连接材料。该材料的晶胞属于六方晶系(a、b方向的夹角为120°,c方向垂直于a、b方向,棱长a+b≠c),如图甲所示;晶胞中碳原子的投影位置如图乙所示。
①该钛硅碳新型材料的化学式为____。
②已知该新型材料的密度为4.51g•cm-3,且a、b的长度均为307pm,阿伏加德罗常数的值用NA表示,则c的长度为____pm (列出计算式)。
六、有机推断题
13.(2021·广东深圳·统考二模)化合物H是一种新型抗癌药物的中间体,其一种合成路线如下:
回答下列问题:
(1)A的名称为_____,F所含官能团的名称为_____。
(2)④的反应类型为____,G的结构简式为____。
(3)反应③的化学方程式为____。
(4)反应⑤可能产生与E互为同分异构体的副产物,其结构简式为____。
(5)芳香化合物M是H的同分异构体。已知M的苯环上只有3个取代基且分子结构中不含-OH,M的核磁共振氢谱仅有四组峰,则M的结构简式为____。(任写一种)。
(6)参照上述合成路线,设计由合成的路线(乙醇、乙酸及无机试剂任选)_____。
14.(2022·广东深圳·统考二模)乙肝新药的中间体化合物J的一种合成路线如图:
已知:RCOOH
回答下列问题:
(1)A的化学名称为____。
(2)D中含氧官能团的名称为____。
(3)反应②中还有HBr生成,则M的结构简式为____。
(4)写出反应③的化学方程式____。
(5)由G生成J的过程中,设计反应④和反应⑤的目的是____。
(6)化合物Q是A的同系物,相对分子质量比A的多14;化合物Q的同分异构体中,同时满足下列条件的共有___种(不考虑立体异构)。
条件:①与FeCl3溶液发生显色反应;②能发生银镜反应;③苯环上取代基数目小于4。
其中,核磁共振氢谱有五组峰,且峰面积之比为2∶2∶1∶1∶1的结构简式为____。
(7)根据上述信息,以 和 为原料,设计合成 的路线(无机试剂任选)____。
15.(2023·广东深圳·统考二模)化合物Ⅷ是合成治疗心衰药物的中间体,该物质的合成路线片段如下(部分反应条件省略):
回答下列问题:
(1)化合物Ⅰ的分子式为_______,化合物Ⅷ中含氧官能团有_______(写名称)。
(2)Ⅱ→Ⅲ涉及两步反应,第一步反应类型为加成反应,第二步的反应类型为_______。
(3)Ⅴ→Ⅵ的化学方程式可表示为,化合物Ⅵ的结构简式为_______。
(4)化合物Ⅳ、Ⅴ、Ⅶ中,化合物_______(填标号)含有手性碳原子。
(5)化合物Y在分子组成上比化合物Ⅶ少两个,同时符合下列条件的Y的同分异构体有_______种,其中核磁共振氢谱有四组峰,且峰面积之比为2:2:2:1的结构简式为_______(任写一种)。
条件:①除苯环外不含其他环结构,且苯环上有两个取代基,其中一个为;
②可使溴的四氯化碳溶液褪色;
③可发生水解反应。
(6)根据上述信息,写出以溴乙烷的一种同系物及为原料合成的路线_______(无机试剂任选)。
参考答案:
1.AD
【分析】硅铍矿(主要含BeO、Fe2O3、SiO2和FeO等)在硫酸中酸浸后得到滤液①中含有的主要离子有H+、Be2+、Fe3+、Fe2+、和SO,二氧化硅过滤除去,然后加入氢氧化钠溶液将pH调节至9,氢离子被中和,Fe3+、Fe2+转化为金属氢氧化物沉淀,滤液为硫酸钠溶液,再加入过量氢氧化钠溶液使氢氧化铍生成BeO,再水解得到Be(OH)2。
【详解】A.氧化铁和氧化亚铁都是碱性氧化物,氧化铍属于两性氧化物,二氧化硅属于酸性氧化物,上述氧化物中只有二氧化硅不溶于稀硫酸,因此“酸浸”步骤所得“滤渣①”的主要成分为SiO2,故A说法错误;
B.滤液①中含有的主要离子有H+、Be2+、Fe3+、Fe2+、和SO,加入氢氧化钠溶液将pH调节至9,氢离子被中和,Be2+、Fe3+、Fe2+转化为金属氢氧化物沉淀,滤液为硫酸钠溶液,因此“滤液②”经处理后可获得副产品Na2SO4▪10H2O,故B说法正确;
C.Fe(OH)2和Fe(OH)3属于碱,Be(OH)2属于两性化合物,“碱溶”时只有氢氧化铍溶解在氢氧化钠溶液中,反应的离子方程式为:Be(OH)2+2OH-=BeO+2H2O,故C说法正确;
D.滤液③的主要阴离子是BeO,它发生水解的离子方程式为:BeO+2H2OBe(OH)2+2OH-,增大溶液的pH,平衡向左移动,不利于BeO的水解,故D说法错误;
故选AD。
2. 分液漏斗 Cu+H2O2+2HCl=CuCl2+2H2O 管内产生棕黄色的烟(CuCl2) 有利于产物(CuCl2)直接进入收集瓶,防止堵塞 在空气中灼烧 Cu Cu(OH)2与Al单质发生了反应 取少量Cu(OH)2悬浊液,加入AlCl3溶液,振荡 K===6.3×106>105,该反应进行较完全
【分析】根据题中图示,湿法制取CuCl2,在三颈烧瓶中加入铜屑、H2O2和浓盐酸,在电热搅拌下发生Cu+H2O2+2HCl=CuCl2+2H2O反应,NaOH溶液吸收尾气,防止污染环境;干法制取CuCl2,在石英管制取CuCl2,在集气瓶中收集CuCl2,NaOH溶液吸收多余的Cl2,避免污染环境;探究Al与CuCl2溶液反应,根据金属性强弱和实验现象回答紫红色固体为Cu,并提出两种猜测并进行相关验证,由Ksp进行相关计算;据此解答。
【详解】(1)根据题中图示可知,仪器a的名称为分液漏斗;答案为分液漏斗。
(2)在三颈烧瓶中加入铜屑、H2O2和浓盐酸,在电热搅拌下发生氧化还原反应生成CuCl2的化学方程式为Cu+H2O2+2HCl=CuCl2+2H2O;答案为Cu+H2O2+2HCl=CuCl2+2H2O。
(3)①石英管内发生Cu+Cl2CuCl2,观察到的现象为管内产生棕黄色的烟(CuCl2);答案为管内产生棕黄色的烟(CuCl2)。
②石英管直接伸入收集装置,该管较粗,其优点是有利于产物(CuCl2)直接进入收集瓶,防止堵塞;答案为有利于产物(CuCl2)直接进入收集瓶,防止堵塞。
(4)除上述两种方法外,实验室中还可先将铜粉在空气中灼烧,再加入适量稀盐酸反应得到CuCl2溶液,即2Cu+O22CuO,CuO+2HCl=CuCl2+H2O;答案为在空气中灼烧。
(5)由于Al的金属性比Cu强,将铝片放入盛有0.1mol·L-1CuCl2溶液,发生置换反应,即2Al+3Cu2+=2Al3++3Cu,则紫红色固体为Cu;答案为Cu。
(6)①由实验取少量Cu(OH)2悬浊液,加入打磨过的铝片,振荡,可推知,猜测i.是Cu(OH)2与Al单质发生了反应;答案为Cu(OH)2与Al单质发生了反应。
②由猜测ii.Cu(OH)2与Al3+发生了反应,可推知实验是取少量Cu(OH)2悬浊液,加入AlCl3溶液,振荡;答案为取少量Cu(OH)2悬浊液,加入AlCl3溶液,振荡。
③由2A13++3Cu(OH)2=2Al(OH)3+3Cu2+可知,K=====6.3×106>105,该反应进行较完全;答案为K===6.3×106>105,该反应进行较完全。
3.(1) I-会被空气中的O2氧化 2KI+2Pb(NO3)2=PbI↓+2KNO3
(2) 酸式滴定管 B ab或ba(答“de”“ed”“gh”“hg”“jk”“kj”均可) PbI2固体不断溶解
(3) 产生金黄色沉淀(或“产生亮黄色沉淀”“产生黄色浑浊”) 200 小于
【详解】(1)①I-具有较强还原性,会被空气中的O2氧化,导致KI溶液变质;
②根据题意KI和Pb(NO3)2发生复分解反应生成PbI2沉淀,根据元素守恒可得化学方程式为2KI+2Pb(NO3)2=PbI↓+2KNO3;
(2)①根据仪器X的结构特点可知其为酸式滴定管;
②由电导率变化曲线可知,电导率出现3次急剧的下降,说明蒸馏水是分三次快速放入,故选B;
③悬浊液导电是因为存在平衡PbI2Pb2++2I-,加水稀释后,离子浓度瞬间下降,电导率瞬间减小,之后反应正向移动,PbI2固体不断溶解,重新达到平衡,而PbI2饱和溶液中Pb2+和I-的浓度不变,所以平衡后电导率相同,即ab、de、gh、jk均可以表示PbI2固体的溶解达到平衡状态,而c→d段溶液的电导率逐渐增大的原因是PbI2固体不断溶解,导致了溶液中离子浓度不断增大;
(3)①增大PbI2饱和溶液中I-的浓度,沉淀溶解平衡逆向移动,清液中产生金黄色的PbI沉淀;
②为保证变量唯一,所用蒸馏水的体积应与所用“上层清液”的体积相同,即200mL;
③增大KI的浓度,PbI2沉淀溶解平衡向生成沉淀的方向移动,导致溶液中的离子浓度减小,电导率的变化会小于蒸馏水中,所以A2-A1小于B2-B1。
4.(1) 分液漏斗 苯
(2)
(3) 或对苯酚与的显色可能有影响 固体 ,(或) 与苯酚的显色时,存在反应:,增大,平衡逆向移动,的浓度减小,溶液颜色变浅
(4) 偏高
【分析】由题干工艺流程图可知,向含苯酚的废水中加入苯进行萃取,操作Ⅰ是萃取分液,分液后得到水层1和有机层,向有机层中加入NaOH溶液将苯酚转化为苯酚钠,然后进行分液,分液后得到有机层(含有苯)和水层,向水层溶液中通入足量的CO2后将苯酚钠转化为苯酚和碳酸氢钠溶液,然后进行过滤,过滤得到苯酚和水层2。再利用控制变量法进行探究氯离子、硫酸根离子、氢离子对显色的影响。
【详解】(1)由分析可知,操作Ⅰ为萃取、分液,因此使用的玻璃仪器有烧杯和分液漏斗,操作Ⅱ是分液,得到有机层(含有苯),则苯可以循环使用,故答案为:分液漏斗;苯。
(2)反应Ⅱ是苯酚钠和二氧化碳反应生成苯酚和碳酸氢钠溶液,苯酚溶解度比较小,过滤,则“水层2”中主要溶质为NaHCO3,故答案为:NaHCO3。
(3)①由题干实验信息可知,实验1、2和实验3、4使用溶液中的或不同,二者阴离子可能也对Fe3+的显色有影响,即根据实验结果,小组同学认为此结果不足以证明猜想3成立的理由是或对苯酚与的显色可能有影响,故答案为:或对苯酚与的显色可能有影响。
②为进一步验证猜想即验证或对苯酚与的显色是否有影响,小组同学设计了实验5和6,根据控制变量可知,实验5、6的pH值相同,Fe3+浓度相同,实验5改变浓度,实验6则改变浓度,故选用的试剂为Na2SO4固体,故答案为:Na2SO4固体。
③根据实验1~6的结果,小组同学得出猜想1不成立,猜想2成立,且对苯酚与的显色反应起抑制作用,说明氯离子对实验没有影响,则,硫酸根对实验有抑制作用,说明实验6相比实验1来说或;故答案为:,(或)。
④根据实验1~6的结果,小组同学得出猜想3成立,且对与苯酚的显色反应有抑制作用,从化学平衡角度解释其原因是与苯酚的显色时,存在反应:,增大,平衡逆向移动,的浓度减小,溶液颜色变浅;故答案为:与苯酚的显色时,存在反应:,增大,平衡逆向移动,的浓度减小,溶液颜色变浅。
(4)①加入溶液前需加热除去多余的,过量溴会氧化碘离子生成单质碘,则消耗硫代硫酸根的量增大,则计算出化合物M的量多,因此会使测定结果偏高;故答案为:偏高。
②根据苯酚与的关系是1:2,若消耗标准溶液的体积为,则样品中苯酚的浓度为;故答案为:。
5. 采用较强烈的搅拌转速 Cu(NH3)+Zn=Zn(NH3)+Cu NH3 “浸取” 2Bi+3Fe2(SO4)3+6NaCl=2BiCl3+3Na2SO4+6FeSO4 PbSO4 将Fe3+还原为Fe2+,避免在Bi3+水解时,Fe3+同时水解,导致产物不纯 过滤、洗涤、干燥 70%
【分析】瓦斯泥(主要含ZnO、Bi2O3、Bi2S3、Bi、Fe2O3,还含少量PbO、FeO、CuO;锌、铋两元素的质量分数分别为8.92%、0.75%),浸取之后过滤得到Cu(NH3)、Zn(NH3)、,滤渣1中的PbO和硫酸反应后,得到的滤渣2中会含有PbSO4,“水解”时加入适量的Zn粉可以将Fe3+还原为Fe2+,避免在Bi3+水解时,Fe3+同时水解,导致产物不纯,“水解”后,将得到的产品过滤、洗涤并干燥即可得到产品,以此解答。
【详解】(1)“浸取”时,为避免“瓦斯泥”在反应器的底部沉淀、结块,可采用较强烈的搅拌转速,故答案为:采用较强烈的搅拌转速;
(2)“过程Ⅰ”中Cu(NH3)和Zn反应生成Zn(NH3)和Cu,反应的离子方程式为Cu(NH3)+Zn=Zn(NH3)+Cu,故答案为:Cu(NH3)+Zn=Zn(NH3)+Cu;
(3)根据元素守恒可知,“过程Ⅱ”中会产生NH3,结合流程图可知,NH3可在流程中的“浸取”步骤中循环使用,故答案为:NH3;“浸取”;
(4)①根据题意,单质铋在Fe3+的氧化作用下被溶解,结合已知的化学方程式可知,剩下的一个化学方程式为Bi和Fe3+的反应,该反应的化学方程式为2Bi+3Fe2(SO4)3+6NaCl=2BiCl3+3Na2SO4+6FeSO4,故答案为:2Bi+3Fe2(SO4)3+6NaCl=2BiCl3+3Na2SO4+6FeSO4;
②滤渣1中的PbO和硫酸反应后,得到的滤渣2中会含有PbSO4,故答案为:PbSO4;
(5)①结合表中信息可知,“水解”时加入适量的Zn粉可以将Fe3+还原为Fe2+,避免在Bi3+水解时,Fe3+同时水解,导致产物不纯,故答案为:将Fe3+还原为Fe2+,避免在Bi3+水解时,Fe3+同时水解,导致产物不纯;
②“水解”后,将得到的产品过滤、洗涤并干燥即可得到产品,故答案为:过滤、洗涤、干燥;
(6)处理3.6t“瓦斯泥”,得到26.05kg的“BiOCl产品”,其中BiOCl质量分数为90%,则铋的回收率为70%,故答案为:70%。
6.(1) 阳 H2
(2)2Fe2++ClO-+2H+=2Fe3++Cl-+H2O
(3)CuS
(4)9.15
(5) NaCl Na2SO4
(6) BaS2O3+NiSO4=NiS2O3+BaSO4 该反应的K==1.6×105,K大于105,反应进行得较完全; 降低NiS2O3的溶解度
【分析】先将高磷镍铁制成电极板,进行电解,Ni、Fe、Zn、Cu转化为阳离子进入溶液,之后加入NaClO将Fe2+氧化为Fe3+,然后加入Na2CO3调pH=2,并将溶液加热至50℃,形成铁、磷共沉淀;过滤后加入H2S除去Cu2+和Zn2+;过滤后向滤液中加入NaOH得到Ni(OH)2沉淀,过滤、水洗沉淀后,加入硫酸溶解,得到硫酸镍溶液,经系列处理得到NiSO4·6H2O。
(1)
电解的主要目的应是将金属元素转化为相应的金属阳离子,所以高磷镍铁应为阳极,被氧化;阴极主要为氢离子放电,所以主要产物为H2;
(2)
“除铁磷”时,ClO-将Fe2+氧化为Fe3+,根据电子守恒、元素守恒可得离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O;
(3)
“除铁磷”后主要杂质还有Cu2+、Zn2+,所以加入H2S除杂时得到的“滤渣2”的主要成分为ZnS和CuS;
(4)
当溶液中c(Ni2+)=1.0×10-5mol·L-1时,c(OH-)==mol/L=×10-5mol/L,所以c(H+)=×10-9mol/L,此时pH=-lg c(H+)=9.15,所以理论上应调节溶液pH≥9.15;
(5)
ClO-会被还原为Cl-,电解时选用2mol·L-1硫酸溶液为电解液,所以溶液中阴离子还有SO,而阳离子只剩加入的Na+,所以“母液”中的溶质主要有NaCl、Na2SO4;
(6)
①根据题意,NiSO4溶液可以使BaS2O3沉淀转化为BaSO4沉淀,同时得到NiS2O3,化学方程式为BaS2O3+NiSO4=NiS2O3+BaSO4;该反应的平衡常数K====1.6×105,K大于105,反应进行得较完全;
②无水乙醇可以降低NiS2O3的溶解度,利于晶体析出。
7.(1)
(2)
(3)时,铜的沉淀率已超过80%,铑的沉淀率几乎为零。或时,铜的沉淀率会降低,时,铑的沉淀率增加
(4)、
(5)
(6)AC
(7) 顶角 6 2.995
【分析】高铜铑精矿通入氯气和HCl氯化溶解得到、CuCl2、FeCl3,加入草酸和铜离子结合生成草酸铜,加入NaOH调节溶液pH=2,避免铁离子沉淀,阳离子交换树脂吸附Na+、Fe3+为滤液除去,发生水解反应生成Rh(OH)3沉淀,最后得到铑粉;
【详解】(1)Cu元素为29号元素,原子核外有29个电子,所以核外电子排布式为:1s2s22p63s23p63d104s1,基态铜原子价层电子排布式为3d104s1;
(2)中Cl为-1价,由x+(-1)×6=-3,解得x=+3,则Rh元素的化合价为+3;
(3)“定向脱铜”时,需将溶液pH调至2,原因是:时,铜的沉淀率已超过80%,铑的沉淀率几乎为零。或时,铜的沉淀率会降低,时,铑的沉淀率增加;
(4)定向脱铜后溶液得到草酸钠、FeCl3,“阳离子交换”过程中,溶液中被阳离子交换树脂吸附的金属阳离子主要有、;
(5)发生水解反应生成Rh(OH)3沉淀,水解的离子方程式为:;
(6)A.反应物CO2中C和O原子存在极性共价键,产物存在C-H和H-O极性键,则反应过程中存在极性共价键的断裂与形成,A正确;
B.H2O分子的正负电荷中心不对称,为极性分子,B错误;
C.CO2中C原子价层电子对个数=2+=2,采取sp杂化方式,CH4中心原子C的价层电子对数是4,则C原子杂化轨道类型为sp3杂化,C正确;
D.H2O分子中O原子的价层电子对数为2+=4,VSEPR模型为四面体,D错误;
E.催化剂通过降低反应的活化能,从而增大反应速率,不能改变反应的焓变,E错误;
故选:AC;
(7)①其中位于晶胞的体心,由晶胞结构可知白球为,顶角的小黑球个数为,棱心的大黑球个数为,结合分子数可知大黑球为O离子,小黑球为,则所处的位置为晶胞的顶角;每个周围紧邻的共有6个;
②当有1%的被替代后阳离子电荷减少了1%×1=0.01,根据电荷守恒,阴离子电荷也相应减少=0.005,晶体中会失去部分产生缺陷,原晶胞中数目为3,则此时平均每个晶胞所含数目为3-0.005=2.995。
8. -574 NO Q 热解温度高,煤焦H/C比值小,表面官能团减少 S-900的比表面积小,吸附能力弱 温度升高,反应速率增大
【详解】(1)已知:
N2(g)+O2(g)=2NO(g) ΔH1=+180.5kJ·mol-1,碳的燃烧热为393.5kJ·mol-1,
ΔH=-393.5kJ·mol-1
将下式-上式可得目标方程式,则,可知ΔH2=-574kJ·mol-1。故答案为:-574;
(2)①达到平衡时NO表示的正反应速率应为N2表示的逆反应速率的两倍,则乙点对应的物质为NO;则平衡时,c(NO)=0.4mol/L,该反应的平衡常数。故答案为:NO,;
②将温度降低至某一温度时,反应重新达到平衡,NO的体积分数为30%,可知N2的体积分数为,则此时N2的分压。该反应为放热反应,降低温度平衡会朝着正反应方向移动,c(NO)减小,c(N2)增大,且降温度会使得反应速率减慢,可知图中甲点可能移动至Q点位置。故答案为:,Q;
(3)煤焦表面存在的官能团有利于NO的吸附,其数量与煤焦中氢碳质量比的值密切相关。由图可知,相同温度下,S-500对NO的脱除率比S-900的高,结合表格数据以及图示分析,可能的原因是:热解温度高,煤焦H/C比值小,表面官能团减少、S-900的比表面积小,吸附能力弱。故答案为:热解温度高,煤焦H/C比值小,表面官能团减少;S-900的比表面积小,吸附能力弱
(4)350℃后,随着温度升高,反应速率增大,NO的脱除率增大。
故答案为:温度升高,反应速率增大。
9.(1)ΔH2-2ΔH1或ΔH3-2ΔH4
(2)CD
(3) 大于 相同温度下,氢碳比越大(或增加氢气的物质的量),该体系加氢反应的平衡向右进行,CO和CO2的平衡转化率均增大,故x>3 0.8 0.75
(4) CO2 *COOH+H++e-=H2O+*CO
【详解】(1)根据盖斯定律,Ⅱ-Ⅰ×2可得V,Ⅲ-2×Ⅳ也可得V,所以ΔH5=ΔH2-2ΔH1或ΔH3-2ΔH4;
(2)A.催化剂可以加快反应速率,但不能改变平衡转化率,A错误;
B.降低温度,正逆反应速率均减小,B错误;
C.增大CO的浓度,反应Ⅰ、Ⅱ平衡正向移动,CH3OH(g)、C2H5OH(g)的浓度增大,反应Ⅲ、IV的平衡均向左移动,C正确;
D.氩气不参与反应,恒温恒容充入氩气,反应Ⅰ、Ⅱ中的反应物和生成物的浓度均不改变,平衡不移动,D正确;
综上所述答案为CD;
(3)①相同温度下,氢碳比越大(或增加氢气的物质的量),该体系加氢反应的平衡向右进行,CO和CO2的平衡转化率均增大,故x>3;
②Q点[CO+CO2]的总平衡转化率为80%,乙醇和甲醇的选择性均为50%,所以n(CH3OH)=(1mol+1mol)×80%×50%=0.8mol;n(C2H5OH)=(1mol+1mol)×80%×50%×=0.4mol,设H2O(g)的物质的量为x mol,H2转化了4mol,则根据H元素守恒有4×0.8mol+6×0.4mol+2x mol=4mol×2,解得x=1.2mol,该反应前后气体系数之和相等,所以可以用物质的量代替分压计算平衡常数Kp,则平衡常数Kp==0.75;
(4)①据图可知CO2的能量低于CO,所以CO2更稳定;
②据图可知第二步反应中*COOH结合H++e-转化为H2O和*CO,化学方程式为*COOH+H++e-=H2O+*CO。
10.(1)
(2) 小于 小于 AD
(3)随着烟气湿度的增大,更多的在催化剂表面转化为,提高了的氧化速率
(4)
(5)3:4
【详解】(1)根据盖斯定律,(反应b+反应c)可得反应a,则(-286.6-196.6)= ;
(2)①由图可知,同一压强下,温度升高的平衡转化率减小,说明平衡逆向移动,该反应为放热反应,则小于0,同一温度下,增大压强反应d的平衡逆向移动,减小,则小于;
②A.恒压下混合气体的总质量不变,但反应前后气体分子数不相等即物质的量会发生变化,根据pV=nRT,容器的体积会发生变化,则密度是一变量,当密度保持不变时,说明反应体系已达到平衡,故A正确;
B.任意时刻,由氮元素质量守恒,存在,故B错误;
C.恒容下,升高温度,反应d正向移动,c(NO2)增大,则该体系中气体颜色变深,故C错误;
D.恒容下,增大的浓度,则压强变大,反应d、e的正反应速率均增大,故D正确;
故选:AD;
③起始充入和,列三段式:、,平衡时的物质的量分数为,则,且与的物质的量分数相等,则2x=y,联立两式,解得x=0.1,y=0.2,此时0.2mol=mol;
(3)一定范围内,NO脱除速率随烟气湿度的增大而增大,可能的原因是:随着烟气湿度的增大,更多的在催化剂表面转化为,提高了的氧化速率;
(4)将总反应减去反应ii可得反应i为;
(5)“光催化氧化法”中由H2O电离出的, 和分别与反应生成,N元素化合价升高了3,生成1mol失去3mol电子,而电子与作用生成离子自由基(),消耗1mol得到4mol电子,由得失电子守恒有关系式3~3~4,消耗的与生成的的物质的量之比为3:4。
11. sp3 N >O >Se (SeO2)n 三角锥形 NCl3 SeF6>SF6 < 硫半径小于硒半径,S-S键的键长小于Se-Se键长,硫硫键的键能大于硒硒键的键能,则光谱能量高,波长短 CoSe
【详解】(1)Se所含质子数为34,原子核外电子数为34,核外电子排布为:[Ar]3d104s24p4;基态Se原子的核外价电子排布图为:。
(2)根据结构简式,“依布硒”中Se原子的杂化类型为sp3杂化,N原子为半充满状态,电离能最大,元素Se、O、N的第一电离能由大到小的顺序为:N >O >Se。
(3)硒的某种氧化物为链状聚合结构,该氧化物的化学式为(SeO2)n。
(4)SeO中的Se为sp3杂化且有一对孤电子对,立体构型为三角锥形,SeO有26个电子,与SeO互为等电子体的分子有NCl3。
(5)室温时,SeF6是一种气体,与SF6具有相似的结构,且为分子晶体,相对分子质量越大,分子间作用越大,则熔、沸越高,SeF6>SF6;
(6)二硒键和二硫键是重要的光响应动态共价键,其光响应原理可用下图表示。已知光的波长与其能量成反比,则图中实现光响应的波长:λ1<λ2,其原因是硫半径小于硒半径,S-S键的键长小于Se-Se键长,S-S键的键能大于Se-Se键的键能,则光谱能量高,波长短。
(7)我国科学家在真空条件下煅烧钴箔和硒粉,合成了具有优异电催化性能的硒化钴,其晶胞结构如下图所示。根据均摊法Co:8×,Se=2,该硒化钴的化学式为CoSe;晶胞地面键角为60°,晶胞体积为=,晶体密度为g·cm-3。
12.(1) 3s23p5 p 14 大于 I原子半径比Cl的原子半径大,导致Si-I键键能较小,较易断裂;而Si-Cl键键能较大,较不易断裂
(2) 7 邻羟基苯甲醛主要形成分子内氢键,而对羟基苯甲醛只能形成分子间氢键,所以后者的熔点高于前者 5:2
(3) Ti3SiC2
【详解】(1)①Cl原子核外有17个电子,核外电子排布式为[Ne] 3s23p5,价电子为3s23p5;溴原子的价电子为4s24p5,属于p区;硅原子核外有14个电子,每个电子的运动状态各不相同,即有14种运动状态不同的电子;
②同主族自上而下第一电离能减小,所以I1(Br)大于I1(I);
③I原子半径比Cl的原子半径大,导致Si-I键键能较小,较易断裂;而Si-Cl键键能较大,较不易断裂;
(2)①苯环上的碳原子以及碳氧双键中的碳原子为sp2杂化,共有7个;
②B为邻羟基苯甲醛,羟基与醛基距离较近,主要形成分子内氢键,而对羟基苯甲醛只能形成分子间氢键,分子间氢键可以增大熔点,所以后者的熔点高于前者;
③单键均为σ键,碳氮三键中有一个σ键、两个π键,所以σ键与π键的个数比为5:2;
(3)①根据均摊法,Ti原子的个数为8×+4×+4=6,Si原子的个数为8×=2,C原子的个数为4,Ti、Si、C原子的个数比为6:2:4=3:1:2,所以化学式为Ti3SiC2;
②晶胞的质量为g=g,密度为4.51g•cm-3,所以晶胞的体积为cm3=pm,底面为边长307pm的菱形,则底面积为×3072pm3,所以c的长度为pm。
13. 环己醇 碳氯键、醚键 消去反应 +NaOH+NaBr+H2O 、、 、
【分析】结合反应条件和各物质的分子式分析,B和Br2发生取代反应生成,可以推知B为,A发生氧化反应生成B,可知A为,发生消去反应生成C,可知C为,D发生消去反应生成 CH2=C(CH3)CH3,E和ClCH2OCH3发生取代反应生成G,结合H的结构式可知G为,以此解答。
【详解】(1)由上述分析可知,A的名称为环己醇,F所含官能团的名称为碳氯键、醚键。
(2)由分析可知,④的反应类型为消去反应,G的结构简式为。
(3)反应③中发生消去反应生成C,化学方程式为 +NaOH+NaBr+H2O,故答案为:+NaOH+NaBr+H2O;
(4)反应⑤可能产生与E互为同分异构体的副产物,结合反应⑤的反应物以及E的结构简式可知,该副产物的结构可能为。
(5)芳香化合物M是H的同分异构体。已知M的苯环上只有3个取代基且分子结构中不含,M的核磁共振氢谱仅有四组峰,符合上述条件的M的结构可能是、 、 、。
(6)目标产物可由得到,可由在NaOH的醇溶液中发生消去反应得到,可由与反应得到,合成路线可表示为 。
14.(1)对溴苯甲酸或4-溴苯甲酸
(2)硝基、酯基
(3)
(4) +H2O
(5)保护羧基
(6) 23
(7)
【分析】在浓硫酸催化下与浓硝酸发生硝化反应生成B,结合B的分子式及后边产物D的结构可推出B为,在浓硫酸催化下与甲醇发生酯化反应生成C为,与化合物M反应生成D,根据D的结构简式及C的分子式的差别推出M为,发生取代反应生成D和溴化氢;E在一定条件下反应生成F,根据F的分子式可推知E发生水解生成甲醇和F,F为。
【详解】(1)A为,化学名称为对溴苯甲酸或4-溴苯甲酸;
(2)D为,含氧官能团的名称为硝基、酯基;
(3)反应②中还有HBr生成,则M的结构简式为;
(4)反应③是在催化剂作用下发生分子内脱水成肽反应生成和水,反应的化学方程式为 +H2O;
(5)由G生成J的过程中,设计反应④和反应⑤先将羧基转化为酯基,再将酯基转化为羧基,故其目的是保护羧基;
(6)化合物Q是A()的同系物,相对分子质量比A的多14,则多一个CH2;化合物Q的同分异构体中,同时满足条件:①与FeCl3溶液发生显色反应,则含有酚羟基;②能发生银镜反应,则含有醛基;③苯环上取代基数目小于4,若除酚羟基外还有一个取代基,则可以为-CH(Br)CHO,与酚羟基的位置有邻、间、对位共3种;若还有两个取代基,则有溴原子、-CH2CHO或-CH2Br和-CHO,跟酚羟基一起定一动二,分别有10种,故共有23种同分异构体;其中,核磁共振氢谱有五组峰,且峰面积之比为2∶2∶1∶1∶1的结构简式为;
(7)以发生硝化反应生成硝基苯,硝基苯还原得到苯胺,苯胺与反应生成,合成的路线如下: 。
15.(1) 醚键、酰胺基
(2)取代反应
(3)
(4)Ⅶ
(5) 9 或或
(6)CH3CH2CH2CH2BrCH3CH2CH2CH2OHCH3CH2CH2CHO
【分析】有机物Ⅰ和单质溴发生苯环上氢的取代反应生成有机物Ⅱ,有机物Ⅱ中的醛基和乙二醇反应生成有机物Ⅲ,在一定条件下有机物Ⅲ和碘甲烷反应取代反应苯环上引入甲基生成有机物Ⅳ,有机物Ⅳ和五氯化磷反应生成有机物Ⅴ,Ⅴ→Ⅵ的化学方程式可表示为,根据原子守恒和有机物Ⅶ的结构简式可判断化合物Ⅵ的结构简式为,有机物Ⅶ经一系列转化为生成有机物Ⅷ,据此解答。
【详解】(1)根据化合物Ⅰ的结构简式可判断分子式为,根据化合物Ⅷ的结构简式可判断其中含氧官能团有醚键、酰胺基。
(2)Ⅱ→Ⅲ涉及两步反应,第一步反应类型为加成反应,即醛基和乙二醇加成醛基转化为羟基,然后2个羟基脱去1分子水生成Ⅲ,所以第二步的反应类型为取代反应。
(3)根据以上分析可知化合物Ⅵ的结构简式为。
(4)手性碳原子是指与四个各不相同原子或基团相连的碳原子,所以化合物Ⅶ中含有手性碳原子,即与-CN相连的碳原子是手性碳原子。
(5)化合物Y在分子组成上比化合物Ⅶ少两个,分子式为C9H7NO2,同时符合下列条件①除苯环外不含其他环结构,且苯环上有两个取代基,其中一个为,②可使溴的四氯化碳溶液褪色;③可发生水解反应,因此另一个取代基是含有三键的酯基,可以是-C≡COOCH或-COOC≡CH或-OOCC≡CH,与氨基均有邻间对三种,因此Y的同分异构体有9种,其中核磁共振氢谱有四组峰,且峰面积之比为2:2:2:1的结构简式为或或 。
(6)根据已知信息可知要合成产品需要丁醛和,丁醛可以用丁醇催化氧化得到,溴丁烷水解得到丁醇,所以合成路线图为CH3CH2CH2CH2BrCH3CH2CH2CH2OHCH3CH2CH2CHO。
广东省深圳市2021届-2023届高考化学三年模拟(二模)按题型分类汇编-选择题: 这是一份广东省深圳市2021届-2023届高考化学三年模拟(二模)按题型分类汇编-选择题,共35页。试卷主要包含了单选题等内容,欢迎下载使用。
广东省汕头2021届-2023届高考化学三年模拟(二模)按题型分类汇编-非选择题: 这是一份广东省汕头2021届-2023届高考化学三年模拟(二模)按题型分类汇编-非选择题,共38页。试卷主要包含了工业流程题,填空题,原理综合题,结构与性质,有机推断题,实验题等内容,欢迎下载使用。
广东省佛山市2021届-2023届高考化学三年模拟(二模)按题型分类汇编-非选择题: 这是一份广东省佛山市2021届-2023届高考化学三年模拟(二模)按题型分类汇编-非选择题,共37页。试卷主要包含了实验题,工业流程题,原理综合题,结构与性质,有机推断题等内容,欢迎下载使用。












