

安徽省蚌埠市2020-2022三年高一化学下学期期末试题汇编3-非选择题
展开安徽省蚌埠市2020-2022三年高一化学下学期期末试题汇编3-非选择题
1. (2020春·安徽蚌埠·高一期末)有下列几组物质:
①和 ②D和T ③甲烷(CH4)与丙烷(C3H8) ④O2与O3 ⑤H2O和H2O2 ⑥和
(1)互为同位素的是______________(填序号,下同)。
(2)互为同素异形体的是________________。
(3)互为同分异构体的是________________。
(4)属于同一种物质的是________________。
2. (2020春·安徽蚌埠·高一期末)1mol烃在氧气中完全燃烧,生成CO2和H2O的物质的量相等,并消耗标准状况下168L氧气。通过计算确定该有机化合物的分子式______。
3. (2021春·安徽蚌埠·高一统考期末)某温度时,在2L的密闭容器中,X、Y、Z(均为气体)的物质的量随时间的变化曲线如图所示。请回答下列问题:
(1)写出该反应的化学方程式___________。
(2)反应开始至2min时用X的浓度变化表示的平均反应速率v(X)= ___________。
51.(2021春·安徽蚌埠·高一统考期末)燃烧法是测定有机物分子式的一种重要方法。将0.1mol某烃在氧气中完全燃烧,得到二氧化碳在标准状况下体积为4.48L,生成水为5.4g,求:
(1)该烃的分子式___________。
(2)写出可能的结构简式___________。
4. (2022春·安徽蚌埠·高一统考期末)某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
(1)该反应的化学方程式为_______。
(2)反应开始至2min,以气体Z表示的平均反应速率为_______。
(3)2min反应达到平衡,容器内混合气体的平均相对分子质量比起始时_______(填“大”、“小”或“相等”下同),混合气体密度比起始时_______。
(4)下列叙述能证明该反应已经达到化学平衡状态的是(填序号)_______。
A.Y的体积分数不再变化
B.容器内气体压强不再变化
C.v(X):v(Y)=3:1
D.单位时间内消耗3nmolX同时生成2nmolZ
5. (2022春·安徽蚌埠·高一统考期末)称取某有机物(含C、H、O元素)2.3g样品,经充分燃烧后,产生CO24.4g、H2O2.7g。计算:
(1)该有机物中C、H、O原子个数比_______。
(2)若该有机物的相对分子质量为46,且能与金属钠反应放出氢气,请写出该有机物的结构简式_______。
6. (2020春·安徽蚌埠·高一期末)400℃时,将一定量的SO2和14molO2压入一个盛有催化剂的10L密闭容器中进行反应:2SO2+O2⇌2SO3。已知2min时,容器中剩余2molSO2和12molO2。试计算:
(1)SO2的起始物质的量浓度__________________。
(2)2min内SO3的反应速率____________________。
7. (2021春·安徽蚌埠·高一统考期末)燃烧法是测定有机物分子式的一种重要方法。将0.1mol某烃在氧气中完全燃烧,得到二氧化碳在标准状况下体积为11.2L,生成水为10.8g,求:
(1)该烃的分子式___________。
(2)写出可能的结构简式___________。
8. (2022春·安徽蚌埠·高一统考期末)一定温度下,在某体积为2L的密闭容器中充入1.5molNO2和2molCO,在一定条件下发生反应:NO2(g)+CO(g)CO2(g)+NO(g),2min时,测得容器中NO的物质的量为0.5mol。
(1)此段时间内,用CO2表示的平均反应速率_______。
(2)2min时,CO的转化率_______。
(3)平衡时,CO为1mol,求CO2的体积分数_______。
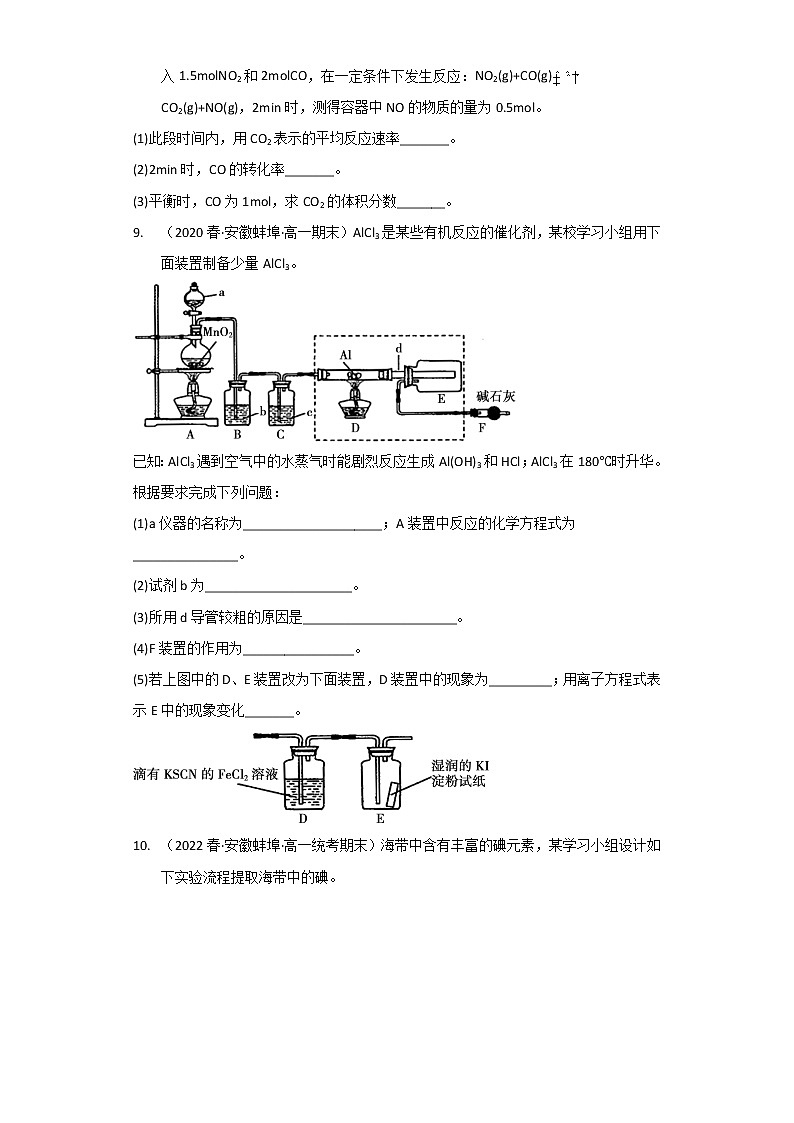
9. (2020春·安徽蚌埠·高一期末)AlCl3是某些有机反应的催化剂,某校学习小组用下面装置制备少量AlCl3。
已知:AlCl3遇到空气中的水蒸气时能剧烈反应生成Al(OH)3和HCl;AlCl3在180℃时升华。根据要求完成下列问题:
(1)a仪器的名称为____________________;A装置中反应的化学方程式为_______________。
(2)试剂b为_____________________。
(3)所用d导管较粗的原因是______________________。
(4)F装置的作用为________________。
(5)若上图中的D、E装置改为下面装置,D装置中的现象为_________;用离子方程式表示E中的现象变化_______。
10. (2022春·安徽蚌埠·高一统考期末)海带中含有丰富的碘元素,某学习小组设计如下实验流程提取海带中的碘。
请回答下列问题:
(1)仪器A的名称为_______,操作A为_______。
(2)由步骤X中到步骤Y一系列操作的目的是_______。
(3)步骤Y中发生反应的离子方程式为_______。
(4)某同学想证明氧化性Br2>I2,现有以下试剂可供选择:
①新制溴水②新制碘水③NaBr溶液④NaI溶液⑤AgNO3溶液⑥CCl4
选用试剂(填标号)
实验操作与现象
_______
_______
11. (2020春·安徽蚌埠·高一期末)下表为10种元素在元素周期表中的位置,请回答有关问题:
ⅠA
ⅡA
…
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
2
①
②
3
③
④
⑤
⑥
⑦
⑧
4
⑨
⑩
(1)表中最活泼的金属是___(填元素符号,下同),非金属性最强的元素是_____。
(2)表中能形成两性氢氧化物的元素是____,写出该元素的氢氧化物与⑨最高价氧化物对应的水化物反应的化学方程式____。
(3)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱_____。
12. (2021春·安徽蚌埠·高一统考期末)下表是元素周期表的一部分,表中所列的每个字母分别代表某一元素。
a
g
i
b
d
f
h
j
l
m
c
k
(1)表中所列短周期元素中,原子半径最大的是___________(填元素符号)。
(2)元素b、d、f的最高价氧化物对应水化物的碱性较强的为___________(填化学式)。
(3)元素j、l的氢化物的稳定性从强到弱的顺序为___________(填化学式)。
(4)由a、g、i三种元素组成的离子化合物是___________,在实验室检验该化合物中阳离子的方法是___________。
13. (2020春·安徽蚌埠·高一期末)A、B、C、D、E为五种常见的有机物,它们之间的转化关系如图1所示。其中A是一种可以使溴水及酸性KMnO4溶液褪色的气体,可作为水果的催熟剂。D分子的模型如图2所示。
图1
D分子的模型
图2
请回答下列问题:
(1)由B生成C的反应类型是________。
(2)A的结构简式为________,D中的官能团为______。
(3)B与D反应生成E的化学方程式为__________________________________。
(4)请写出B的一种用途:_____________________________________________。
14. (2021春·安徽蚌埠·高一统考期末)I.A是化学实验室中最常见的有机物乙醇,俗名酒精,它易溶于水并有特殊香味,能进行如右图所示的多种反应。
(1)写出A的官能团名称___________。
(2)反应④的化学反应方程式___________。
(3)下列关于化合物B的化学性质,说法正确的是___________(填标号)。
a.可以与氧气发生取代反应
b.可以使溴的四氯化碳溶液褪色
c.不可以使酸性高锰酸钾溶液褪色
Ⅱ.“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题:
(4)写出制取乙酸乙酯的化学反应方程式___________,反应类型___________。
(5)试管B中盛放的溶液是饱和碳酸钠溶液,其主要作用是___________。
a.溶解乙醇
b.吸收挥发出来的乙酸
c.降低乙酸乙酯溶解度
(6)装置中通蒸气的导管不能插入试管B的溶液中,目的是___________。
15. (2022春·安徽蚌埠·高一统考期末)A是一种常见的有机物,其产量被用作衡量一个国家石油化工产业发展水平的标志,F是高分子化合物,有机物A可以实现如图所示的转化。
请回答下列问题:
(1)A的结构式为_______。
(2)D的官能团名称为_______,④的反应类型为_______。
(3)请写出⑤反应的化学方程式_______。
(4)在实验室中,可用如图所示装置制取少量G,试管a中盛放的试剂是_______。
16. (2021春·安徽蚌埠·高一统考期末)我国有漫长的海岸线,海洋资源十分丰富。工业上从海水中提取与Mg的流程如下:
(1)镁元素在元素周期表中位置___________。
(2)从海水中提取溴的主要步骤是向浓缩的海水中通入氯气,将溴离子氧化,该反应的离子方程式是___________。
(3)反应③利用了的还原性,反应的离子方程式为___________。
(4)工业上常用熟石灰而不用烧碱沉淀,优点是___________。在实验室中,如何检验已经沉淀完全___________。
(5)步骤①②之后并未直接用“含的海水”进行蒸馏得到液溴,而是经过“空气吹出”“吸收”“氧化”等步骤后再蒸馏,这样设计工艺的意义是___________。
(6)用下面提供的试剂,设计简单的实验证明溴的非金属性比碘强(已知和溶在水中浓度较稀时都呈黄色)___________。(可选择的试剂:溴水、碘水、KI溶液、四氯化碳、氯水、淀粉溶液)
17. (2022春·安徽蚌埠·高一统考期末)下表为元素周期表的一部分,针对表中①~⑧元素,回答下列问题
①
②
③
④
⑤
⑥
⑦
⑧
(1)写出⑧的原子结构示意图_______。
(2)③元素在周期表中的位置是第二周期第_______族。
(3)写出②的最高价氧化物的电子式_______。
(4)⑤和⑥两种元素的最高价氧化物对应水化物中碱性较强的是_______(填化学式)。
(5)⑤的单质在③中燃烧,产物所含化学键的类型_______。
参考答案:
1. ② ④ ① ⑥
【分析】质子数相同而中子数不同的同一种元素的不同核素互为同位素;同种元素组成的不同单质互为同素异形体;分子式相同而结构不同的化合物互为同分异构体;分子式和结构都相同的物质为同一物质,根据概念进行判断。
【详解】①和的分子式相同,都为C8H10,但二者结构不同,互为同分异构体;
②D和T质子数都为1,中子数分别为1、2,质子数相同而中子数不同,D和T是氢元素的不同核素,互为同位素;
③甲烷(CH4)与丙烷(C3H8)的结构相似,分子组成上相差2个CH2原子团,互为同系物;
④O2与O3是氧元素组成的不同单质,互为同素异形体;
⑤H2O和H2O2组成元素相同,但分子式和结构都不同,属于两种不同物质;
⑥ 和写法不同,但分子式和结构都相同,属于同一物质。
综上所述,互为同位素的是②;互为同素异形体的是④;互为同分异构体的是①;属于同一种物质的是⑥,答案为:②;④;①;⑥。,
【点睛】四同的比较首先要清楚判断对象,如同位素的判断对象是核素,同素异形体的判断对象是单质,同系物和同分异构体的判断对象一般是有机化合物等,先将所给对象分类,再进行判断。
2. C5H10
【详解】设烃的分子式为CxHy,1mol烃在氧气中完全燃烧,并消耗标准状况下168L氧气,则n(O2)==7.5mol,根据烃燃烧的化学方程式可知 则由生成CO2和H2O的物质的量相等,得出x= ,①y=2x,由消耗O2的量得②x+ =7.5,联立①②,解之得x=5,y=10,有机化合物的分子式为C5H10;答案为C5H10。
3. 0.075mol/(L·min)
【详解】(1)由图可得:X、Y为反应物,Z为生成物,,,,,方程式为:;
(2) 。
4.
【详解】(1)由题意得:,,设该烃的分子式为,则,即该烃的分子式为:;
(2) 该烃的分子式为,是乙烷,可能的结构简式为。
5. (1)3X+Y 2Z
(2)0.02mol·L-1·min-1
(3) 大 相等
(4)AB
【解析】(1)由图可知,X、Y为反应物,Z为生成物,因为反应的化学计量数之比等于各物质的转化量之比,即X、Y、Z的化学计量数之比为0.3:0.1:0.2=3:1:2,又因为2min后反应物的物质的量不变且不为0,故该反应为可逆反应,因此反应的化学方程式为3X+Y 2Z,故答案为:3X+Y 2Z。
(2)反应开始至2min,生成气体Z为0.2mol,则用Z表示的平均反应速率,故答案为:0.02mol·L-1·min-1。
(3)2min时,反应达平衡,由反应方程式可知混合气体总物质的量减小,而总质量不变,所以容器内混合气体的平均相对分子质量比起始时大;由于混合气体的总质量自始至终不变,而在恒容容器中发生反应,因此混合气体的密度与起始时相等;故答案为:大;相等。
(4)A.开始时随着反应的进行,Y的体积分数逐渐减小,当反应达到平衡时,Y的体积分数不再变化,A项正确;B.该反应为气体分子数减小的反应,在恒容条件下,当容器内气体压强不再变化时,反应达到平衡,B项正确;C.当v(X):v(Y)=3:1时,不能证明反应正逆反应速率相等,无法说明反应达到平衡,C项错误;D.单位时间内消耗3nmolX同时生成2nmolZ,均为正反应方向,不能说明反应达到平衡状态,D项错误;故答案为:AB。
6. (1)2:6:1
(2)CH3CH2OH
【分析】称取某有机物(含C、H、O元素)2.3g样品,经充分燃烧后,产生CO24.4g,含C的物质的量为=0.1mol,H2O2.7g,其中H原子的物质的量为×2=0.3mol,则O原子的物质的量为=0.05mol,则n(C):n(H):n(O)=0.1:0.3:0.05=2:6:1。
(1)根据分析,n(C):n(H):n(O)=2:6:1,最简式为C2H6O。
(2)若该有机物的相对分子质量为46,符合最简式C2H6O,能与金属钠反应放出氢气,则该物质含有羟基,则该有机物的结构简式CH3CH2OH。
7. 0. 6 mol·L-1 0. 2 mol·L-1·min-1
【分析】先计算出氧气的浓度的变化量,根据变化量之比等于化学计量数之比计算出SO2 和SO3的浓度的变化量,再用三段法进行计算。
【详解】根据c=,开始时容器内有14molO2,O2的物质的量浓度为1. 4 mol·L-1,2min时容器中剩余2molSO2和12molO2,,2min时容器中剩余SO2和O2物质的量浓度分别为:0. 2 mol·L-1,1. 2 mol·L-1,设SO2的起始物质的量浓度为x,根据变化量之比等于化学计量数之比,写出该反应的三段式如下:
SO2的起始物质的量浓度x=0. 2 mol·L-1+0. 4 mol·L-1=0. 6 mol·L-1;2min内SO3的反应速率v==0. 2 mol·L-1·min-1,答案为:0. 6 mol·L-1;0. 2 mol·L-1·min-1。
【点睛】计算化学反应速率时要注意计算公式为,不能用物质的量的变化量代替物质的量浓度的变化量。
8. 、、
【分析】该烃在氧气中完全燃烧,产物是水和二氧化碳,已知水的质量,即可求出水物质的量,又由氢原子守恒,可求出烃中氢原子物质的量;同理已知二氧化碳的体积,即可求出二氧化碳物质的量,又由碳原子守恒,可求出该烃中碳原子物质的量。
【详解】(1)由题意得:
设该烃的分子式为,则
即该烃的分子式为:
(2)分子式为C5H12 符合烷烃的通式,故可能是正戊烷、异戊烷、新戊烷。结构简式为:CH3CH2CH2CH2CH3 、CH3CH2CH(CH3)CH3、C(CH3)4
9. (1)0.125mol· (L·min)-1
(2)25%
(3)28.6%
【解析】(1)2min时,容器中NO的物质的量为0.5mol,则用NO表示的平均反应速率为:,由反应速率之比等于化学计量数之比可得,用CO2表示的平均反应速率为:;故答案为:。
(2)2min时,NO的物质的量为0.5mol,由方程式可得,CO转化量为0.5mol,则CO的转化率为:;故答案为:25%。
(3)平衡时,CO为1mol,初始容器中充入了1.5molNO2和2molCO,则CO转化了1mol,由方程式可得达到平衡时,NO2为0.5mol,CO2为1.0mol,NO为1.0mol,CO为1mol,则CO2的体积分数为:;故答案为:28.6%。
10. 分液漏斗 MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O 饱和食盐水 防止三氯化铝气体冷凝为固体而堵塞导管 吸收氯气防止污染空气,防止空气中的水蒸气进入 E 装置导致三氯化铝与水反应 溶液变红色 Cl2+2I- = I2+2Cl-
【分析】根据装置A是气体发生装置制取氯气,可写出仪器a的名称和发生的化学方程式;根据浓盐酸中HCl会挥发,产生的Cl2中会含HCl气体而要除去HCl,可判断B中装的试剂b;因为AlCl3遇到空气中的水蒸气时能剧烈反应生成Al(OH)3和HCl,装置C应装浓H2SO4干燥Cl2;根据制取的AlCl3易凝固,避免堵塞,选用粗导管;根据Cl2有毒和产物易与水反应判断F装置的作用;根据Cl2的强氧化性会氧化亚铁离子和置换出单质I2来判断;据此解答。
【详解】(1)A装置由浓盐酸与二氧化锰制备氯气,仪器a为分液漏斗,浓盐酸与二氧化锰发生氧化还原反应,生成MnCl2、Cl2、H2O,化学方程式为MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O;答案为分液漏斗,MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O。
(2)生成的氯气中含有氯化氢,B用饱和食盐水除去氯气中的氯化氢;答案为饱和食盐水。
(3)由于氯化铝的熔沸点较低,因此所用d导管较粗的原因是防止三氯化铝气体冷凝为固体而堵塞导管;答案为防止三氯化铝气体冷凝为固体而堵塞导管。
(4)氯气有毒,需要尾气处理,另外空气中含有水蒸气,因此F装置的作用为吸收氯气防止污染空气,防止空气中的水蒸气进入E装置导致三氯化铝与水反应;答案为吸收氯气防止污染空气,防止空气中的水蒸气进入E装置导致三氯化铝与水反应。
(5)氯气具有强氧化性,能够将亚铁离子氧化成铁离子,因此D中溶液会变红;氯气能够将碘离子氧化成碘单质,发生反应为:Cl2+2I-=I2+2Cl-,淀粉遇到碘单质变蓝;答案为溶液变红色;Cl2+2I-=I2+2Cl-。
11. (1) 坩埚 过滤
(2)富集碘元素
(3)5I- + +6H+ =3I2 +3H2O
(4) ①④⑥ 向盛有NaI溶液的试管中滴入少量新制溴水,再加入CCl4振荡后静置,溶液分层,下层液体为紫红色
【分析】干海带在坩埚中灼烧后,加水溶解并转移到烧杯中,煮沸过滤后得到含I-的溶液,调节pH=4.5,加入氧气氧化得到I2,再加入CCl4萃取分液后得到I2的CCl4溶液,再加入浓氢氧化钠溶液,充分反应后分液,向水层中加入45%硫酸溶液,得到I2的悬浊液,过滤后得到I2,据此解答。
(1)仪器A的名称为坩埚;由分析可知,操作A为过滤;故答案为:坩埚;过滤。
(2)步骤X中到步骤Y一系列操作的目的是富集碘元素;故答案为:富集碘元素。
(3)步骤Y中发生的反应为I-和IO在酸性条件下,反应生成I2,离子方程式为:5I- + +6H+ =3I2 +3H2O;故答案为:5I- + +6H+ =3I2 +3H2O。
(4)证明氧化性Br2>I2,可利用溴水与NaI溶液反应,生成碘单质,选用试剂为:新制溴水、NaI溶液、CCl4;实验操作与现象为:向盛有NaI溶液的试管中滴入少量新制溴水,再加入CCl4振荡后静置,溶液分层,下层液体为紫红色;故答案为:①④⑥;向盛有NaI溶液的试管中滴入少量新制溴水,再加入CCl4振荡后静置,溶液分层,下层液体为紫红色。
12. K F Al Al(OH)3+KOH==K[Al(OH)4] 在试管中加 5 mL KBr 稀溶液,再滴加少量新制氯水 ,振荡,再加入 5 mL CCl4,振荡、静置,观察到CCl4层呈现橙红色
【分析】根据元素周期表中各元素位置可知,①~⑩依次为N、F、Mg、Al、Si、S、Cl、Ar、K、Br,根据元素性质和元素周期律相关规律解答。
【详解】(1)元素周期表中从左到右元素的金属性逐渐减弱,非金属性逐渐增强,从上到下元素的金属性逐渐增强,非金属性减弱,因此金属性最强的元素在元素周期表的左下角,非金属性最强的元素在元素周期表的右上角,题中①~⑩所给的10种元素中最活泼的金属是⑨号K元素,非金属性最强的元素是②号F元素,答案为:K;F;
(2) 表中10种元素中④号Al元素位于元素周期表中金属与非金属分界线附近,形成的Al2O3、Al(OH)3具有两性,能与⑨号元素K的最高价氧化物对应的水化物KOH发生化学反应,反应的化学方程式为:Al(OH)3+KOH==K[Al(OH)4],答案为:Al;Al(OH)3+KOH==K[Al(OH)4];
(3)同主族元素从上到下非金属性逐渐减弱,元素形成的单质的氧化性逐渐减弱,⑦、⑩对应的单质为Cl2、Br2,非金属性:Cl>Br,单质的氧化性:Cl2>Br2,Cl2氧化性比Br2强,所以Cl2可以将Br-氧化为Br2,再根据Br2在水和有机溶剂中的溶解性不同,可用CCl4等有机溶剂萃取水溶液中的Br2,根据Br2溶解在CCl4中的特殊颜色进行观察,所以Cl2和Br2的氧化性强弱比较实验可设计如下:在试管中加 5 mL KBr 稀溶液,再滴加少量新制氯水 ,振荡,再加入 5 mL CCl4,振荡、静置,观察到CCl4层呈现橙红色,答案为:在试管中加 5 mL KBr 稀溶液,再滴加少量新制氯水 ,振荡,再加入 5 mL CCl4,振荡、静置,观察到CCl4层呈现橙红色。
【点睛】根据元素在元素周期表中的位置将元素推断出来以后,在解答有关问题时要注意题目要求,是写化学用语还是名称,写化学方程式还是离子方程式等。
13. Na NaOH 先取样于试管中,再滴加适量的NaOH溶液,在酒精灯上微热,把湿润的红色石蕊试纸放在试管口,如有气泡产生且红色石蕊试纸变蓝,则证明是
【详解】a~k的元素分别为:H、N、O、Na、Mg、Al、P、S、Cl、Ar、K、Se;
(1)短周期元素即1-3周期,原子半径从上到下逐渐增大,从左到右逐渐减小,最大的是Na;
(2)元素b、d、f分别为Na、Mg、Al为同周期元素,从左到右金属性减弱,对应的最高价氧化物对应水化物的碱性也减弱,较强的为NaOH;
(3)元素j、l分别为S、Cl,同周期从左到右非金属性逐渐增强,其氢化物的稳定性也逐渐增强,从强到弱的顺序为;
(4)由a、g、i三种元素组成的离子化合物是,检验该化合物中阳离子铵根离子的方法是:先取样于试管中,再滴加适量的NaOH溶液,在酒精灯上微热,把湿润的红色石蕊试纸放在试管口,如有气泡产生且红色石蕊试纸变蓝,则证明是。
14. 氧化反应 CH2==CH2 羧基(或—COOH) CH3COOH+CH3CH2OHCH3COOC2H5+H2O 用作燃料(合理即可)
【分析】根据D分子的模型,推出D的结构简式为CH3COOH,A是一种可以使溴水及酸性KMnO4溶液褪色的气体,A可作为水果的催熟剂,即A为乙烯,结构简式为CH2=CH2,CH2=CH2与H2O在一定条件下发生加成反应,即B为CH3CH2OH,乙醇与O2在Cu作催化剂下发生氧化反应,即C为乙醛,结构简式为CH3CHO,乙醇与乙酸发生酯化反应;
【详解】根据D分子的模型,推出D的结构简式为CH3COOH,A是一种可以使溴水及酸性KMnO4溶液褪色的气体,A可作为水果的催熟剂,即A为乙烯,结构简式为CH2=CH2,CH2=CH2与H2O在一定条件下发生加成反应,即B为CH3CH2OH,乙醇与O2在Cu作催化剂下发生氧化反应,即C为乙醛,结构简式为CH3CHO,乙醇与乙酸发生酯化反应,即E为乙酸乙酯,结构简式为CH3COOCH2CH3,
(1)根据上述分析,B生成C的反应类型为氧化反应;
(2)A的结构简式为CH2=CH2;D的结构简式为CH3COOH,官能团是羧基或-COOH;
(3)乙酸与乙醇发生酯化反应,其反应方程式为CH3COOH+CH3CH2OHCH3COOC2H5+H2O;
(4)B为乙醇,乙醇可以作燃料、饮料、消毒剂等。
15. 羟基 b 取代反应(酯化反应) abc 防止倒吸
【分析】I. A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,A能和Na、乙酸、红热的铜丝反应,B和水在催化剂条件下反应生成A,则B为CH2=CH2,A为CH3CH2OH,在浓硫酸作催化剂条件下,乙醇和乙酸发生酯化反应生成C为CH3COOCH2CH3,A在红热的Cu丝作催化剂条件下发生催化氧化反应生成D为CH3CHO,A和Na反应生成E为CH3CH2ONa,以此解答该题。
【详解】(1)A为乙醇,含有的官能团为羟基,
(2)反应④为乙醇发生催化氧化生成乙醛,化学方程式为;
(3)化合物B为乙烯CH2=CH2;
a.乙烯可以与氧气在点燃条件下发生氧化反应,a错误;
b.乙烯和溴单质发生加成反应,可以使溴的四氯化碳溶液褪色,b正确;
c.乙烯可被酸性高锰酸钾溶液氧化,可以使溶液褪色,c错误;
故选:b;
(4)用乙酸和乙醇反应制取乙酸乙酯的化学反应方程式:,反应类型是取代反应(酯化反应);
(5)饱和碳酸钠溶液的主要作用是:溶解乙醇、中和乙酸、降低乙酸乙酯溶解度,故选:abc;
(6)通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止倒吸。
16. (1)
(2) 羧基 取代反应或酯化反应
(3)CH3COOCH2CH3 + NaOH CH3COONa + CH3CH2OH
(4)饱和碳酸钠溶液
【分析】A的产量被用作衡量一个国家石油化工产业发展水平的标志,则A为CH2=CH2,A与水加成反应得到B,则B为CH3CH2OH,B氧化可得到C,则C为CH3CHO,C继续氧化得到D,则D为CH3COOH,B与D发生酯化反应得到G,则G为CH3COOCH2CH3,G在碱性条件下水解得到B和E,则E为CH3COONa,F是高分子化合物,则F为聚乙烯,据此解答。
(1)由分析可知,A为乙烯,结构式为: ;故答案为: 。
(2)由分析可知,D为CH3COOH,官能团名称为:羧基;④为乙酸与乙醇的反应,反应类型为:取代反应或酯化反应;故答案为:羧基;取代反应或酯化反应。
(3)⑤为乙酸乙酯在碱性条件下的水解,反应的化学方程式为:CH3COOCH2CH3 + NaOH CH3COONa + CH3CH2OH;故答案为:CH3COOCH2CH3 + NaOH CH3COONa + CH3CH2OH。
(4)在实验室中,用如图所示装置制取少量乙酸乙酯时,试管a中盛放的试剂为:饱和碳酸钠溶液,目的是除去乙酸和乙醇杂质,同时降低乙酸乙酯的溶解度;故答案为:饱和碳酸钠溶液。
17. 第三周期ⅡA族 成本低 静置取上层清液,加入NaOH溶液,若不生成浑浊则已沉淀完全 “空气吹出”“吸收”“氧化”的过程实际上是的浓缩过程,与直接蒸馏含的海水相比产率更高,消耗能源少,成本降低 取少量KI溶液于试管中,向其中加入溴水,向反应后的溶液中加入少量淀粉溶液,若观察到变蓝,则可说明溴的非金属性比碘强
【分析】反应②通入氯气,氧化溴离子生成单质溴,通入热空气吹出溴,在水中被二氧化硫吸收得到含溴化氢的水溶液,再通入氯气氧化溴离子生成溴单质;反应①加入熟石灰沉淀镁离子生成氢氧化镁沉淀,过滤后的沉淀溶解在稀盐酸得到氯化镁溶液,蒸发浓缩、冷却结晶得到氯化镁晶体,在氯化氢气流中加热失去结晶水,得到固体氯化镁,电极熔融氯化镁生成镁和氯气;
【详解】(1)镁元素是24号元素,在元素周期表中位置第三周期ⅡA族;
(2)通入氯气,将溴离子氧化生成溴单质和氯离子,该反应的离子方程式是;
(3)反应③利用了的还原性,S元素化合价升高生成,Br元素化合价降低,从Br2降至Br-,反应的离子方程式为;
(4)工业上常用熟石灰而不用烧碱沉淀,优点是熟石灰原料便宜且易得,成本低;实验室中检验已经沉淀完全的方法:静置取上层清液,加入NaOH溶液,若不生成浑浊则已沉淀完全;
(5) 这样设计工艺的意义是:“空气吹出”“吸收”“氧化”的过程实际上是的浓缩过程,与直接蒸馏含的海水相比产率更高,消耗能源少,成本降低;
(6) 证明溴的非金属性比碘强的实验方案为:取少量KI溶液于试管中,向其中加入溴水,向反应后的溶液中加入少量淀粉溶液,若观察到变蓝,则可说明溴的非金属性比碘强。
18. (1)
(2)VIA
(3)
(4)NaOH
(5)离子键和共价键
【分析】根据元素周期表①为氢元素,②为碳元素,③为氧元素,④为氟元素,⑤为钠元素,⑥为铝元素,⑦为硫元素,⑧为氯元素。
(1)⑧为氯元素,原子结构示意图为;
(2)③为氧元素,在周期表中的位置是第二周期第VIA族;
(3)②为碳元素,最高价氧化物为CO2,电子式为:;
(4)⑤为钠元素,⑥为铝元素,最高价氧化物对应水化物分别为NaOH(强碱)和Al(OH)3(有两性),碱性较强的是NaOH;
(5)③为氧元素,⑤为钠元素,钠单质在氧气中燃烧,产物为过氧化钠,产物中所含化学键的类型为离子键和共价键。
云南昆明市2020-2022三年高一化学下学期期末试题汇编3-非选择题: 这是一份云南昆明市2020-2022三年高一化学下学期期末试题汇编3-非选择题,共21页。试卷主要包含了90,00ml/L-0等内容,欢迎下载使用。
山东省枣庄市2020-2022三年高一化学下学期期末试题汇编3-非选择题: 这是一份山东省枣庄市2020-2022三年高一化学下学期期末试题汇编3-非选择题,共23页。
山东省聊城市2020-2022三年高一化学下学期期末试题汇编3-非选择题: 这是一份山东省聊城市2020-2022三年高一化学下学期期末试题汇编3-非选择题,共23页。试卷主要包含了8g,则x的值为_______,25,25ml·L-1 1等内容,欢迎下载使用。












