




辽宁省大连市名校联盟2022-2023学年高三上学期1月高考适应性测试(一)化学试题(Word版含答案)
展开绝密★使用前
大连市名校联盟2022-2023学年高三上学期1月高考适应性测试(一)
化 学
考生注意:
1.本试卷共100分,考试时间75分钟。共三大题,20小题,共8页
2.请将各题答案填写在答题卡上。
3.本试卷主要考试内容:高考全部内容
一、选择题(本题共12小题,每小题3分,共36分.在每小题给出的四个选项中,只有一项是符合题目要求的)
1.设NA为阿伏加德罗常数的值。下列说法正确的是
A.7.8 g的Na2S和Na2O2的混合物中含有阴、阳离子总数为0.3 NA
B.常温常压下,22.4 LCO2中含有NA个CO2分子
C.1.0 L 1.0 mol·L-1的NaClO水溶液中含有的氧原子数为NA
D.常温常压下,18 g羟基(-O2H)中所含的中子数为8 NA
2.在体积相同的两个密闭容器中分别充满C2H4、C3H6气体,当这两个容器内温度和气体密度相等时,下列说法正确的是
A.两种气体的压强是P(C2H4)<P(C3H6) B.C2H4 比C3H6的质量小
C.两种气体的分子数目相等 D.两种气体的氢原子数目相等
3.能正确表示下列变化的离子方程式是
A.硅酸钠中滴加盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+
B.少量SO2通入NaClO溶液中:SO2+3ClO-+H2O=SO42-+Cl-+2HClO
C.高锰酸钾溶液中滴入双氧水:2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O
D.小苏打治疗胃酸过多:CO32-+2H+=CO2↑+H2O
4.下列各反应的产物与反应物用量无关的是
A.Na2CO3和稀盐酸B.Al2O3和NaOH溶液C.NH4HCO3和NaOH溶液D.CO2和NaOH溶液
5.用0.100 mol·L‑1 HCl标准溶液滴定25.00mL 0.0500 mol·L‑1 的四甲基乙二胺[(CH3)2NCH2CH2N(CH3)2,用“X”表示],其滴定曲线如图所示。已知乙二胺的一级电离方程式为: H2NCH2CH2NH2 + H2O[H2NCH2CH2NH3]+ +OH-,下列说法正确的是
A.在B点时,用酚酞作指示剂,当溶液恰好由红色变无色,达到了滴定终点
B.在C点时,可以求得X的二级电离Kb2= 10-5.9
C.在A点时,c(Cl-)>c(X)>c(HX)+
D.在D点时,2c(X)+c(HX)+ =c(H+)-c(OH- )
6.亚硝酰氯(ClNO)是有机物合成中的重要试剂,遇水反应生成一种氢化物和两种氧化物。某学习小组用Cl2和NO利用如图所示装置制备亚硝酰氯(ClNO),下列说法正确的是
A.X装置可以随开随用,随关随停
B.Y装置中的药品可以换成浓硫酸
C.装入药品打开K2后,应先打开K1再打开K3
D.若无装置Y,则Z中可能发生反应的化学方程式为2ClNO+H2O=2HCl+NO↑+N2O3↑
7.已知还原性。向和的混合溶液中通入适量氯气,原溶液中各离子的物质的量变化知下图所示(和点横坐标为和)。下列说法正确的是
A.段表示物质的量的变化情况
B.原溶液中和的物质的量均为
C.段发生的离子反应为
D.反应不能发生
8.在298K和100kPa压力下,已知金刚石和石墨的熵、燃烧热和密度分别为:
物质 | S/(J·K−1·mol−1) | ∆H/(kJ·mol−1) | ρ/(kg·m−3) |
C(金刚石) | 2.4 | −395.40 | 3513 |
C(石墨) | 5.7 | −393.51 | 2260 |
此条件下,对于反应C(石墨)→C(金刚石),下列说法正确的是A.该反应的∆H<0,∆S<0
B.由公式∆G=∆H−T∆S可知,该反应∆G=985.29kJ·mol−1
C.金刚石比石墨稳定
D.超高压条件下,石墨有可能变为金刚石
9.若阿伏加德罗常数的数值用NA表示,下列说法正确的是( )
A.1.6gNH2-离子所含质子数为NA
B.常温常压下,200g8.5%的H2O2溶液中含氧原子数为NA
C.7.8gNa2O2晶体中所含离子总数为0.4NA
D.在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为5NA
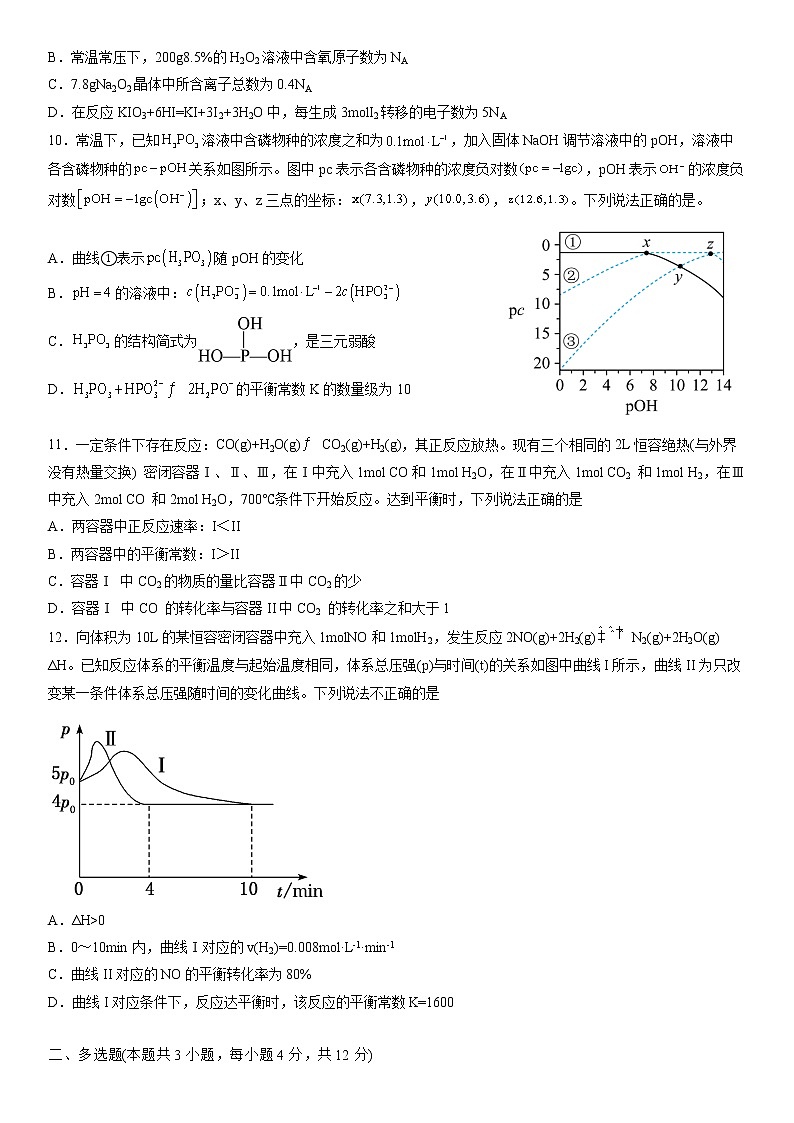
10.常温下,已知溶液中含磷物种的浓度之和为,加入固体NaOH调节溶液中的pOH,溶液中各含磷物种的关系如图所示。图中pc表示各含磷物种的浓度负对数,pOH表示的浓度负对数;x、y、z三点的坐标:,,。下列说法正确的是。
A.曲线①表示随pOH的变化
B.的溶液中:
C.的结构简式为,是三元弱酸
D.的平衡常数K的数量级为10
11.一定条件下存在反应:CO(g)+H2O(g)CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1mol CO和1mol H2O,在Ⅱ中充入1mol CO2 和1mol H2,在Ⅲ中充入2mol CO 和2mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是
A.两容器中正反应速率:I<II
B.两容器中的平衡常数:I>II
C.容器Ⅰ 中CO2的物质的量比容器Ⅱ中CO2的少
D.容器Ⅰ 中CO 的转化率与容器II中CO2 的转化率之和大于1
12.向体积为10L的某恒容密闭容器中充入1molNO和1molH2,发生反应2NO(g)+2H2(g)N2(g)+2H2O(g) ΔH。已知反应体系的平衡温度与起始温度相同,体系总压强(p)与时间(t)的关系如图中曲线I所示,曲线II为只改变某一条件体系总压强随时间的变化曲线。下列说法不正确的是
A.ΔH>0
B.0~10min内,曲线Ⅰ对应的v(H2)=0.008mol·L-1·min-1
C.曲线II对应的NO的平衡转化率为80%
D.曲线I对应条件下,反应达平衡时,该反应的平衡常数K=1600
二、多选题(本题共3小题,每小题4分,共12分)
13.在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是
A.反应2NO(g)+O2(g) 2NO2(g)的ΔH>0
B.图中X点所示条件下,延长反应时间能提高NO转化率
C.图中Y点所示条件下,增加O2的浓度不能提高NO转化率
D.380℃下,c起始(O2)=5.0×10−4 mol·L−1,NO平衡转化率为50%,则平衡常数K>2000
14.25℃时,用HCl气体调节0.1mol·L-1碱BOH的pH,体系中粒子浓度的对数值(1gc)、反应物的物质的量之比的关系如图所示。若忽略通入气体后溶液体积的变化,下列说法正确的是
A.25℃时,BOH的电离平衡常数为10-9.25
B.t=0.5,2c(H+)+c(BOH)=2c(OH-)+c(B+)
C.P1所示溶液:c(C1-)<0.05mol·L-1
D.P2所示溶液:c(B+) >100c(BOH)
15.是一种钠离子电池正极材料,充放电过程中正极材料立方晶胞(示意图)的组成变化如图所示,晶胞内未标出因放电产生的0价Cu原子。下列说法正确的是
A.每个晶胞中个数为x
B.每个晶胞完全转化为晶胞,转移电子数为8
C.每个晶胞中0价Cu原子个数为
D.当转化为时,每转移电子,产生原子
三、填空题(共52分)
16.某实验小组欲探究SO2和Cl2能否发生反应,设计如下图所示的实验装置进行实验。
(1)装置A制取氯气,该反应的化学方程式:___________。
(2)装置C中发生复分解反应制取SO2,该反应的化学方程式:___________。
(3)为验证SO2和Cl2发生了反应,小组同学又继续如下实验。
①甲同学认为若SO2和Cl2反应,生成了Cl-,只要检验到生成的Cl-即可,甲取适量B中样品于试管中,向其中滴加少量___________溶液,有白色沉淀生成。
②乙同学认为甲同学的结论不合理,认为应该在装置A、B间增加一个洗气瓶,然后再按甲同学的方法实验即可得到正确结论。洗气瓶中盛有试剂的名称是___________。
③丙同学认为按乙同学的建议改进实验也不合理,理由是:___________。
④丙同学取溶液X于试管中,加入少量反应后B中的溶液,生成大量白色沉淀,得出正确结论:SO2与Cl2同时通入水中,可以发生反应。溶液X是_________(填选项序号)。
a. BaCl2溶液 b. Ba(OH)2溶液 c. 氯水 d. 石蕊溶液
SO2与Cl2同时通入水中反应的化学方程式是______________________。
17.回答下列问题:
(1)已知酰胺键()的性质与酯基相似。化合物Y有解热镇痛的作用,可由X与乙酸酐合成,下列关于X和Y的说法正确的是___________(填字母序号)。
A.可以用溶液鉴别X与Y B.X、Y均不能使酸性溶液褪色
C.X可与溴水发生取代反应 D.1mol Y最多能与2mol NaOH反应
(2)下列根据实验操作,实验现象得出的结论正确的是___________(填字母序号)。
选项 | 实验操作 | 实验现象 | 结论 |
A | 向油脂中加入NaOH溶液,加热 | 液体不再分层 | 油脂水解完全 |
B | 向蔗糖溶液中加入稀硫酸,水浴加热几分钟,加入少量新制的悬浊液,加热 | 无砖红色沉淀产生 | 蔗糖没有水解 |
C | 将乙醇与浓硫酸混合溶液加热,产生的气体直接通入酸性溶液 | 紫红色褪去 | 乙醇发生了消去反应 |
D | 向葡萄糖溶液中加入少量酸性溶液,充分振荡 | 紫红色褪去 | 葡萄糖具有还原性 |
A.A B.B C.C D.D
(3)由草本植物香料X合成一种新型香料H()的路线如图。
请回答下列问题:
①A中官能团的名称为___________,X的结构简式为___________。
②写出下列反应的化学方程式
B→G:___________;
D→E:___________;
F→H:___________;
G→B:___________。
③符合下列条件的A的同分异构体有___________种。
a.遇溶液发生显色反应
b.能发生加聚反应
c.能发生银镜反应
18.Ⅰ.甲、乙、丙是三种不含相同离子的可溶性强碱或盐,其相对分子质量:甲<乙<丙,它们所含离子如下表所示:
阳离子 | NH、Mg2+、Ba2+ |
阴离子 | OH-、NO、Cl- |
(1)丙是_________。
(2)甲有两种可能,为了确定是哪种可能,请设计实验确定甲的物质组成,操作为:_________。
Ⅱ.某化学兴趣小组在探究“复分解反应发生的条件”时,选做了如图所示的三个实验(提示: BaCl2溶液呈中性。)
甲同学:向试管I中慢慢滴入MgCl2溶液,并不断振荡,至溶液颜色恰好变为无色为止。
乙同学:分别完成试管Ⅱ和Ⅲ中的两个实验后,接着进行如下探究。请分析后作答:
(3)甲同学经过分析推断,试管Ⅲ反应后所得溶液中一定含有的溶质是_________ (填化学式);步骤①中一定发生的反应的化学方程式是_________。
(4)乙同学把沉淀M、N混合后加入AgNO3溶液和过量的稀硝酸,观察到的实验现象是_________;实验结束,乙同学把反应后的混合物与滤液C全部倒入废液缸中,则废液缸内上层清液中,除酚酞和H+、NO外一定含有的离子有_________(填离子符号)。
19.海洋中有丰富的食品、矿产、能源、药物和水产等资源,下图为海水综合利用的部分流程。
回答下列问题:
(1)为了除去粗盐中的及泥沙,可将粗盐溶于水,然后进行下列五项操作: a.过滤;b.加过量溶液;c.加适量盐酸;d.加过量溶液;e.加过量溶液。正确的操作顺序是_______→_______→_______→a→c___。(填字母)
(2)步骤③加入的试剂A是_______,然后进行的操作I是_______。
(3)步骤①~⑦中,涉及氧化还原反应的步骤有_______。
(4)步骤⑥的化学方程式为_______。
(5)步骤⑦的离子方程式为_______。
(6)将海水浓缩至,使用上述流程中的生产方法最终得到,若的提取率为55%,则海水中溴的浓度为_______。(计算结果保留两位有效数字)
20.氟是人体必需元素之一,氟化物有阻止龋齿发生的作用,含氟牙膏使人们的牙齿更健康。
(1)基态F原子的电子排布图为___________。
(2)和的晶格能由大到小的顺序是___________;元素中第一电离能最小的是___________。
(3)分子中氧原子的杂化轨道类型为___________。分子的立体构型为___________。和的沸点依次升高的原因是___________。
(4)羟基磷灰石是骨骼和牙齿的主要成分,其晶体属于六方晶系,晶胞中含有10个,6个,2个。其中可被取代形成氟取代的羟基磷灰石。某氟取代的羟基磷灰石晶胞中和的分布情况如图所示。
①化合物中存在的化学键的类型有___________。
②化合物的密度___________(列出化简的计算式,阿伏加德罗常数的值为)
③羟基磷灰石可形成缺失的化合物,若剩余有缺失,和不发生变化,则此化合物中和P的物质的量之比为___________。
辽宁省部分名校2023-2024学年高三上学期12月适应性测试一化学试题含答案: 这是一份辽宁省部分名校2023-2024学年高三上学期12月适应性测试一化学试题含答案,共41页。试卷主要包含了单选题,原理综合题,结构与性质等内容,欢迎下载使用。
辽宁省实验中学2023-2024学年高三上学期高考适应性测试(一)化学试题 Word版含答案: 这是一份辽宁省实验中学2023-2024学年高三上学期高考适应性测试(一)化学试题 Word版含答案,共16页。
辽宁省名校联盟2022-2023年高三下学期3月高考适应性测试化学试题含答案: 这是一份辽宁省名校联盟2022-2023年高三下学期3月高考适应性测试化学试题含答案,共19页。试卷主要包含了类比法是一种重要的化学思维方法,下列实验操作及现象表述错误的是等内容,欢迎下载使用。












