

2022-2023学年湖北省武汉市华中师范大学第一附属中学高三上学期期中考试 化学试卷 Word版含答案
展开满分:100分 考试时间:75分钟
命题人:梅席 陈倩倩 周冰洁 审题人: 刘南
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Cl 35.5
选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与生活紧密相关,下列说法错误的是
A.脲醛树脂可用于生产电器开关
B.味精以淀粉为主要原料通过发酵法生产
C.直径为1~100 nm的纳米材料可产生丁达尔现象
D.防晒衣的主要成分为聚酯纤维,忌长期用肥皂洗涤
2.“夏禹铸九鼎,天下分九州”。青铜器在古时被称为“吉金”,是红铜与锡、铅等的合金。其表面铜锈大多呈青绿色,主要含有Cu2(OH)3Cl和Cu2(OH)2CO3。下列说法错误的是
A.青铜器中锡、铅对铜有保护作用
B.Cu2(OH)3Cl和Cu2(OH)2CO3都属于盐类
C.可用NH4Cl溶液浸泡青铜器来清洗铜锈
D.博物馆中贵重青铜器常放在银质托盘上进行展示
3.药物非洛地平是一种长效的钙离子通道阻断剂,广泛应用于
医药领域,其结构简式如右图所示。下列说法正确的是
A.非洛地平的分子式为C18H20Cl2NO4
B.非洛地平可以与盐酸反应
C.1 ml非洛地平最多消耗7 ml H2
D.非洛地平分子中所有碳原子可能共平面
4.下列离子反应方程式书写正确的是
A.等体积等物质的量浓度的Na[Al(OH)4]溶液与稀硫酸混合:[Al(OH)4]- + 4H+ === Al3++4H2O
B.次氯酸钠溶液吸收少量SO2:SO2 + H2O +=== SO2- 4 ++ 2HClO
C.硫氰化铁溶液中滴加NaOH溶液产生沉淀:Fe3+ +=== Fe(OH)3↓
D.向H2O2溶液中滴加少量氯化铁溶液:2Fe3+ + H2O2 === O2↑ + 2H+ + 2Fe2+
5.下列关于阿伏伽德罗常数NA的说法中正确的是
A.1 ml HClO中含有H-Cl键个数为NA
B.1 ml SO3溶于水,所得溶液中H2SO4分子数为NA
C.78 g Na2O2和足量水完全反应,转移电子数为2NA
D.13 g乙炔和苯乙烯的混合气中,碳原子个数为NA
6.下列实验装置及现象正确的是
7.下列实验设计方案、现象和结论均正确的是
8.下列关于物质的结构与性质的叙述正确的是
A.Li、Na同主族, Na保存在煤油中,可推断Li也保存在煤油中
B.Be、Mg同主族,MgO不溶于强碱,可推断BeO也不溶于强碱
C.Ge、Pb同主族,Ge可作半导体材料,可推断Pb也可作半导体材料
D.O、S同主族,H2O2有氧化性,可推断H2S2也有氧化性
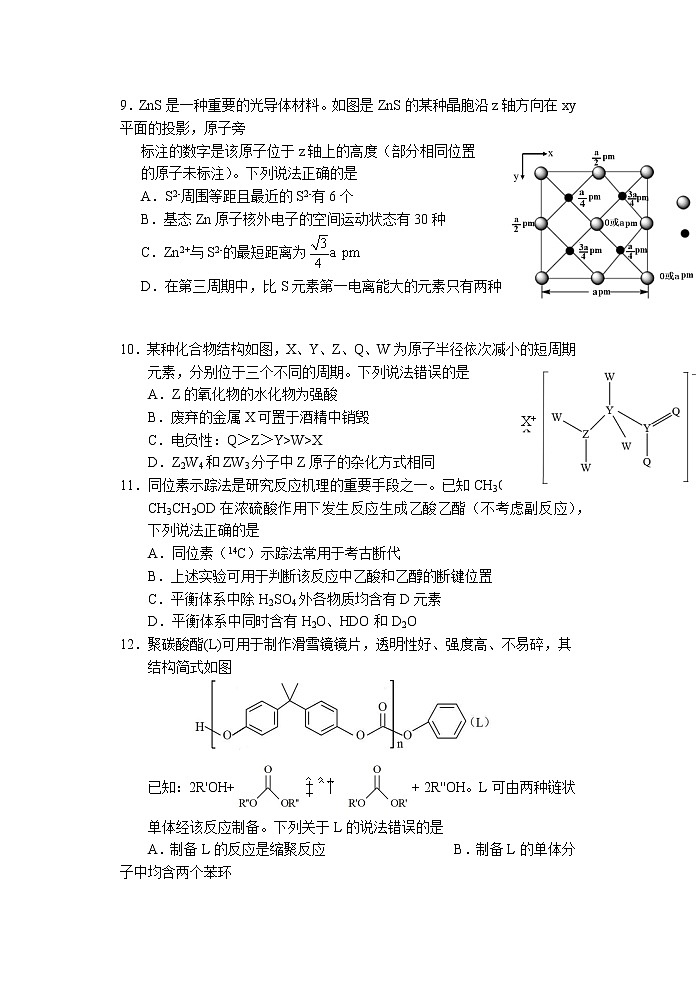
9.ZnS是一种重要的光导体材料。如图是ZnS的某种晶胞沿z轴方向在xy平面的投影,原子旁
标注的数字是该原子位于z轴上的高度(部分相同位置
的原子未标注)。下列说法正确的是
A.S2-周围等距且最近的S2-有6个
B.基态Zn原子核外电子的空间运动状态有30种
C.Zn2+与S2-的最短距离为
D.在第三周期中,比S元素第一电离能大的元素只有两种
10.某种化合物结构如图,X、Y、Z、Q、W为原子半径依次减小的短周期元素,分别位于三个不同的周期。下列说法错误的是
A.Z的氧化物的水化物为强酸
X+
B.废弃的金属X可置于酒精中销毁
C.电负性:Q>Z>Y>W>X
D.Z2W4和ZW3分子中Z原子的杂化方式相同
11.同位素示踪法是研究反应机理的重要手段之一。已知CH3COOH和CH3CH2OD在浓硫酸作用下发生反应生成乙酸乙酯(不考虑副反应),下列说法正确的是
A.同位素(14C)示踪法常用于考古断代
B.上述实验可用于判断该反应中乙酸和乙醇的断键位置
C.平衡体系中除H2SO4外各物质均含有D元素
D.平衡体系中同时含有H2O、HDO和D2O
12.聚碳酸酯(L)可用于制作滑雪镜镜片,透明性好、强度高、不易碎,其结构简式如图
已知:2R'OH++ 2R''OH。L可由两种链状单体经该反应制备。下列关于L的说法错误的是
A.制备L的反应是缩聚反应 B.制备L的单体分子中均含两个苯环
C.1 ml L中sp3杂化的碳原子数目为3NA D.分离出苯酚可促进L的合成
13.过氧硫酸氢根(HSO- 5)参与烯烃的不对称环氧化反应机理如图所示,下列说法错误的是
A.该反应受体系pH的影响
B.是中间产物且具有较强氧化性
C.该过程中有非极性键的生成,没有非极性键的断裂
催化剂
D.总反应方程式为:OH- + HSO- 5+ +SO2- 4+H2O
14.“电解法”制备氢碘酸的装置如图所示。其中双极膜(BPM)是阴、阳复合膜,在直流电作用下复合层间的H2O解离成H+和(少量会因为浓度差通过BPM膜)。下列说法正确的是
A.a极的电势比b极的低
B.A、B膜均为阳离子交换膜
C.若撤去A膜,对该电解池的工作无影响
D.电解过程中,图中三处H2SO4溶液的c(H2SO4)均不变
15.常温下,某实验小组以酚酞为指示剂,用0.1000 ml/L NaOH溶液滴定20.00 mL 0.1000 ml/L H2A溶液。溶液pH、所有含A微粒的分布分数δ[如的分布分数:δ()=] 随滴加NaOH溶液体积V(NaOH)的变化关系如图所示,下列说法正确的是
A.曲线①代表δ(),曲线②代表δ(A2-)
B.NaHA是酸式盐,其水溶液显碱性
C.常温下,的水解常数Kh≈1.0×10-9
D.当滴定至中性时,溶液中存在:c()+c(H2A) >c(Na+)
非选择题:本题共4小题,共55分。
16.(14分)三氯氧磷(POCl3)可用作半导体掺杂剂。工业上采用直接氧化法由PCl3制备POCl3,反应原理为:P4(白磷)+6Cl2 4PCl3,2PCl3+O2 2POCl3。
已知:PCl3、POCl3的部分性质如下:
某实验小组模拟该工艺设计实验装置如图(部分加热和夹持装置已略去):
请回答下列问题:
(1)装置戊中发生反应的离子方程式为: 。
(2)装置乙的主要作用为:①干燥气体,② , ③ 。
(3)装置丙的温度需控制在60~65 C的原因是 。
(4)实验制得的POCl3中常含有PCl3杂质,该实验小组采用下列方法测定产品中的氯元素
含量,继而通过计算确定三氯氧磷的纯度:
I.取m g产品于锥形瓶中,加入足量NaOH溶液,待水解完全后滴加稀硝酸至酸性
II.向锥形瓶中加入V1 mL c1 ml/L AgNO3溶液至完全沉淀
Ⅲ.向其中加入少量硝基苯,用力摇动,使沉淀表面被有机物覆盖
Ⅳ.加入指示剂,用c2 ml/L KSCN溶液进行滴定,至终点时消耗KSCN溶液V2 mL
(已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12)
① 步骤IV中选用的指示剂为 。
② 在接近滴定终点时,使用“半滴操作”可提高测量的准确度。其方法是:将滴定管的旋塞稍稍转动,使半滴KSCN溶液悬于管口, ,继续摇动锥形瓶,观察颜色变化。
③ 产品中氯元素含量的表达式为: 。
④ 下列操作会使测得的氯元素含量偏小的是 。
a.配制AgNO3标准溶液时仰视容量瓶刻度线 b.实验过程中未加入硝基苯
c.滴定前滴定管尖嘴处有气泡,滴定后无气泡d.滴定时锥形瓶未干燥
(5)如需进一步提纯产品,可采用的提纯方法为 。
17.(14分)铋及其化合物在工业生产中用途广泛,如氯氧化铋(BiOCl)常用作电子设备、塑料助剂等。以下是一种用铋精矿(Bi2S3,含有FeS2、 Cu2S、PbO2及不溶性杂质)制备 BiOCl的一种方法,其流程如图:
已知:① Fe(OH)3开始沉淀的 pH值为2.7,沉淀完全时的 pH值为3.7。
② pH≥3时,BiCl3极易水解为BiOCl沉淀。
请回答以下问题:
(1)铋精矿在浸取时除采用粉碎矿石和增大压强来提高铋精矿浸取率外,还可以采取 措施(任写两条)。
(2)“加压浸取”过程中,Bi2S3转化为Bi2O3,FeS2转化为Fe2O3,而Cu2S溶解进入浸出液,且硫元素转化为,请写出Cu2S在此过程中发生反应的离子方程式:____________。
(3)“操作Ⅰ”为 、过滤、洗涤、干燥。
(4)根据流程分析,盐酸羟胺(NH3OHCl)在流程中的作用是:①________② 。
(5)流程中生成 BiOCl 的离子方程式:________________________________________。
(6)复杂氧化物可改写成氧化物或盐的形式,如可改写为或,请将分别改写成氧化物和盐的形式 。
18. (13分)帕罗韦德是一种新型口服抗新冠药物,其重要中间体K的合成路线如下。
已知:(均为烷基)
回答下列问题:
(1)已知A→B为加成反应,工业上常利用物质A在氧气中燃烧时放出的大量热来进行
__________。
(2)B与足量氢气反应后的产物名称为___________。
(3)已知C为不饱和醇,C→D的反应类型为___________。
(4)写出G→H第一步反应的化学方程式___________。
(5)已知芳香化合物M为K的同分异构体,则满足下列条件的同分异构体共有_______种。
①能与发生显色反应;
②1 ml M最多消耗2 ml NaOH;
③核磁共振氢谱中有五组峰;
写出其中一种峰面积之比为的有机物的结构简式:__________。
(6)结合以上流程,以乙炔和乙醇为原料合成2,5-己二醇( ),无机试剂任选,设计合成路线。
19.(14分)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与储存,过程如下:
(1)反应I由两步反应完成:a. H2SO4(l)SO3(g)+H2O(g) △H1 = +177 kJ/ml
b. 2SO3(g)2SO2(g) +O2(g) △H2 = +197 kJ/ml
① 请写出反应I的热化学反应方程式: 。
② 硫酸工业中可通过反应b的逆反应合成SO3,下表列出了不同温度、压强下SO2的平衡转化率:
在实际生产中,选定温度为400~500 ℃的原因是 ;选定压强为常压的原因是 。
(2)可以作为水溶液中SO2歧化反应(反应II)的催化剂,催化历程如下:
i.SO2+4I-+4H+=== S↓+2I2+2H2O ii.
某实验小组为探究i、ii反应速率与SO2歧化反应速率的关系,进行如下实验:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
① 请补全反应ii: 。
② 比较A、B、C,可得出的结论是:______________________。
③ D是A的对比实验,则a=__________。
④ 实验表明,SO2的歧化反应速率D>A,则反应速率:i ii(填“>”、“=”或“<”)。
华中师大一附中2022—2023学年度上学期期中检测
高三年级化学 参考答案
选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
非选择题:本题共4小题,共55分。
16.(14分)
(1)MnO2 + 4H+ +2Cl- Mn2+ + Cl2↑+ 2H2O (2分)
(2)② 观察O2流速进而调节PCl3与O2的反应速率(答出“观察O2流速”就给分)(1分)
③ 平衡气压(或写“检验装置是否发生堵塞”)(1分)
(3)温度过低反应速率慢,温度过高会造成PCl3挥发,利用率降低 (2分)
(4)① 硫酸铁溶液(或硫酸铁铵溶液 硝酸铁溶液 合理即可) (1分) (未写“溶液”不给分)
② 用锥形瓶内壁将半滴KSCN溶液沾落,再用洗瓶以少量蒸馏水吹洗锥形瓶内壁(2分)
③ (2分)
④bc (2分)(选“b”或“c”给1分,错选0分)
(5) 蒸馏(1分)
17.(14分)
(1)多次浸取、适当升高温度、搅拌、适当增大氨水的浓度(任写两种)(2分)
(2) 2 Cu2S + 16NH3 + 5O2 + 2H2O = 4[Cu(NH3)4]2+ + 2SO42- + 4OH-
或 2 Cu2S + 16 + 5O2 = 4[Cu(NH3)4]2+ + 2SO42- + 4OH- +14 H2O (2分)
(3)蒸发浓缩,冷却结晶 (或“加热浓缩,冷却结晶”)(2分)
(4) ① 将Fe3+还原为 Fe2+,提高产品纯度(2分)
② 将铅元素从+4价还原为+2价,便于后续“沉铅”(2分)
(5) (2分)
(6) (1分) 或(1分)
18.(13分)
(1) 焊接或切割金属(1分)(“焊接金属”、“切割金属”均给分)
(2) 甲基丁醇(2分)
(3) 消去反应(2分)
(4) (2分)
(5 ) 4 (2分)
或 (1分)(写一种即可)
(6) (3分)
19.(14分)
(1)① 2H2SO4(l)2SO2(g)+2H2O(g)+O2(g) △H = +551 kJ/ml(2分)
② 在此温度下催化剂的活性较高 (2分)
常压下,SO2的转化率已经很高,若采用高压,SO2转化率增大程度较小,但生产成本增大 (2分)
(2)① I2+2H2O+SO2===+2I-+4H+ (2分)
② H+单独存在时不具有催化作用,但H+可以加快歧化反应速率 (2分)
③ 0.0002 (或2×10-4) (2分) (若带了单位“ml”不扣分)
④ < (2分)A
B
C
D
冷水
氢气在氯气中燃烧
检验乙炔气体可使酸性高锰酸钾溶液褪色
浓氨水与浓硫酸反应
分离I2和KMnO4固体
方案设计
现象和结论
A
取2 mL卤代烃样品于试管中,加入5 mL 20% KOH溶液并加热,冷却到室温后滴加AgNO3溶液
产生白色沉淀,
则该卤代烃中含有氯元素
B
向2 mL 0.1 ml/L NaOH溶液中加入2 mL 0.1 ml/L MgCl2溶液,再滴加几滴0.1 ml/LFeCl3溶液
先产生白色沉淀,再转化为红褐色沉淀,则Ksp[Mg(OH)2]> Ksp[Fe(OH)3]
C
室温下,用pH试纸分别测试CH3COONa溶液和NaNO2溶液的pH
pH(CH3COONa)=9,pH(NaNO2)=8,
则酸性: HNO2>CH3COOH
D
将氯气通入紫色石蕊溶液中
溶液先变红后褪色,
则氯气具有酸性和漂白性
熔点/℃
沸点/℃
其它
PCl3
-112
75.5
遇水极易水解
POCl3
2
105.3
遇水极易水解
温度/℃
SO2的平衡转化率/%
0.1 MPa
0.5 MPa
1 MPa
5 MPa
10 MPa
450
97.5
98.9
99.2
99.6
99.7
550
85.6
92.9
94.9
97.7
98.3
A
B
C
D
试剂组成
0.4 ml/L KI
0.4 ml/L KI
0.2 ml/L H2SO4
0.2 ml/L H2SO4
0.2 ml/L KI
a ml I2
实验现象
溶液变黄,一段时间后出现浑浊
溶液变黄,出现浑浊较A快
无明显现象
溶液由棕褐色很快褪色成黄色,出现浑浊较A快
题号
1
2
3
4
5
6
7
8
答案
C
D
B
B
D
A
B
D
题号
9
10
11
12
13
14
15
答案
C
A
D
C
C
B
D
湖北省武汉市华中师范大学第一附属中学2023-2024学年高一上学期1月期末化学试题(Word版附答案): 这是一份湖北省武汉市华中师范大学第一附属中学2023-2024学年高一上学期1月期末化学试题(Word版附答案),共12页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
湖北省武汉市华中师范大学第一附属中学2023-2024学年高三上学期11月期中考试化学试题(Word版附答案): 这是一份湖北省武汉市华中师范大学第一附属中学2023-2024学年高三上学期11月期中考试化学试题(Word版附答案),共10页。试卷主要包含了选择题等内容,欢迎下载使用。
【期中真题】湖北省武汉市华中师范大学第一附属中学2022-2023学年高三上学期期中考试化学试题.zip: 这是一份【期中真题】湖北省武汉市华中师范大学第一附属中学2022-2023学年高三上学期期中考试化学试题.zip,文件包含期中真题湖北省武汉市华中师范大学第一附属中学2022-2023学年高三上学期期中考试化学试题原卷版docx、期中真题湖北省武汉市华中师范大学第一附属中学2022-2023学年高三上学期期中考试化学试题解析版docx等2份试卷配套教学资源,其中试卷共31页, 欢迎下载使用。












