

广西贵港市2020-2022三年中考化学真题知识点分类汇编2-化学方程式(含解析)
展开广西贵港市2020-2022三年中考化学真题知识点分类汇编2-化学方程式(含解析)
一、单选题
1.(2021·广西贵港·统考中考真题)铜能与浓硝酸反应,反应的化学方程式为:,则X的化学式是
A.N2O4 B.NO2 C.NO D.N2O
2.(2020·广西贵港·中考真题)推理是学习化学的一种方法。以下推理正确的是
A.质子数决定元素种类,则质子数相同的微粒一定属于同种元素
B.根据质量守恒定律,1g氢气与9g氧气反应一定生成10g水
C.有机物一定含有碳元素,则含碳元素的化合物一定是有机物
D.在室温下,酸性溶液的pH<7,则pH<7的溶液一定是酸性溶液
二、填空题
3.(2022·广西贵港·统考中考真题)端午节是中华民族的传统节日,这一天小美妈妈准备了丰盛的晚餐。
(1)小美一进家门,就闻到粽子的香味,从微观的角度解释闻到香味的原因是____________。包粽子的原料之一是糯米,糯米中富含的营养素是_____________。
(2)妈妈煮菜时用了加碘食盐。人体缺碘可引起_____________。
(3)饭前,小美用酒精消毒液洗手。酒精能杀菌消毒的原因是_____________。
(4)饭后,小美从报纸获悉“2021年9月,中国科学家在《科学》杂志撰文宣告首次实现了由CO2到淀粉【(C6H10O5)n】的人工全合成。”合成淀粉的总反应化学方程式为: ,则m的值为_____________。该技术除有望缓解粮食危机外,还可缓解环境问题中的_____________效应。
4.(2020·广西贵港·中考真题)一包不纯的氯化钾粉末,杂质可能是硫酸钠、氢氧化钠、氯化钠、硝酸钡中的一种或几种。为确定其成分,某兴趣小组的同学进行如下实验:
实验一:取少量该粉末于烧杯中,加蒸馏水,充分搅拌,得到无色澄清溶液,往溶液中通入CO2,产生白色沉淀。
实验二:取14.0g该粉末于烧杯中,加入蒸馏水完全溶解,再加入足量的硝酸银溶液和稀硝酸,充分反应后,产生28.7g白色沉淀。
根据以上信息,回答下列问题:
(1)杂质中一定没有___________,一定有__________。
(2)实验一中产生白色沉淀的化学方程式为_____________。
三、流程题
5.(2022·广西贵港·统考中考真题)要实现“装满‘米袋子’,充实‘菜篮子’”的目标,化肥起到非常重要的作用。工业以煤、空气和水为原料生产碳酸氢铵的一种流程如图所示:
(1)NH4HCO3属于_____________(填“氮”、“磷”、“钾”或“复合”)肥。
(2)“造气”是利用煤、空气和水在一定条件下反应获取CO2、N2和H2,加快“造气”反应速率的具体措施有______________(写一点)。
(3)“合成”是指N2和H2在一定条件下反应生成氨气,反应的化学方程式为______________。
(4)“循环”是指______________(填物质名称)的循环利用。
6.(2022·广西贵港·统考中考真题)纯碱可用于造纸、玻璃生产等领域。纯碱产品中常含有少量的氯化钠杂质,某兴趣小组的同学为测定某品牌纯碱样品中碳酸钠的质量分数,设计了下图方案并进行实验。
(1)滤液B中含有的阳离子有_____________(填化学符号)。
(2)若沉淀不经过操作b会使测定结果_____________(填“偏大”、“偏小”或“无影响”)。
(3)根据以上数据计算该样品中碳酸钠的质量分数(写出计算过程,结果精确至0.1%)。
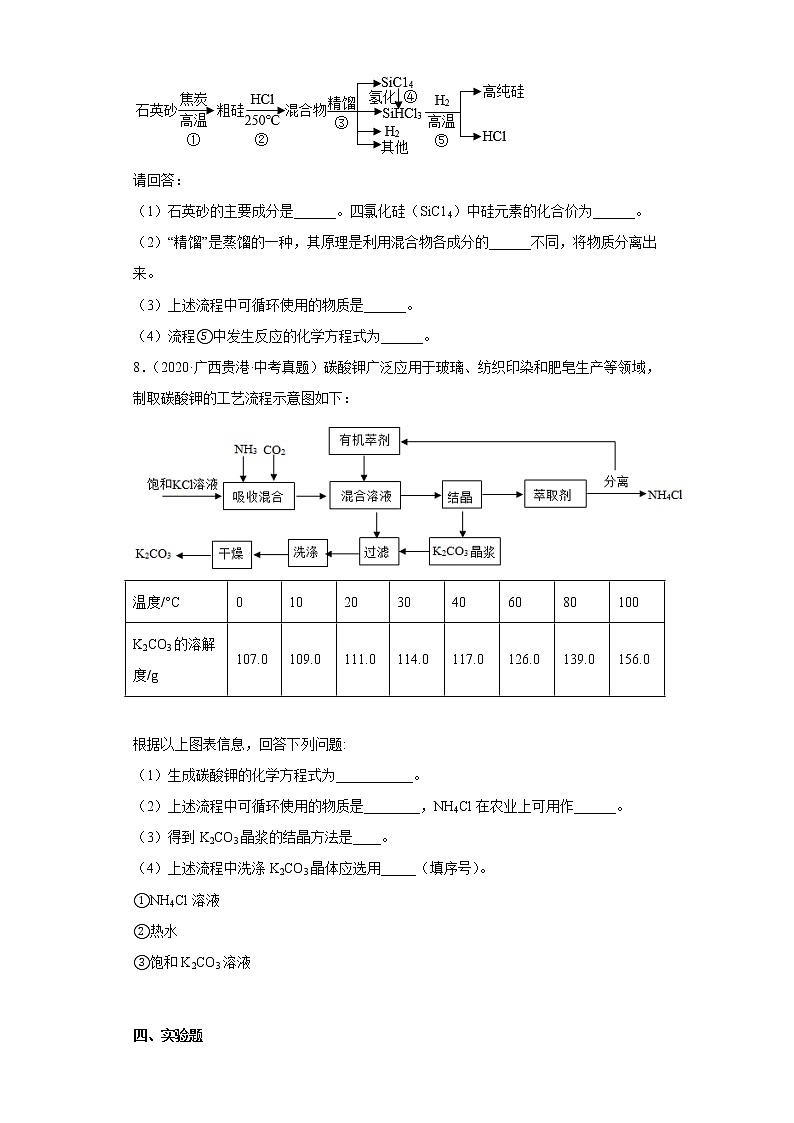
7.(2021·广西贵港·统考中考真题)“太阳能光伏发电”能有效推进“碳中和”,发展“低碳经济”,其关键的材料是高纯硅。以下是高纯硅的简易生产流程。
请回答:
(1)石英砂的主要成分是______。四氯化硅(SiC14)中硅元素的化合价为______。
(2)“精馏”是蒸馏的一种,其原理是利用混合物各成分的______不同,将物质分离出来。
(3)上述流程中可循环使用的物质是______。
(4)流程⑤中发生反应的化学方程式为______。
8.(2020·广西贵港·中考真题)碳酸钾广泛应用于玻璃、纺织印染和肥皂生产等领域,制取碳酸钾的工艺流程示意图如下:
温度/°C | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 100 |
K2CO3的溶解度/g | 107.0 | 109.0 | 111.0 | 114.0 | 117.0 | 126.0 | 139.0 | 156.0 |
根据以上图表信息,回答下列问题:
(1)生成碳酸钾的化学方程式为___________。
(2)上述流程中可循环使用的物质是________,NH4Cl在农业上可用作______。
(3)得到K2CO3晶浆的结晶方法是____。
(4)上述流程中洗涤K2CO3晶体应选用_____(填序号)。
①NH4Cl溶液
②热水
③饱和K2CO3溶液
四、实验题
9.(2022·广西贵港·统考中考真题)下图为实验室常用的实验装置,请回答:
(1)写出标号仪器的名称:①____________,②___________。
(2)实验室常用一种固体和一种液体制取氧气,该反应的化学方程式为____________,氧气能用G装置收集是因为氧气___________溶于水。
(3)若用F装置干燥二氧化碳气体,F装置中应盛装的试剂为___________。
(4)氯气是一种有毒的气体,密度比空气大,能溶于水并与水发生反应。实验室常用浓盐酸和二氧化锰共热制取氯气。为了便于连接尾气处理装置,实验室制取并收集氯气应选择的装置为__________(填装置序号)。
五、计算题
10.(2021·广西贵港·统考中考真题)请根据所示的实验过程和提供的信息作答:
(1)K2CO3中钾、碳、氧元素的质量比为______(写最简比)。
(2)实验结束后溶液中的溶质为______。
(3)实验所用K2CO3溶液的溶质质量分数为______(精确至0.1%)。
(4)计算原混合液中CaCl2的质量分数。(写出计算过程,精确至0.1%)。
11.(2020·广西贵港·中考真题)我市覃塘区石灰石资源丰富,某石灰厂为了测定某石灰石样品中CaCO3的质量分数,往盛有300g稀盐酸的烧杯中依次加入粉碎后的石灰石样品(杂质不与盐酸反应),充分反应后,实验数据记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
石灰石样品/g | 25 | 15 | 10 |
烧杯中物质总质量/g | 316.2 | 326.8 | m |
(1)CaCO3中钙、碳、氧三种元素的质量比为多少;(写最简比)
(2)表中m= ;
(3)所用稀盐酸的溶质质量分数为多少;
(4)求该石灰石样品中CaCO3的质量分数。(写出计算过程)
参考答案:
1.B
【详解】根据质量守恒定律,反应前后原子种类和个数都不变,由方程式知反应物中含有的原子种类及原子个数为Cu,1;H,4;N,4;O,12;已知生成物中含有的原子种类及原子个数为Cu,1;H,4;N,2;O,8;比较分析可知2X中含有原子个数分别为N:2和O:4,故X的化学式为NO2。故选B。
2.D
【详解】A、质子数相同的微粒不一定属于同种元素,如氖原子与水分子中的质子数都是10,但两种微粒就不属于同一种元素,选项错误;
B、氢气与氧气燃烧时,参加反应的两种物质的质量比=4:32,则1g氢气与9g氧气反应时,参加反应的氧气的质量为8g,生成水的质量为9g,选项错误;
C、含碳元素的化合物不一定是有机物,如CO、CO2虽然含有碳元素,但其化学性质与无机物相似,属于无机物,选项错误;
D、由pH于溶液酸碱性的关系可知,酸性溶液的pH<7,pH<7的溶液一定是酸性溶液,选项正确,故选D。
3.(1) 微粒在不断运动 糖类
(2)甲状腺疾病
(3)酒精能使蛋白质变性
(4) 12n 温室
【解析】(1)能闻到菜香,从微观角度考虑是微粒在不断运动,带有香味的分子运动到人的鼻子,使人闻到气味,故填:微粒在不断运动;糯米的主要成分是淀粉,属于营养物质中的糖类,故填:糖类;
(2)缺碘会引起甲状腺疾病,故填:甲状腺疾病;
(3)酒精能使蛋白质变性,达到杀菌消毒的目的,故填:酒精能使蛋白质变性;
(4)根据化学反应前后原子个数不变,反应后共有10n+14n个氢原子,可推测m=12n,合成淀粉消耗二氧化碳,能够减少温室效应,故填:12n;温室。
4. 硫酸钠 氢氧化钠、硝酸钡、氯化钠
【详解】实验一:
取少量该粉末于烧杯中,加蒸馏水,充分搅拌,得到无色澄清溶液,不可能同时含有硫酸钠和硝酸钡,往溶液中通入CO2,产生白色沉淀,可知一定含氢氧化钠和硝酸钡,二氧化碳先与氢氧化钠反应生成碳酸钠和水,碳酸钠与硝酸钡反应生成碳酸钡沉淀和硝酸钠,则一定不含硫酸钠。
实验二:
取14.0g该粉末于烧杯中,加入蒸馏水完全溶解,再加入足量的硝酸银溶液和稀硝酸,充分反应后,产生28.7g白色沉淀,不溶于稀硝酸的白色沉淀为氯化银,氯离子只能来自氯化钾或氯化钠;
设14g氯化钾与硝酸银充分反应生成氯化银沉淀的质量为x,则
27
解得x=27g<28.7g;
设14g氯化钠与硝酸银充分反应生成氯化银沉淀的质量为y,则
34.3
解得y=34.3g>28.7g;可知一定含有氯化钠;
(1)综上所述,杂质中一定含氢氧化钠、硝酸钡、氯化钠,一定不含硫酸钠。
(2)实验一中产生白色沉淀的反应为碳酸钠与硝酸钡反应生成碳酸钡沉淀和硝酸钠,反应的化学方程式为。
5.(1)氮
(2)将煤粉碎(或适当提高温度等)
(3)
(4)氮气、氢气
【详解】(1)碳酸氢铵中含有植物所需的氮元素,属于氮肥,故填:氮;
(2)加快反应速率可以增大反应物的接触面积、升高温度、加入催化剂等,考虑气体和固体反应,故填:将煤粉碎(或适当提高温度等);
(3)反应物是氮气和氢气,生成氨气,故填:;
(4)根据碳酸化的反应物和生成物可以推测发生的反应方程式为,氮气、氢气没有参加反应,可以继续在后面用于合成氨,在合成氨这一步中没有反应完的氮气和氢气可以循环利用,故填:氮气、氢气。
6.(1)Ca2+、Na+
(2)偏大
(3)设该样品中碳酸钠的质量为x。
该样品中碳酸钠的质量分数为。
答:该样品中碳酸钠的质量分数为88.3%。
【详解】(1)纯碱产品中常含有少量的氯化钠杂质,加水溶解,加入过量氯化钙溶液,氯化钙和碳酸钠反应生成碳酸钙和氯化钠,则滤液B中含有的溶质为氯化钙和氯化钠,阳离子有钠离子和钙离子,化学符号为Ca2+、Na+。
(2)沉淀是碳酸钙,经过过滤操作,带有水分,需要将水分蒸发掉,则若沉淀不经过操作b会使碳酸钙质量偏大,通过化学方程式计算得到的碳酸钠的质量偏大,故会使测定结果偏大。
(3)见答案。
7. 二氧化硅 +4 沸点 HCl和H2
【详解】(1)石英砂的主要成分是二氧化硅,还含有一些其他杂质;四氯化硅的化学式为SiCl4,四氯化硅中氯元素的化合价显-1价,设SiCl4中硅元素的化合价为,根据化合物中正负化合价的代数和为零,可得:,即四氯化硅中硅元素的化合价为+4价。故分别填:二氧化硅;+4。
(2)蒸馏可把混合物分离,原理是利用混合物各成分的沸点不同;故填:沸点。
(3)根据生产流程可知,流程②中加入HCl,在流程⑤中有HCl生成,故HCl可以循环使用;流程③中有H2生成,流程⑤中H2参与反应,故H2可以循环使用。故填:HCl和H2。
(4)根据生产流程可知,流程⑤中是SiHCl3和氢气在高温条件下生成硅和HCl,反应的化学方程式为:。
8. 有机萃剂 氮肥 蒸发结晶 ③
【详解】(1)由图可知,饱和氯化钾溶液和氨气、二氧化碳反应生成碳酸钾和氯化铵,该反应的化学方程式为:;
(2)由图可知,上述流程中可循环使用的物质是有机萃剂;
氯化铵含氮元素,可做氮肥;
(3)由表中数据可知,碳酸钾的溶解度受温度影响不大,得到K2CO3品浆的结晶方法是:蒸发结晶;
(4)①NH4Cl溶液还可以继续溶解碳酸钾,不能用来洗涤碳酸钾,不符合题意;
②热水能溶解碳酸钾,不能用来洗涤碳酸钾,不符合题意;
③饱和K2CO3溶液不能继续溶解碳酸钾,可用来洗涤碳酸钾,符合题意。
故选③。
9.(1) 酒精灯 长颈漏斗
(2)
不易
(3)浓硫酸
(4)CFH
【解析】(1)①是酒精灯,②是长颈漏斗。
(2)实验室常用一种固体和一种液体制取氧气是使用过氧化氢和二氧化锰制取氧气,二过氧化氢在二氧化锰的催化作用下分解生成水和氧气,化学方程式为。G是排水法,能用排水法收集的气体需要难溶于水或不易溶于水。氧气能用G装置收集是因为氧气不易溶于水。
(3)F中可存放液体干燥剂。浓硫酸具有吸水性且不和二氧化碳反应,可用浓硫酸干燥二氧化碳气体,所以F装置中应盛装的试剂为浓硫酸。
(4)实验室常用浓盐酸和二氧化锰共热制取氯气,是固体和液体加热制取气体,发生装置选择C。氯气密度比空气大,能溶于水并与水发生反应,则不能用排水法收集,可使用向上排空气法收集,可选DF。氯气是一种有毒的气体,要便于连接尾气处理装置,则选择F从长管通入收集氯气,短管接H,利用水或其他试剂吸收过量的有毒的氯气,所以应选择的装置为CFH。
10.(1)13:2:8
(2)氯化钾和碳酸钾(或KCl和K2CO3)
(3)13.8%
(4)解:该反应过程中一共生成10g碳酸钙沉淀,设原混合液中CaCl2的质量为,则:
所以,原混合液中CaCl2的质量分数为:
答:原混合液中CaCl2的质量分数为11.1%。
【详解】(1)K2CO3中钾、碳、氧元素的质量比为:,故填:13:2:8。
(2)向HCl和CaCl2混合溶液中加入K2CO3溶液,K2CO3先与HCl反应生成氯化钾、水和二氧化碳,待HCl完全反应后,K2CO3再与CaCl2反应生成碳酸钙沉淀和氯化钾,根据图示信息,第一次加入50gK2CO3溶液,烧杯中有2.5g沉淀,即HCl已经完全反应完;第二次加入50gK2CO3溶液,烧杯中有7.5g沉淀,即50gK2CO3溶液生成5g碳酸钙沉淀,理论上30gK2CO3溶液能生成3g碳酸钙沉淀;第三次加入30gK2CO3溶液,烧杯中有10g沉淀,即30gK2CO3溶液生成碳酸钙沉淀为2.5g<3g,所以,此时氯化钙完全反应,K2CO3溶液过量。实验结束后溶液中的溶质有:反应生成的氯化钾,还有过量的碳酸钾;故填:氯化钾和碳酸钾(或KCl和K2CO3)。
(3)第二次向烧杯中加入50gK2CO3溶液,生成碳酸钙沉淀的质量为:,设生成5g碳酸钙沉淀需要K2CO3的质量为,则:
实验所用K2CO3溶液的溶质质量分数为:。故填:13.8%。
(4)见答案。
11.10:3:12;336.8;7.3%;80%
【详解】(1)CaCO3中钙、碳、氧三种元素的质量比为40:12:(16×3)=10:3:12;
第一次:生成二氧化碳的质量为25g+300g-316.2g=8.8g;设第一次加入25g样品中碳酸钙的质量为x,则
解得x=20g;
该石灰石样品中CaCO3的质量分数为;
第二次加入15g样品后,设生成二氧化碳的质量y,消耗稀盐酸溶质质量为z,则
,
解得y=5.28g
而实际上第一、第二次生成二氧化碳的质量为300g+25g+15g—326.8g=13.2g<8.8g+5.28g,故第二次稀盐酸已经不足,则第三次加入10g样品不反应,m值为336.8g;
设生成13.2g二氧化碳需要HCl的质量为z,
则所用稀盐酸的溶质质量分数为;
答:CaCO3中钙、碳、氧三种元素的质量比为10:3:12;表中m=336.8;所用稀盐酸的溶质质量分数为7.3%;该石灰石样品中CaCO3的质量分数为80%。
2020-2022广西贵港市中考化学三年真题知识点分类汇编9-盐和化肥(含解析): 这是一份2020-2022广西贵港市中考化学三年真题知识点分类汇编9-盐和化肥(含解析),共21页。试卷主要包含了单选题,多选题,填空题,推断题,流程题,实验题,科学探究题,计算题等内容,欢迎下载使用。
2020-2022广西贵港市中考化学三年真题知识点分类汇编8-酸和碱、中和反应(含解析): 这是一份2020-2022广西贵港市中考化学三年真题知识点分类汇编8-酸和碱、中和反应(含解析),共12页。试卷主要包含了单选题,推断题,实验题,科学探究题等内容,欢迎下载使用。
2020-2022广西贵港市中考化学三年真题知识点分类汇编7-水、溶液(含解析): 这是一份2020-2022广西贵港市中考化学三年真题知识点分类汇编7-水、溶液(含解析),共14页。试卷主要包含了单选题,填空题,流程题,计算题等内容,欢迎下载使用。












