



- 2022太原高三上学期期末考试政治试题含解析 试卷 1 次下载
- 2022太原高三上学期期末考试地理试题含解析 试卷 0 次下载
- 2022太原高三上学期期末考试历史试题含解析 试卷 0 次下载
- 2022太原高三上学期期末考试生物试题含解析 试卷 0 次下载
- 2022太原高三上学期期末考试物理试题含解析 试卷 0 次下载
2022太原高三上学期期末考试化学试题含解析
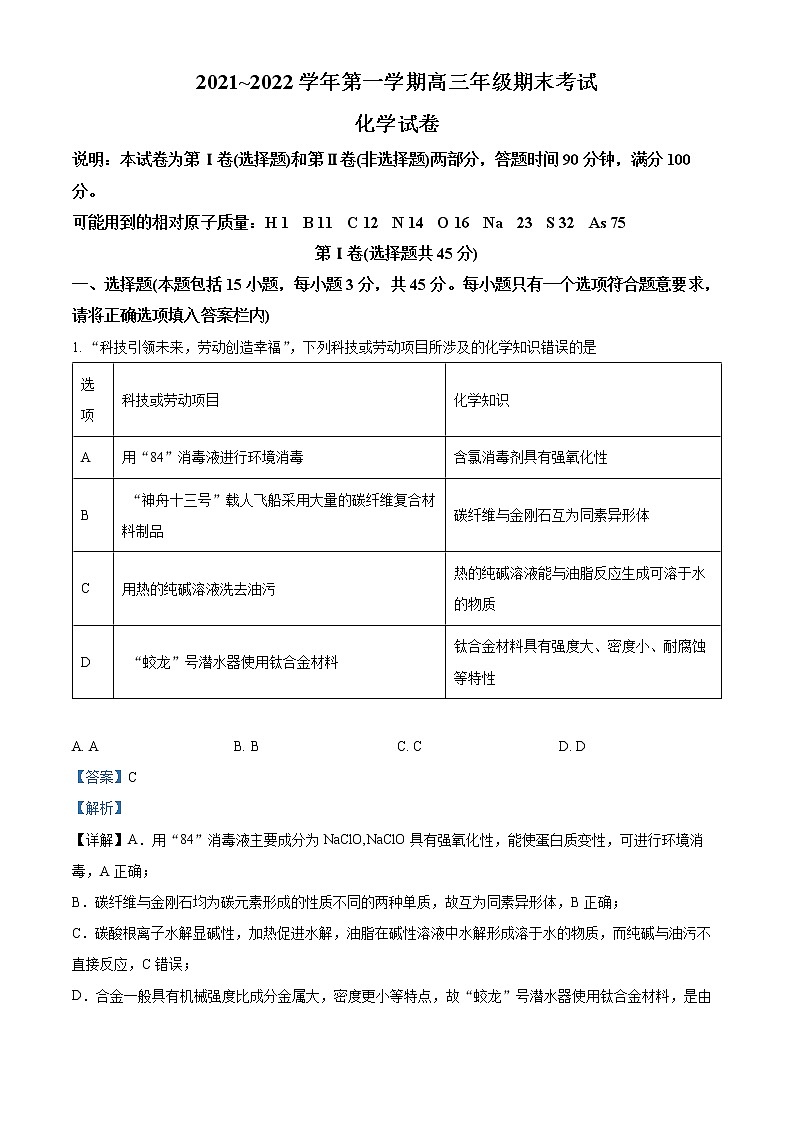
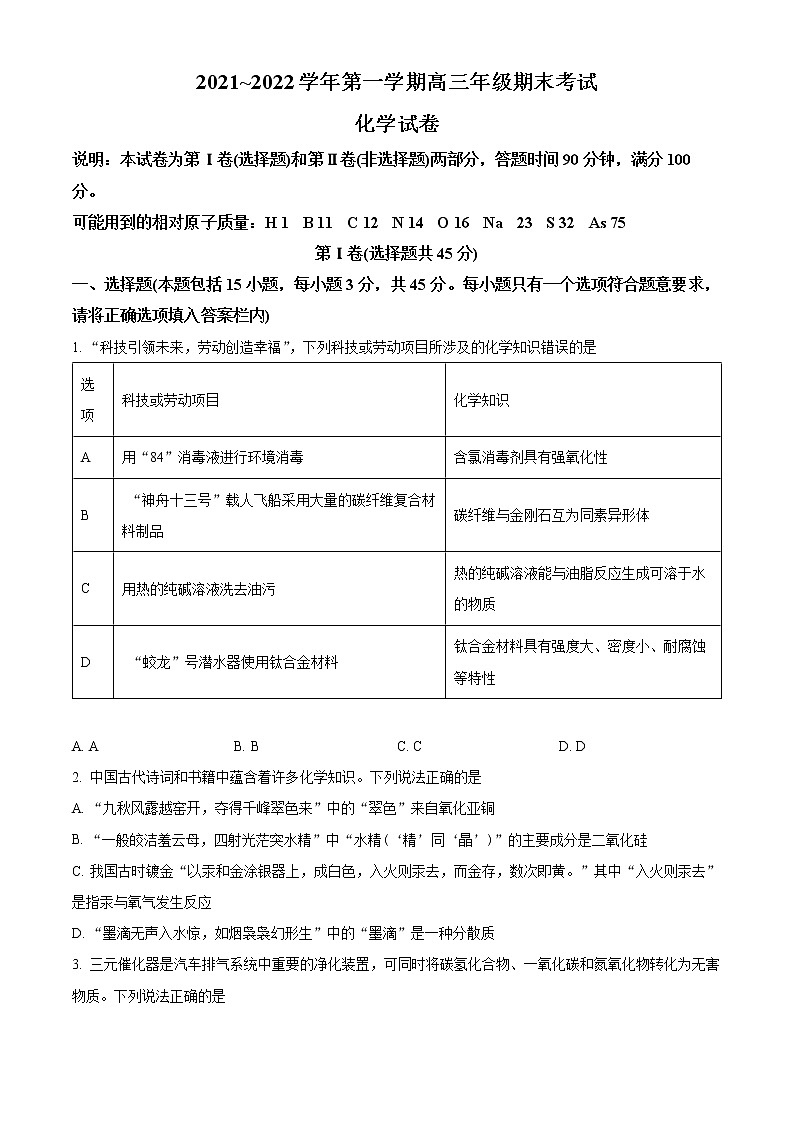
展开2021~2022学年第一学期高三年级期末考试
化学试卷
说明:本试卷为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,答题时间90分钟,满分100分。
可能用到的相对原子质量:H 1 B 11 C 12 N 14 O 16 Na 23 S 32 As 75
第Ⅰ卷(选择题共45分)
一、选择题(本题包括15小题,每小题3分,共45分。每小题只有一个选项符合题意要求,请将正确选项填入答案栏内)
1. “科技引领未来,劳动创造幸福”,下列科技或劳动项目所涉及的化学知识错误的是
选项 | 科技或劳动项目 | 化学知识 |
A | 用“84”消毒液进行环境消毒 | 含氯消毒剂具有强氧化性 |
B | “神舟十三号”载人飞船采用大量的碳纤维复合材料制品 | 碳纤维与金刚石互为同素异形体 |
C | 用热的纯碱溶液洗去油污 | 热的纯碱溶液能与油脂反应生成可溶于水的物质 |
D | “蛟龙”号潜水器使用钛合金材料 | 钛合金材料具有强度大、密度小、耐腐蚀等特性 |
A. A B. B C. C D. D
2. 中国古代诗词和书籍中蕴含着许多化学知识。下列说法正确的是
A. “九秋风露越窑开,夺得千峰翠色来”中的“翠色”来自氧化亚铜
B. “一般皎洁羞云母,四射光茫突水精”中“水精(‘精’同‘晶’)”的主要成分是二氧化硅
C. 我国古时镀金“以汞和金涂银器上,成白色,入火则汞去,而金存,数次即黄。”其中“入火则汞去”是指汞与氧气发生反应
D. “墨滴无声入水惊,如烟袅袅幻形生”中的“墨滴”是一种分散质
3. 三元催化器是汽车排气系统中重要的净化装置,可同时将碳氢化合物、一氧化碳和氮氧化物转化为无害物质。下列说法正确的是
A. CO2的电子式为 B. CH4的球棍模型为
C. N2的结构式为N≡N D. 乙烯的结构简式为CH2CH2
4. 化学符号是连接宏观与微观的桥梁。下列过程对应的离子方程式正确的是
A. 向氯化钙溶液中通入少量的二氧化碳气体:Ca2++H2O +CO2= 2H++ CaCO3↓
B. 用草酸溶液滴定KMnO4溶液:2+ 16H++5= 2Mn2++10CO2↑+8H2O
C. 醋酸钠溶于水显碱性:H2O +CH3COO- = OH-+ CH3COOH
D. 向硫酸氢钠溶液中滴加氢氧化钡溶液至溶液呈中性:2H+++Ba2++2OH-= 2H2O+BaSO4↓
5. 粉煤灰中水化活性最高的组分是CaО和MgO,其次是Al2O3,最差的是SiO2。下列说法正确的是
A. 碱性:Ca(OH)2>Mg(OH)2>Al(OH)3
B. 工业上常采用电解熔融的MgO、Al2O3得到对应的金属单质
C. 因还原性:C>Si,故工业上可由SiO2和焦炭制取粗硅
D. CaO 、MgO和Al2O3均属于碱性氧化物,SiO2属于酸性氧化物
6. 下列实验装置正确且能达到相应实验目的的是(部分夹持仪器已略去)
A | B | C | D |
制取碳酸氢钠 | 配制2 mol/L的稀硫酸 | 制备并检验SO2气体 | 比较元素的非金属性:Cl>C>Si |
A. A B. B C. C D. D
7. 2021年诺贝尔生理学或医学奖颁发给了发现温度和触觉感受器的两位科学家,其中温度感受器的发现与辣椒素有关。已知辣椒素的结构如图所示,下列有关辣椒素说法错误的是
A 分子式:C18H27NO3
B. 可以发生取代、加成、氧化反应
C. 可与NaOH溶液反应
D. 1 mol辣椒素最多可与5 mol氢气发生加成反应
8. 已知HNO2在低温下较稳定,酸性比醋酸略强,既有还原性又有氧化性,其氧化产物、还原产物与溶液pH的关系如下表。下列有关说法错误的是
pH范围 | >7 | <7 |
产物 | NO、N2O、N2中的一种 |
A. 碱性条件下,NaNO2与NaClO反应的离子方程式为+ ClO- =+Cl-
B. 向冷的NaNO2溶液中加入滴有淀粉的氢碘酸,若溶液变蓝色,则证明氧化性:HNO2>I2
C. 向冷的NaNO2溶液中通入SO2最终可得到HNO2
D. 低温时不用其他试剂即可区分HNO2溶液与Na2CO3溶液
9. 设NA为阿伏加德罗常数的值,根据氯元素的“价-类”二维图,下列分析正确的是
A. 标准状况下,1.12 L CCl4所含共价键数为2NA
B. 由“价-类”二维图推测ClONO2可能具有强氧化性,1 mol ClONO2水解生成两种酸时,转移电子数1NA
C. 工业上用NaClO3和SO2制备1 mol ClO2时,消耗SO2分子数0.5NA
D. 1 L 1 mol/LNaClO溶液中含有ClO-数为1NA
10. 2021年11月,我国“祝融号”火星车与欧洲“火星快车”实现太空“握手”,火星首次留下中国印迹。经探测研究发现,火星地表的土壤岩石中富含A、B、C、D、E五种原子序数依次增大的短周期主族元素,其中A、E为同一主族元素,且E的最高正化合价和最低负化合价的代数和是4,B与E的原子所含质子数之和是D原子所含质子数的两倍,火星岩石中存在大量的化合物BDA3。下列说法错误的是
A. 单质B能与热水反应,所得溶液呈弱碱性
B. 简单氢化物的稳定性:D<E<A
C. 含C元素的盐溶液可能显碱性
D. 简单离子半径:E>B>A
11. 中国将提高国家自主贡献力度,采取更加有力的政策和措施,力争于2030年前实现碳达峰,2060年前实现碳中和。我国科学家研发了一种水系可逆Zn—CO2电池,电池工作时,复合膜(由a、b膜复合而成)层间的H2O解离成H+和OH-,在外加电场中可透过相应的离子膜定向移动。当闭合K1时,Zn—CO2电池工作原理如图所示。下列说法不正确的是
A. 闭合K1时,Pd电极电势高于Zn电极电势
B. 闭合K1时,Pd表面的电极反应式为CO2+ 2H+-2e-=HCOOH
C. 闭合K2时,OH-通过b膜向Pd电极方向移动
D. Pd电极还具有高效双催化性能,有利于CO2和HCOOH的相互转化
12. 用含铁废铜制备胆矾晶体的流程如下图所示:
下列说法错误的是
A. “溶解”时延长浸泡时间,可以提高铜的浸出速率
B. 流程中Cu2(OH)2CO3可用CuO代替
C. 常温下,流程中pH=3时,c(Cu2+)·c2(OH-)<Ksp[Cu(OH)2]
D. “系列操作”前加入H2SO4的目的是抑制Cu2+的水解
13. 科学家采用基于金属钌的催化剂,将从空气中捕获的二氧化碳转化为甲醇,总反应为CO2+3H2 CH3OH+H2O,其反应过程如图所示。下列说法正确的是
A. 反应过程中氮的成键数目没有变化
B. 反应过程中伴随极性键的断裂和形成
C. 是中间产物
D. 反应过程中物质M代表H2O
14. 已知反应( aq)+2I-(aq)2(aq)+I2(aq),若向该溶液中加入含Fe3+的某溶液,反应机理如图所示。下列有关说法错误的是
①2Fe3+(aq)+2I-(aq)I2(aq)+2Fe2+(aq)
②2Fe2+( aq)+(aq)=2Fe3+(aq)+2(aq)
A. 反应①和反应②相比,反应②更快
B. Fe3+是该反应的催化剂
C. 增大Fe3+的浓度,能够加快反应速率
D. 若不加Fe3+,正反应的活化能比逆反应的活化能大
15. 常温下,向20 mL 0.2 mol/LHA(Ka=1×10-4.7)溶液中逐滴滴加0.2 mol/LNaOH溶液,溶液pH变化曲线如图所示。下列说法错误的是
A. ①②③点溶液中,水的电离程度最大的是②
B. ①点溶液中c(A-)+ c(HA) = 2c(Na+)
C. ②点溶液中:c(A-)= c(Na+)
D. ③点溶液的pH约为8.85
第Ⅱ卷(非选择题共55分)
二、必做题(本题包括4小题,共40分)
16. 含氯消毒剂和过氧化物消毒剂均可有效灭杀新冠病毒。
Ⅰ.过碳酸钠(2Na2CO3·3H2O2)俗称固态双氧水,具有去污、杀菌等功效。其制备原理:2Na2CO3(aq)+3H2O2(aq)=2Na2CO3·3H2O2(aq) △H<0。
(1)结合过氧化氢和碳酸钠的性质,推测制备过碳酸钠的过程中,碳酸钠与过氧化氢的物质的量之比应小于2:3,且加入Na2CO3溶液速率不能过快的原因是_______。
(2)过碳酸钠的储存稳定性是重要的品质指标。以不同种类的稳定剂制备的过碳酸钠产品,测得其活性氧的质量分数随时间变化如图所示。由图可知,制备过碳酸钠时应选择的稳定剂是_______。(填图中字母)
Ⅱ.NaClO2是一种更为安全有效的清洗﹑杀菌剂,特别是在NaClO使用受限制的场合,NaClO3是NaClO的安全代用品。
(3)工业上用石墨电极电解ClO2、NaCl溶液制备NaClO3。写出该反应的离子方程式:_______。
17. 某学习小组用下图所示实验装置探究SO2与Fe(NO3)3溶液的反应(夹持仪器已省略)。
回答下列问题:
(1)仪器X的名称是_______。
(2)滴加浓硫酸之前,先通一段时间CO2,其目的是_______。
(3)装置A中的分液漏斗可改成如图所示的恒压滴液漏斗,其优点是_______。
(4)开始实验后,若把少量SO2通入Fe(NO3)3溶液,装置B中溶液由棕黄色变为浅绿色,但立即又变为棕黄色,该过程可用化学用语表征为_______。
(5)测定反应后装置B溶液中Fe2+的浓度时(只考虑Fe2+与KMnO4的反应),用0.01000 mol/L的酸性KMnO4溶液滴定20.00 mL B中溶液,平均消耗酸性KMnO4溶液的体积为15.00 mL,则B中c(Fe2+)=_______。
18. 三氧化二镍(Ni2O3)是一种灰黑色、无气味、有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料生产NiCl2,继而生产Ni2O3,其工艺流程如下:
已知:①下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol/L计算)。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 3.0 | 6.7 |
沉淀完全的pH | 3.2 | 9.0 | 4.7 | 9.2 |
②25℃时,Ksp(NiCO3)= 1×10-6
回答下列问题:
(1)“酸浸”过程中,l mol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式:_______。
(2)“酸浸”后的酸性溶液中加入H2O2的目的是_______ 。
(3)“沉镍”前需加NaOH控制溶液pH的范围为_______;“滤渣1”的主要成分有_______。
(4)“氧化”时生成Ni2O3的离子方程式为_______。
(5)保持其他条件不变,在不同温度下对含镍废料进行“酸浸”,镍的浸出率随时间变化如图。“酸浸”的最佳温度与时间分别为_______℃、_______min。
(6)“沉镍”过程中,若滤液中c(Ni2+)= 2.0 mol/L,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤1×10-5mol/L],则需要加入Na2CO3固体的质量最少为_______。(不考虑水解,计算结果保留两位小数)
19. 以NOx为主要成分的雾霾综合治理是当前重要的研究课题,其中汽车尾气的处理尤为重要。请回答下列问题:
(1)NO和CO均为汽车尾气的成分,在催化转换器中二者可发生反应2CO(g)+2NO(g)=N2(g)+2CO2(g)减少尾气污染。
①已知:N2(g)+O2(g)= 2NO(g) △H= a kJ/mol
C(s)+O2(g)= CO2(g) △H = b kJ/mol
2C(s)+O2(g) = 2CO(g) △H = c kJ/mol
则2CO(g)+2NO(g)=N2(g)+2CO2(g) △H =_______(用含a、b、c的表达式表示)。
②某研究小组探究催化剂对CO、NO转化的影响。将CO和 NO以一定的流速通过两种不同的催化剂Ⅰ和Ⅱ进行反应,相同时间内测量逸出气体中N2的含量,从而确定尾气脱氮率(即NO的转化率)结果如图(对应曲线Ⅰ和Ⅱ)所示。由图可知:要达到最大脱氮率,应采取的最佳实验条件为_______;若低于200℃,图中曲线Ⅰ脱氮率随温度升高变化不大的主要原因为_______。
(2)①在500℃时,向恒容密闭体系中通入1 mol NO和 1 mol CO进行反应2CO(g)+ 2NO(g)N2(g)+ 2CO2(g)时,下列描述能说明反应达到平衡状态的是_______。(填字母)
A.单位时间内,断裂2 mol C=O键同时生成1 mol N≡N键
B.体系中混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CO与NO的转化率比值不再改变
②一定温度下,向恒容容器中通入等物质的量的NO和CO气体,测得容器中压强随时间的变化关系如表所示:
t/min | 0 | 1 | 2 | 3 | 4 | 5 |
p/kPa | 200 | 185 | 173 | 165 | 160 | 160 |
该条件下反应的平衡常数Kp=_______(kPa)-1(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(3)间接电化学法可对NO进行无害化处理,其工作原理如图所示,为使电解产物全部转化为NH4NO3,需要补充物质A,A是_______,理由是_______。
三、选做题(以下两题任选一题作答)
【选修3:物质结构与性质】
20. 半导体砷化硼具有超高的导热系数,有助于电子器件降温散热。回答下列问题:
(1)基态硼原子的价电子排布式为_______,根据“对角线规则”,硼的性质与_______(填名称)相似。
(2)实验测得,砷的第一电离能大于硒的第一电离能,原因是_______。
(3)三氧化二砷的分子结构如图所示,其中砷原子的杂化方式是_______,1 mol As4O6中含有的σ键数目为_______。
(4)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),则H、B、N电负性由大到小的顺序是_______。
(5)氢化物的沸点:SbH3>NH3>AsH3,其理由是_______。
(6)砷化硼的晶胞结构如图(a)所示,图(b)中矩形AA'C'C是沿如图(a)放置的晶胞对角面取得的截图。
①若该晶体的密度为a g/cm3,设B和As的原子半径分别为rB pm和rAs pm,则原子的空间占有率为_______×100%(列出计算表达式,阿伏加德罗常数的值为NA)。
②晶胞中各原子在矩形AA'C'C中的位置为_______(填“甲”、“乙”、“丙”、“丁”)。
甲. 乙.
丙. 丁.
【选修5:有机化学基础】
21. 以葡萄糖为原料制得的山梨醇(A)和异山梨醇(B)都是重要的生物质转化平台化合物。E是一种治疗心绞痛的药物,由葡萄糖为原料合成E的过程如下:
回答下列问题:
(1)葡萄糖中含有的官能团是_______(填名称),A的分子式为_______。
(2)由B到C的化学方程式为_______。
(3)D的结构简式为_______,D→E的反应类型为_______。
(4)F是B的同分异构体,7.30 g的F与足量饱和碳酸氢钠溶液反应可释放出2.24 L二氧化碳(标准状况),F的可能结构共有_______种(不考虑立体异构)。其中核磁共振氢谱为三组峰,峰面积之比为3:1 :1的结构简式为_______。
(5)合成中反应③和反应⑤的目的是:_______。
(6)写出由环己烯制备1,4-环己二醇的合成线路(其他无机试剂任选):____。(提示:卤代烃易被H2还原)
2022太原高一上学期期末考试化学试题含解析: 这是一份2022太原高一上学期期末考试化学试题含解析,文件包含山西省太原市2021-2022学年高一上学期期末考试化学试题含解析docx、山西省太原市2021-2022学年高一上学期期末考试化学试题docx等2份试卷配套教学资源,其中试卷共25页, 欢迎下载使用。
2022-2023学年山西省太原市第五中学校高三上学期期末考试化学试题含解析: 这是一份2022-2023学年山西省太原市第五中学校高三上学期期末考试化学试题含解析,共25页。试卷主要包含了单选题,实验题,工业流程题,原理综合题,有机推断题等内容,欢迎下载使用。
山西省太原市2022-2023学年高三上学期期末考试化学试题: 这是一份山西省太原市2022-2023学年高三上学期期末考试化学试题,文件包含山西省太原市2022-2023学年高三上学期期末考试化学试题pdf、太原市2022-2023学年第一学期期末高三化学答案pdf等2份试卷配套教学资源,其中试卷共7页, 欢迎下载使用。